子宫腺肌病合并脑梗死、肾梗死1例
杨进玉,杨永瑞
(平邑县中医医院 a.脑病科;b.临床药学科,山东 临沂 273300)
子宫腺肌病是指子宫内膜(包括腺体和间质)侵入子宫肌层生长而产生的良性病变。该病发病机制尚未明确,临床上以月经过多、严重痛经、不孕等为表现,以及糖类抗原125(carbohydrate antigen 125,CA125)、CA199、D-二聚体水平在月经期升高、月经期后迅速下降等为特点[1]。可能是由于血清D-二聚体水平升高常提示患者血液的高凝状态,子宫腺肌病患者发生静脉系统血栓栓塞的风险升高,已经受到临床重视[2-3]。不仅如此,新近的研究还发现部分子宫腺肌病患者可以发生脑梗死[4-5],即子宫腺肌病还可能导致患者动脉系统血栓栓塞。子宫腺肌病同时发生脑梗死、肾梗死的病例尚未见报道,本文报道1例该病例,以提高对子宫腺肌病合并动脉系统血栓栓塞这一病理现象的认知。
1 病例介绍
患者,女,51岁,因“突发左侧肢体活动不灵1 h”于2020年1月25日13:30(经期第2天)入院。既往有子宫肌瘤病史2 a。平素月经规律,周期30 d,经期 6~7 d,量中等,色暗红,无血块及痛经。近2 a来出现经期腹痛,经量增多(1~2倍),持续7 d左右,色暗红,夹血块,未予诊治。无高血压、糖尿病及其他病史可查,无烟酒嗜好,无重要家族史。入院查体:体温36.3 ℃,心率80次·min-1,呼吸20次·min-1,血压140/85 mmHg(1 mmHg=0.133 kPa),心肺听诊无异常。神经系统查体:神志清,言语流利,计算力、定向力正常,颅神经检查无异常,左侧肌张力低,左上肢肌力2级,左下肢肌力4级,右上下肢肌力肌张力正常,双侧腱反射对称,Babinski征左(+)右(-),Chaddock征左(+)右(-),左侧偏身痛觉减退。美国国立卫生研究院卒中量表(the National Institutes of Health stroke scale,NIHSS)评分5分。实验室检查:血红蛋白125 g·L-1,红细胞3.57×1012L-1,血小板194×109L-1,白细胞6.32×109L-1,中性粒细胞43.5%;血糖5.9 mmol·L-1,甘油三酯1.65 mmol·L-1,总胆固醇4.24 mmol·L-1,低密度脂蛋白2.9 mmol·L-1,同型半胱氨酸9.36 μmol·L-1, D-二聚体5.16 mg·L-1(正常值0~0.5 mg·L-1),CA125 1 563 U·mL-1(正常值0~35 U·mL-1,1 U=16.67 nkat), 红细胞沉降率、C反应蛋白、脂蛋白磷脂酶A2、中枢神经特异性蛋白、癌胚抗原、甲胎蛋白等肿瘤标志物均在正常范围,抗核抗体谱阴性。颅脑磁共振成像(magnetic resonance imaging,MRI)显示双侧额顶枕叶、右侧颞叶、右侧小脑半球T2加权成像、弥散加权成像(diffusion weighted imaging,DWI)序列均呈高信号,相应表观扩散系数(apparent diffusion coeffecient,ADC)呈低信号(图1);头颈部CT血管成像(computed tomography angiography,CTA)未见明显异常;颈动脉超声、经胸及经食道超声心动图无明显异常,经颅多普勒超声发泡试验阴性。CT腹部平扫、强化示:(1)子宫多发占位并右侧输尿管受压,考虑子宫腺肌病;(2)左肾低密度灶,考虑肾囊肿。诊断脑梗死。因患者拒绝接受静脉溶栓,给予抗栓、降脂等治疗,症状减轻,肌力恢复至左上肢5级,左下肢正常,2月 7日复查颅脑磁共振DWI图像示双侧额顶枕叶、右侧颞叶病灶吸收好转(图2)。2月8日好转,带阿司匹林、氯吡格雷、阿托伐他汀钙、丁苯酞等出院口服。2020年2月10日在平邑县中医医院康复科行康复治疗,2月24日(经期第2天)出现右上肢活动不灵,伴头昏,视物模糊,转入脑病科,查体神志清,颅神经检查无异常,右上肢肌力3级,右下肢肌力5级,左上下肢肌力肌张力正常,双侧腱反射对称,Babinski征右(+)左(-),Chaddock征右(+)左(-),右侧偏身痛觉减退,NIHSS评分3分;颅脑核磁共振DWI示双侧额顶枕叶、左侧基底节区、双侧放射冠区、右侧小脑半球散在点片状高信号,较1月26日片可见新发高信号(图3)。胸腹部CT平扫、增强示:(1)双肾楔形低密度灶,考虑肾梗死(图4);(2)考虑子宫腺肌症合并子宫肌瘤;心脏、双侧下肢动静脉系统超声无异常;动态心电图显示偶发房性早搏。血红蛋白116 g·L-1,D-二聚体1.90 mg·L-1,CA125 336.8 U·mL-1,生化血脂正常。诊断为:(1)脑梗死复发;(2)肾梗死;(3)子宫腺肌病。给予低分子肝素钠0.4 mL,皮下注射,每12 h 1次,共治疗18 d,于3月12日出院。3月17日入平邑县中医医院妇科住院,术前CA125 293 U·mL-1,3月19日行子宫切除术,术后病理报告为子宫腺肌病(图5)。术后第2天给予低分子肝素抗凝,3月21日复查D-二聚体0.06 mg·L-1,CA125 114 U·mL-1,3月29日复查D-二聚体0.01 mg·L-1,CA125 74.2 U·mL-1,停用低分子肝素,7月21日复查D-二聚体0.01 mg·L-1,CA125 12.2 U·mL-1,随访至今,未再复发。

图1 首次发病时颅脑DWI
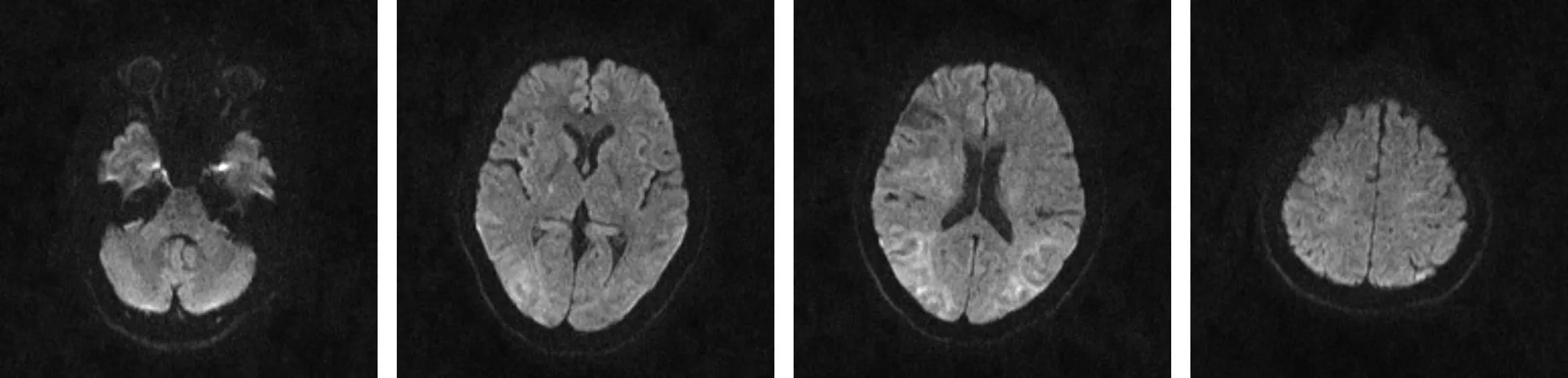
图2 发病第13天颅脑DWI

图3 复发时颅脑DWI
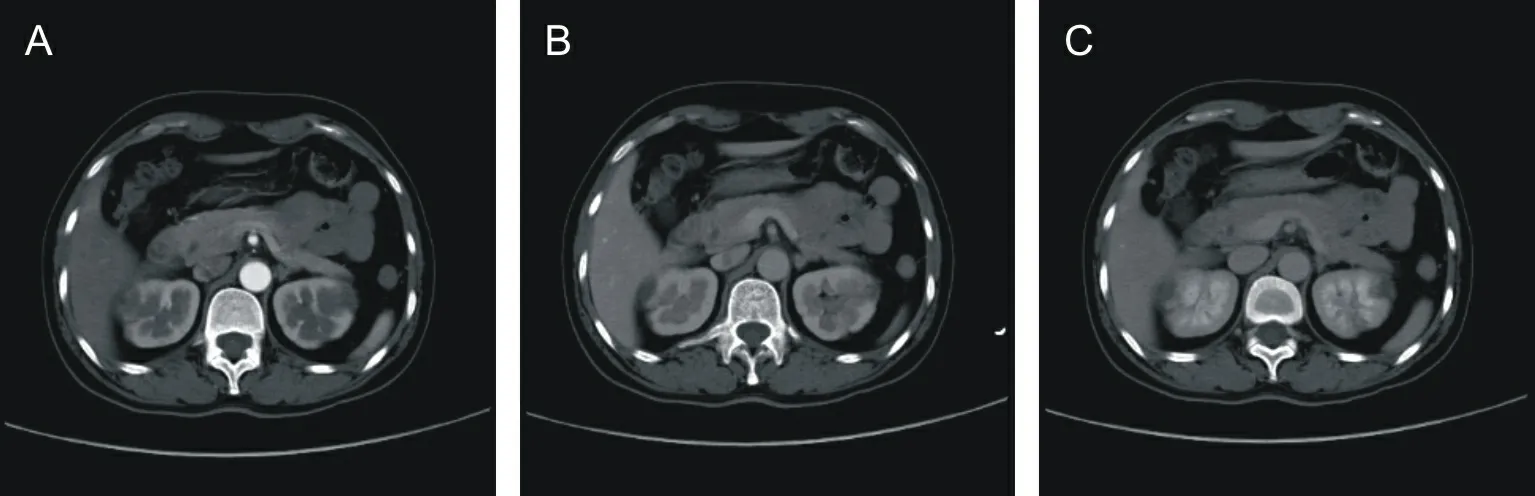
A为皮质期;B为髓质期;C为分泌期。

图5 切除子宫病理切片(HE染色,放大倍数20×20)
2 讨论
本例患者脑梗死的特点包括:中年女性,短期内发生以累及前后2个循环、左右两侧大脑的多发性细小的梗死灶为主的多发性脑梗死,而且第2次发病期间被CT证实同时合并肾梗死,2次发作均在经期。由于患者无高血压、糖尿病等脑梗死的危险因素,头颈部血管未见狭窄等改变,患者脑梗死的病因和发病机制不明,按TOAST分型标准属于隐源性脑梗死。由于患者既往有月经血量过多、痛经等病史,2次脑梗死发作均在经期,2次发病血清D-二聚体、CA125水平明显升高,病理检查证实为子宫腺肌病,手术切除子宫后血清D-二聚体、CA125水平逐渐恢复至正常,而且长期随访脑梗死不再发生,推测患者2次多发性脑梗死以及1次肾梗死的发生与子宫腺肌病有关。
子宫腺肌病发病机制不明,月经期血浆CA125、D-二聚体水平明显升高是其临床特点之一。血浆D-二聚体是纤维蛋白单体经活化因子ⅩⅢ交联后再经纤溶水解所产生的一种特异性降解产物,其血清水平升高往往提示高凝状态[6]。子宫腺肌病患者血清D-二聚体水平升高与患者发生静脉系统血栓栓塞有关,已经被多项研究证实[2-3]。活动性癌症且无高血压、糖尿病等传统危险因素的多发性脑梗死患者血清D-二聚体水平也升高,而且有研究证实经多普勒超声检测发现D-二聚体水平升高的数值与患者颈动脉血流出现微小血栓的信号数量呈正相关,提示癌症患者血清D-二聚体水平升高会导致动脉系统微小血栓形成,最终导致脑梗死的发生[7]。本例患者短时间内发生2次脑梗死,患者的MRI显示2次脑梗死均为累及左右两侧、前后循环的多发性小梗死灶的脑梗死,更重要的是患者第2次脑梗死发生同时合并肾梗死,提示患者脑梗死的发生机制可能与心源性的小栓塞有关,2次脑梗死发生期间D-二聚体水平升高,进一步提示本例患者血清D-二聚体水平升高也可能通过上述癌症患者脑梗死发生的途径导致脑梗死的发生。
本研究还发现,子宫腺肌病患者血浆CA125水平在脑梗死发生期间明显升高。CA125抗原是由肌间的异位子宫内膜分泌并释放进入血液循环,使血中CA125水平增加[8]。国外研究表明,子宫腺肌病尤其是严重子宫腺肌病(子宫体积大于孕12周)CA125升高明显[9]。杨舫等[10]研究证明,血清CA125诊断子宫腺肌病灵敏度可达78.89%,特异度为98.53%,可作为子宫腺肌病诊断、术前评估、疗效及复发判定的指标之一。研究表明CA125升高可使子宫腺肌病发生血栓栓塞概率增加[11]。然而,血浆CA125水平升高是否与患者脑梗死发生有关尚不明确。Jovin等[12]研究表明,具有黏蛋白特性的CA125水平明显升高,与癌症患者脑梗死的发生有关,提示本例患者CA125可能直接参与血液高凝状态的形成,并最终导致子宫腺肌病相关脑梗死的发生,但这还需要进一步的研究证实。
此外,有文献报道子宫腺肌病相关脑梗死的发生还被认为与非细菌性血栓性心内膜炎有关[13-14],本例患者经过2次心脏超声检查未发现该病的依据。由于患者非细菌性血栓性心内膜炎的形成机制不清,子宫腺肌病相关脑梗死的发病机制依然有待今后的研究。子宫腺肌病相关脑梗死的治疗,因考虑为高凝机制所致,故应予抗凝治疗。目前子宫腺肌病的根治性治疗是子宫全切除术[15],其保守性手术后仍然存在复发或未控[16],因此,本研究认为对子宫腺肌病并脑梗死的治疗,全切除术不仅是子宫腺肌病治疗的根本方法,也是预防子宫腺肌病相关脑梗死复发的重要措施。子宫腺肌病相关脑梗死或其他器官栓塞,也应是子宫全切术的手术指征。
子宫腺肌病并发脑梗死已有报道,然而子宫腺肌病相关脑梗死同时并发肾梗死尚未见报道。本例患者的表现再次提示,子宫腺肌病可能导致动脉系统血栓栓塞的风险,临床上值得重视。

