基于生物信息学分析CSRP1基因在胃癌中的表达及其与免疫细胞浸润的关系
郭晨旭,李发展,刘斌,温慧娟,米阳,郑鹏远
(1.郑州大学第五附属医院 a.马歇尔医学研究中心;b.消化内科,河南 郑州 450052;2.郑州大学 医学科学院,河南 郑州 450052)
最新研究显示,胃癌是全球第五大常见癌症,是引起死亡的第四大癌症,在中国胃癌是第三大常见癌症,是引起死亡的第三大癌症[1]。遗传、幽门螺杆菌感染、不健康的生活方式(包括吸烟、饮酒、亚硝酸盐摄入过多、摄食纤维性食物过少)均是胃癌的风险因素[2]。其发病机制仍不完全明确,上述致癌因素引起的原癌基因激活是其重要的分子机制。因此,发现新的胃癌诊断治疗靶点对于胃癌的诊治具有较大的意义。随着二代测序技术的发展,结合生物信息学分析,越来越多的致病基因被发现,极大推动了胃癌的发病机制及精准治疗研究,由于低免疫原性,胃癌免疫治疗的效果不佳[3]。因此,筛选与免疫浸润相关的基因可能有助于增强胃癌免疫治疗的效果,对胃癌的诊疗有重要的意义。CSRP1是一种蛋白质编码基因,编码半胱氨酸和甘氨酸富含蛋白质家族成员[4],是一种有效的生长因子,可参与发育及细胞分化过程[5]。已有研究表明,CSRP1在肝癌、直肠癌等肿瘤中发挥了一定的作用[6-7]。但其在胃癌中的应用还缺乏相应的报道。因此,本研究应用大数据生物信息学分析来探讨CSRP1在胃癌中的发生机制。
1 材料及方法
1.1 数据的获取和处理从美国肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)(https://portal.gdc.cancer.gov/)数据库中下载407例样本基因表达数据(包含胃癌组织375例,正常胃黏膜32例)以及匹配的临床数据,如年龄、性别、肿瘤阶段、TNM分期、生存状态等数据(项目ID:TCGA-STAD)。
1.2CSRP1与胃癌临床病理分期的关系分析CSRP1与胃癌患者T、N分期的关系,使用单因素和多因素Cox回归分析对胃癌患者的CSRP1、性别、年龄及T、N分期进行风险评估。
1.3CSRP1高表达和低表达组间差异分析和生存曲线绘制根据CSRP1基因表达中位数,将胃癌样本分为高表达组和低表达组。首先使用“limma”在R软件中计算两组样本间的差异基因,并使用“ggplot”包和“heatmap”包绘制差异基因的热图和火山图(|logFC|>0.5,P<0.05),最后使用R软件“survival”包绘制生存曲线,得出CSRP1表达水平和生存的关系。
1.4 差异基因的富集分析使用DAVID(v6.8)(https://david.ncifcrf.gov/)数据库进一步将加权基因共表达网络分析(基于基因的共表达关系,将基因聚类成多个不同模块的算法)得到的与胃癌患者生命状态相关的模块进行基因本体(Gene Ontology,GO)功能富集分析,以明确该模块中的基因所涉及的生物学过程、分子功能及细胞定位,同时进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,以便于明确这些基因参与的代谢途径及信号通路。
1.5 差异基因的蛋白质相互作用网络分析将得到的差异基因导入STRING(v11.5)(https://string-db.org/cgi/)在线网站,构建其编码蛋白的互作网络。然后将得到的网络导入Cytoscape(v3.7.2)进行处理。在Cytoscape中,运行cytoHubba插件筛选出相关性最好的前15个基因。使用单因素Cox回归分析评估15个基因的风险率,筛选出与患者生存相关的核心基因。在Kaplan-Meier Plotter(http://kmplot.com/analysis/index.php?p=service)在线网站中绘制核心基因在胃癌患者中的生存曲线,并在TIMER(v2.0)(https://cistrome.shinyapps.io/timer/)在线网站中探索与CSRP1的相关性。
1.6CSRP1与免疫浸润的关系基于TIMER(v2.0)和Cibersort(https://cibersort.stanford.edu/)2种免疫细胞浸润分析工具评估CSRP1与多个免疫细胞的相关性,进一步探索CSRP1与免疫细胞的关系。
2 结果
2.1CSRP1表达与临床分期的关系基于TCGA数据库信息,对CSRP1的表达水平及患者临床特征进行分析。结果显示,随着肿瘤浸润程度的增加,CSRP1的表达水平升高(见图1A),并且CSRP1水平的升高和淋巴结的转移有一定关系(见图1B)。单因素和多因素Cox分析发现CSRP1、年龄及T、N分期均可以作为胃癌的独立预后指标(见图1C和图1D)。

A、B为CSRP1表达水平与肿瘤T、N分期的关系;C、D为单因素、多因素Cox回归分析评估CSRP1与胃癌患者预后的关系。
2.2CSRP1的差异基因表达情况及CSRP1和生存的关系根据CSRP1的差异基因绘制热图和火山图,共发现765个上调基因和246个下调基因(见图2A和图2B)。在TCGA-STAD肿瘤样本中,根据CSRP1的中位表达水平将胃癌样本分成高表达组和低表达组。生存分析显示,高表达CSRP1的患者预后不良,生存期短于低表达组(P<0.05),见图2C。
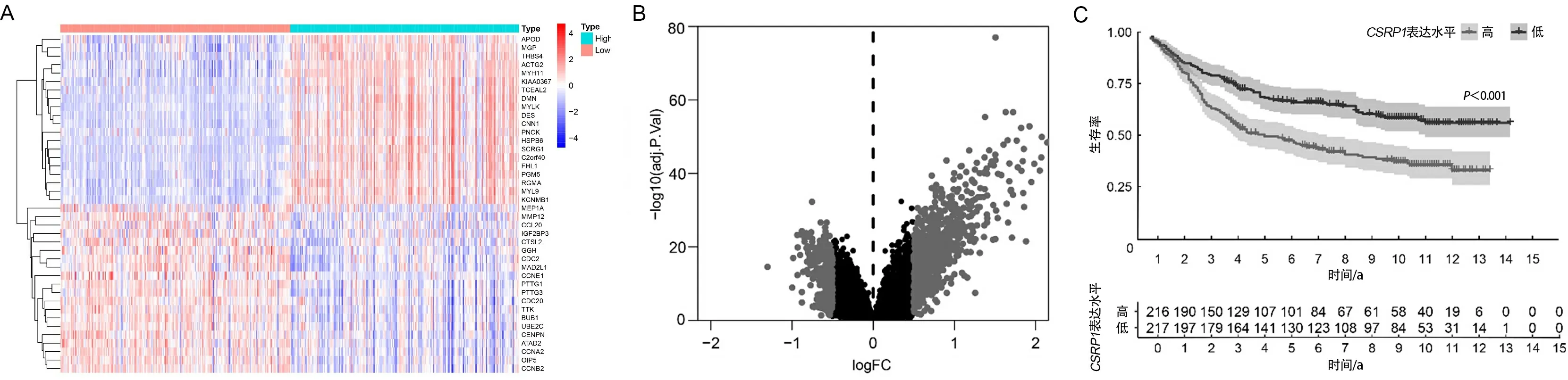
A、B为CSRP1高表达组和低表达组胃癌样本间差异基因的热图和火山图;C为使用Kaplan-Meier法分析基于CSRP1表达水平的胃癌患者的生存曲线。
2.3 富集分析对上调和下调的差异基因分别进行GO和KEGG富集分析(见图3A~D)。结果显示,在GO富集分析中,下调的差异基因主要富集在核溶解、细胞分裂和染色体断裂中;上调的差异基因主要富集在细胞外基质和细胞外骨架结构中。在KEGG通路富集中,下调的差异基因主要富集在细胞周期和细胞衰老中;上调的差异基因主要富集在细胞黏附及PI3K-Akt信号通路上。
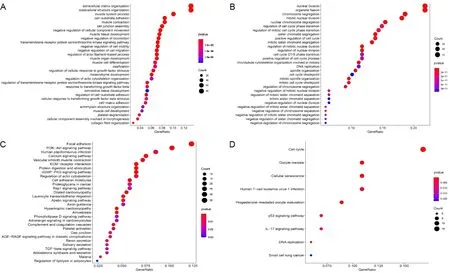
A为上调的差异基因GO富集;B为上调的差异基因KEGG富集;C为下调的差异基因GO富集;D为下调的差异基因KEGG富集。
2.4 蛋白质相互作用网络基于STRING数据库构建差异基因蛋白质相互作用网络,运用Cytoscape进行可视化处理(见图4A),确定了14个和CSRP1高度相关的蛋白质。使用单因素Cox回归分析评估14个蛋白的编码基因在样本中的风险率,P<0.05作为筛选标准(见图4B)。其中ACTA2基因与胃癌患者预后存在相关性(P=0.014),基于TIMER在线网站对CSRP1和ACTA2的相关性进行验证(见图4C),发现ACTA2与CSRP1高度相关(r=0.805)。对ACTA2进行生存分析(见图4D),发现高表达ACTA2的胃癌患者预后较差,与CSRP1结果一致。
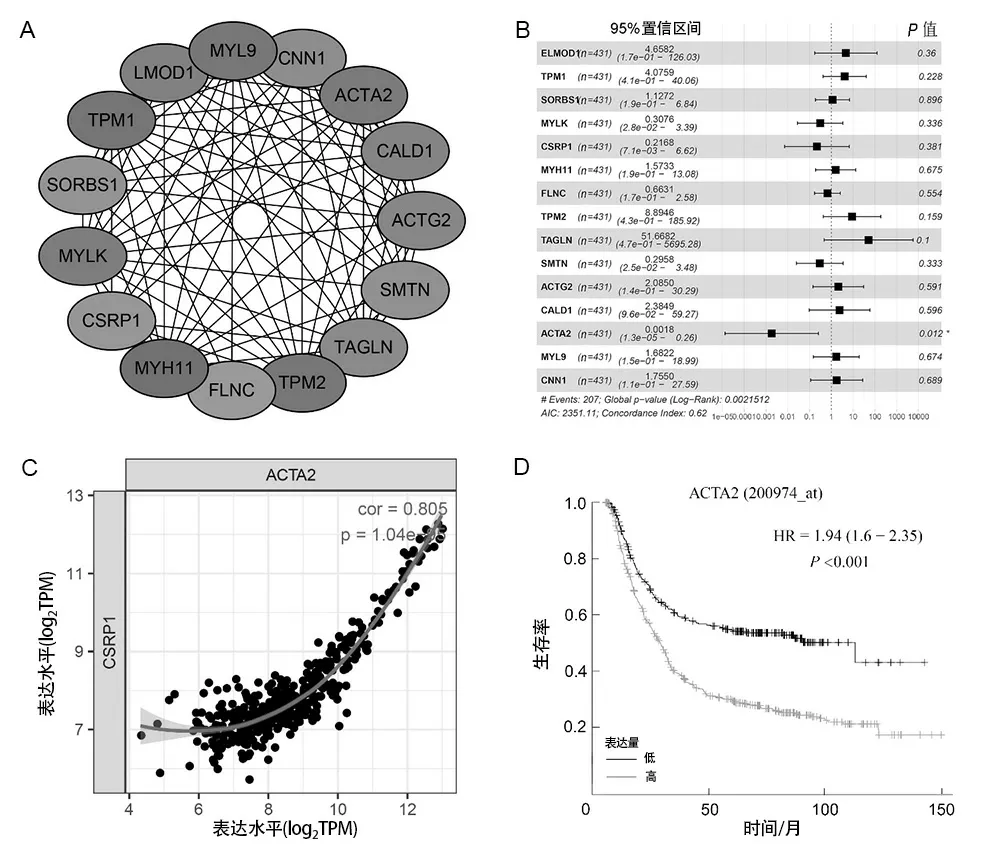
A为CSRP1相关性最高的14个基因的蛋白质相互作用网络;B为14个基因在胃癌中的单因素Cox回归分析;C为ACTA2与CSRP1的相关性散点图;D为ACTA2的表达水平与胃癌患者的生存曲线的关系。
2.5CSRP1与免疫细胞的关系基于TIMER在线网站分析CSRP1与6种主要免疫细胞(B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞)的相关性。结果显示,CSRP1的表达水平与CD4+T细胞、巨噬细胞和树突状细胞相关(见图5A)。为了一步探索CSRP1与免疫细胞的关系,根据不同免疫细胞的标志基因的表达量对胃癌样本转录组数据的免疫细胞浸润程度进行量化,并绘制胃癌组织样本中每种免疫细胞的浸润水平相关图(见图5B)。根据CSRP1表达水平中位数将样本分成高、低两组,比较两组免疫细胞浸润情况。结果显示,CSRP1表达水平和活化的CD4+T细胞、滤泡辅助T细胞、活化的树突状细胞以及自然杀伤细胞浸润水平呈负相关(P<0.05),见图5C。

A为CSRP1与6种免疫细胞的相关性散点图;B为胃癌中免疫细胞的相关性图;C为不同免疫细胞在CSRP1高表达组和低表达组中的浸润差异。
3 讨论
已有研究证明,CSRP1在不同肿瘤或者同一肿瘤的不同阶段表达不同[8]。CSRP1在多种肿瘤中发挥作用,有研究指出,在结直肠癌中,CSRP1是潜在的抑癌基因[6]。在乳腺癌中,CSRP1扮演着十分重要的RNA结合蛋白的角色[9]。Jin等[10]发现塞来昔布能够通过抑制CSRP1的表达产生抗胃癌作用。本研究基于生物信息学分析发现CSRP1高表达的胃癌患者预后不良;同时,CSRP1、年龄及肿瘤的T、N分期均可以作为胃癌预后的独立因子。对CSRP1相关的差异基因进行富集分析发现,差异基因主要集中在核溶解、细胞黏附、细胞分裂以及细胞衰老等重要功能中;对关键差异基因进行蛋白互作,确定了与CSRP1相关的14个基因,对这14个相关基因进行筛选,进一步确定了高度相关基因ACTA2,该基因编码球状肌动蛋白[11]。研究表明,高表达ACTA2的肺癌患者预后不佳,降低ACTA2的表达水平可使肺癌细胞的迁移、侵袭能力下降[12]。ACTA2也参与HER2基因阳性的乳腺癌的转移[13]。进一步验证ACTA2与CSRP1的相关性并进行生存分析,结果显示高表达ACTA2基因的胃癌患者预后不佳,与CSRP1对胃癌患者的预后一致。同时,肿瘤的免疫治疗是当前研究的热点,而肿瘤微环境对肿瘤的免疫疗法起着至关重要的作用[14]。肿瘤微环境包括细胞成分和非细胞成分,细胞成分如成纤维细胞、内皮细胞、神经元、脂肪细胞、免疫细胞,非细胞成分包括细胞外基质、细胞因子、生长因子等[15]。为了探讨CSRP1在胃癌患者免疫治疗中的潜在作用,通过分析CSRP1与免疫细胞的相关性发现CSRP1的表达水平和活化的CD4+T细胞、滤泡辅助T细胞、活化的树突状细胞以及自然杀伤细胞浸润水平呈负相关。T细胞是人类免疫系统的重要组成部分,亚型较多,如CD4+T细胞、CD8+T细胞及调节T细胞等[16]。有研究指出,CD4+T细胞可通过调节肿瘤微环境的间接方式或者直接通过细胞溶解机制消除肿瘤细胞,CD4+T细胞也可以增强B细胞的抗肿瘤效应和强度,协助启动CD8+T细胞的基因表达程序,增强淋巴细胞毒性功能[17]。有研究显示,具有高丰度CD4+记忆T细胞的胃癌患者预后较好[18]。本研究结果显示,高表达CSRP1胃癌患者的CD4+T细胞浸润水平较低,预后较差,与上述研究结果[18]一致。辅助T细胞是产生高亲和力抗体所必需的细胞,同时辅助T细胞可以分泌白细胞介素-21和白细胞介素-4,辅助T细胞缺乏可能导致肿瘤产生免疫逃逸,影响胃癌患者预后[19]。树突状细胞是专门的抗原提呈细胞,可以识别外来的病原体或者体内异常的肿瘤抗原并将其提呈给T细胞,树突状细胞的代谢控制着其发育和成熟过程,可通过代谢调节增强树突状细胞的抗原提呈能力,改善肿瘤免疫疗法[20]。自然杀伤细胞在自身免疫系统对抗肿瘤中发挥着重要的作用,一旦被激活,可分泌细胞毒性因子靶向杀死癌细胞。Pernot等[21]研究表明,肿瘤微环境中自然杀伤细胞的比率影响胃癌患者的预后。Ishikawa等[22]研究发现,扩增自然杀伤细胞与IgG1抗体结合治疗晚期胃癌,可获得较好效果。
综上所述,CSRP1表达水平和多种免疫细胞浸润水平呈负相关,表明CSRP1可通过影响肿瘤的免疫浸润减弱胃癌患者的免疫应答,预后较差,考虑CSRP1可能成为胃癌免疫治疗的新靶点。

