m6A甲基化修饰结合蛋白YTHDF2在食管癌组织中的表达及其对食管癌细胞增殖和迁移的影响
马琰迪,卢香云,何尚峰,俞雪燕,胡云华,高海霞,陈云昭,禹 洁,王文洁,李 锋,3,崔晓宾,4
(1.石河子大学医学院病理学系,新疆 石河子 832002;2.江苏省苏州市高新区人民医院病理科,江苏 苏州 215000;3.首都医科大学附属北京朝阳医院病理科,北京 100200;4.南京大学医学院附属鼓楼医院病理科,江苏 南京 210008)
据世界卫生组织报道,2018年全球食管癌新发病例为58.2万例,而我国新发病例占53.7%[1],可见我国是食管癌发病率较高的国家之一。食管癌主要分为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC) 和食管腺癌 (esophageal adenocarcinoma,EAC),其中ESCC是食管癌最常见的组织学类型[2]。虽然现有的医疗技术明显提升,能通过多种治疗方法(手术、化疗和靶向治疗)提高疗效,但食管癌患者的预后仍较差[3],因此深入研究食管癌发生发展的相关机制,寻求新的有效治疗靶点是提高食管癌患者总体生存率的重要手段。N6-甲基腺嘌呤(N6-methyladenosine RNA,m6A)是最普遍的RNA转录后修饰,其修饰过程有多种酶(腺苷甲基转移酶、去甲基化酶和甲基识别蛋白等)参与,甲基化修饰酶的失调可导致一系列疾病,包括肿瘤的发生发展,也是其成为目前研究热点的原因之一[4]。YTH结构域连接蛋白2(YTH domain-containing family protein 2,YTHDF2)在m6A修饰过程中扮演重要角色,其能结合m6A甲基化的mRNA,调节mRNA的降解[5]。但YTHDF2与食管癌发生发展的关系仍未阐明。本研究首先利用免疫组织化学染色法检测ESCC组织中YTHDF2的表达,进一步分析YTHDF2与ESCC患者临床病理特征和预后的关系,再利用YTHDF2 siRNA转染食管癌细胞系检测YTHDF2对ESCC细胞的增殖、克隆形成和迁移能力的影响,为寻找新的有效的食管癌治疗靶点提供理论依据。
1 资料与方法
1.1 临床资料 选取2004—2016年石河子大学医学院第一附属医院、乌鲁木齐市自治区人民医院和喀什市第一人民医院病理科石蜡包埋组织,其中ESCC组织113例,癌旁正常食管上皮组织95例,有随访信息者59例,男性37例,女性22例,平均年龄 (58.881±9.385)岁,患者术前均未接受过放疗或化疗。所有研究样本的病理诊断和分期,由2名资深病理医生根据WHO消化系统肿瘤2019版对HE切片进行复片,并参照国际抗癌联盟(Union for International Cancer Control, UICC)2019版TNM分期标准进行分期。癌旁正常食管上皮组织和ESCC组织均经过病理学验证,本实验经石河子大学医学院医学伦理学与人体临床试验委员会批准,并获得所有参与者的书面知情同意。收集患者的基本信息、肿瘤部位、分化程度、有无淋巴结转移、有无远处转移和肿瘤TNM分期等临床病理参数。后期采用电话、医院病历或其他方法对患者进行随访,随访截止时间为2020年8月或死亡日期。
1.2 细胞、主要试剂和仪器 食管癌EC9706和Eca109细胞(上海复祥生物科技有限公司)。胎牛血清(以色列BI公司),RPMI-1640培养基和Lipofectamine™2000转染试剂(美国Thermo Fisher公司),0.25%胰蛋白酶消化液(北京索莱宝有限公司),YTHDF2 siRNA(上海吉玛基因公司,引物序列见表1),蛋白裂解液和BCA蛋白定量检测试剂盒(上海碧云天生物技术有限公司),YTHDF2抗体(武汉三鹰生物技术有限公司),GAPDH抗体和山羊抗兔IgG二抗 (北京中杉金桥生物技术有限公司),10%PAGE凝胶剂盒(上海雅酶生物科技有限公司),CCK-8试剂盒和ECL化学发光底物(西安米鼠生物科技有限公司)。组织芯片制作仪(英国Mitogen公司),多功能酶标仪和凝胶成像分析仪(美国Bio-Rad公司)。
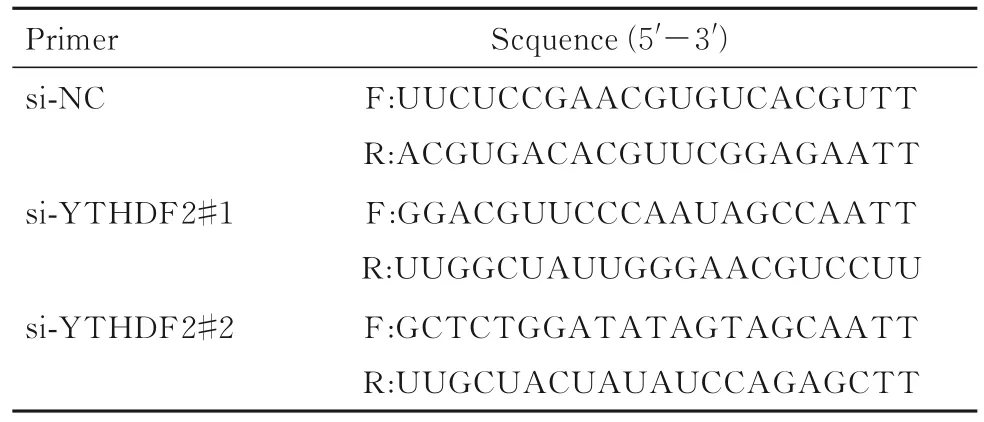
表1 YTHDF2 siRNA引物序列Tab. 1 Sequences of YTHDF 2 siRNA primers
1.3 细胞培养 将复苏的Eca109和EC9706细胞置于含10%胎牛血清的RPMI-1640培养基中,在37℃、5%CO2培养箱中进行培养,换液,传代,冻存。
1.4 组织芯片制备、免疫组织化学染色和结果判定 组织芯片制备:首先对选取的HE染色切片病理诊断进行核对,在切片上标记典型区域,然后针对该区域对应在蜡块上区域准确的标记,即为制备组织芯片的取材位点。采用组织芯片制作仪制作组织芯片,3~4 μm厚度,连续切片,备用。免疫组织化学染色采用EnVision两步法。由2名高年资的病理医师双盲法评定染色结果,YTHDF2主要定位于细胞质,少量定位于细胞核中,以呈棕黄色颗粒为阳性。①按细胞着色强度评分:无着色为0分,黄色为1分,棕黄色为2分,棕色为3分。②按肿瘤细胞中阳性细胞的百分率记分:<5%记0分,6%~25%记1分,26%~50%记2分,51%~75%记3分,≥76%记4分。2项记分相乘代表YTHDF2表达强度,0~1分为(-),2~4分为(+),5~8分为(),9~12分为()。其中≤1分为不表达,2~4分为低表达,≥5分为高表达。若2名病理医师对某结果存在分歧,则由第3名高年资的病理医师进一步评定。
1.5 细胞转染和分组 取对数生长期Eca109和EC9706细胞分为对照组(转染si-NC)和si-YTHDF2组(分别转染si-YTHDF2#1和si-YTHDF2#2),细胞消化计数后,每孔5×104个细胞铺于6孔细胞培养板,待细胞贴壁长至70%左右时,加入2 mL无血清培养基,然后分别加入Lipofectamine™2000转染试剂和YTHDF2 siRNA混匀的转染试剂静置5~10 min,弃去6孔细胞培养板中原有培养基,用PBS缓冲液清洗2次,将混合液体均匀滴入每个孔中,4~6 h后进行换液,继续培养24和48 h后,收集细胞用于后续实验。
1.6 Western blotting法检测各组细胞中YTHDF2蛋白表达水平 凝胶的制备严格按照PAGE凝胶剂盒说明书进行操作。分别用浓度为50、75和100 nmol·L-1YTHDF2 siRNA 和si-NC转 染Eca109和EC9706细胞,分别在24和48 h后提取蛋白,每孔加入10 μL蛋白,上样,10%聚丙烯酰胺凝胶电泳,湿转转膜,PSA室温封闭2 h,加入YTHDF2抗体(1∶1 000)和GAPDH抗体(1∶1 000)4℃过夜孵育,TBST洗膜5 min×6次,山羊抗兔IgG(1∶10 000) 室温孵育2 h,TBST洗膜5 min×6次,滴加ECL化学发光底物显影。采用Image J软件进行灰度值分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。选定YTHDF2 siRNA最佳转染浓度和时间用于后续实验。
1.7 CCK-8法检测各组细胞增殖活性 转染细胞后,分别将对照组、si-YTHDF2#1组和si-YTHDF2#2组细胞消化计数,接种于5个96孔细胞培养板中,每孔2×103个细胞,每个96孔细胞培养板,每组细胞铺3个复孔,分别在铺板后第1~5天加入CCK-8溶液,每孔10 μL,37℃孵育2 h后用多功能酶标仪检测在450 nm波长下各组细胞的吸光度(A)值,重复读数3次,计算平均值,以A值平均值表示细胞增殖活性。
1.8 平板克隆实验检测各组细胞克隆形成数 各组培养24 h的Eca109和EC9706细胞,消化并计数,接种于6孔细胞培养板,每孔接种2×103个细胞,每组3个复孔,于37℃恒温恒湿条件下培养14 d,然后用4%多聚甲醛固定20 min,0.1%结晶紫染色20 min,晾干,拍照并计数克隆形成数。
1.9 Transwell小室实验检测各组细胞中迁移细胞数 利用无Matrigel基质胶的Transwell小室,进行细胞迁移实验。在上室加入2×104个细胞,加入无血清细胞悬浮液量为200 μL,在下室加入含20%血清培养液600 μL,培养24 h,4%多聚甲醛固定20 min,0.1%结晶紫染色20 min。洗涤,200倍镜视野下观察并计数迁移细胞数,选取3个视野,计算平均值。
1.10 统计学分析 采用SPSS 26.0统计软件进行统计学分析。ESCC组织与癌旁正常食管上皮组织中YTHDF2表达强度比较采用Fisher’s确切概率法;不同临床病理特征ESCC患者YTHDF2表达强度比较采用χ2检验或Fisher’s确切概率法。按照随访患者信息中是否存活进行二分类(0为死亡,1为存活),采用Kaplan-Meier法对患者进行生存分析。细胞增殖活性、细胞克隆形成数和迁移细胞数均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 ESCC组织和癌旁正常食管上皮组织中YTHDF2蛋白表达情况 免疫组织化学染色,YTHDF2主要表达于细胞质中,少量表达于细胞核中。ESCC组织中YTHDF2蛋白表达强度明显高于癌旁正常食管上皮组织(P<0.01)。见图1和表2。
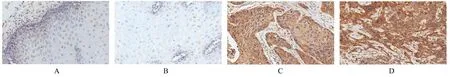
图1 免疫组织化学染色法检测不同组织中YTHDF2蛋白表达情况Fig.1Expressions of YTHDF2 protein in different tissues detected by immunohistochemistry staining

表2 不同组织中YTHDF2蛋白表达情况Tab. 2Expressions of YTHDF 2 in different tissues
2.2 不同临床病理特征ESCC患者癌组织中YTHDF2蛋白表达情况 根据免疫组织化学评分,59例ESCC患者分为YTHDF2低表达组(≤4分,22例)和YTHDF2高表达组(>5分,37例)。不同发病年龄和TNM分期ESCC患者癌组织中YTHDF2蛋白表达强度比较差异有统计学意义(P=0.008,P=0.041)。不同性别 (P=0.580)、肿瘤部位 (P=0.380)、肿瘤分级 (P=0.563)、肿瘤浸润深度(P=1.000)、淋巴结转移(P=0.590)和远处转移(P=0.240)等临床病理特征ESCC患者癌组织中YTHDF2蛋白表达强度比较差异均无统计学意义。见表3。
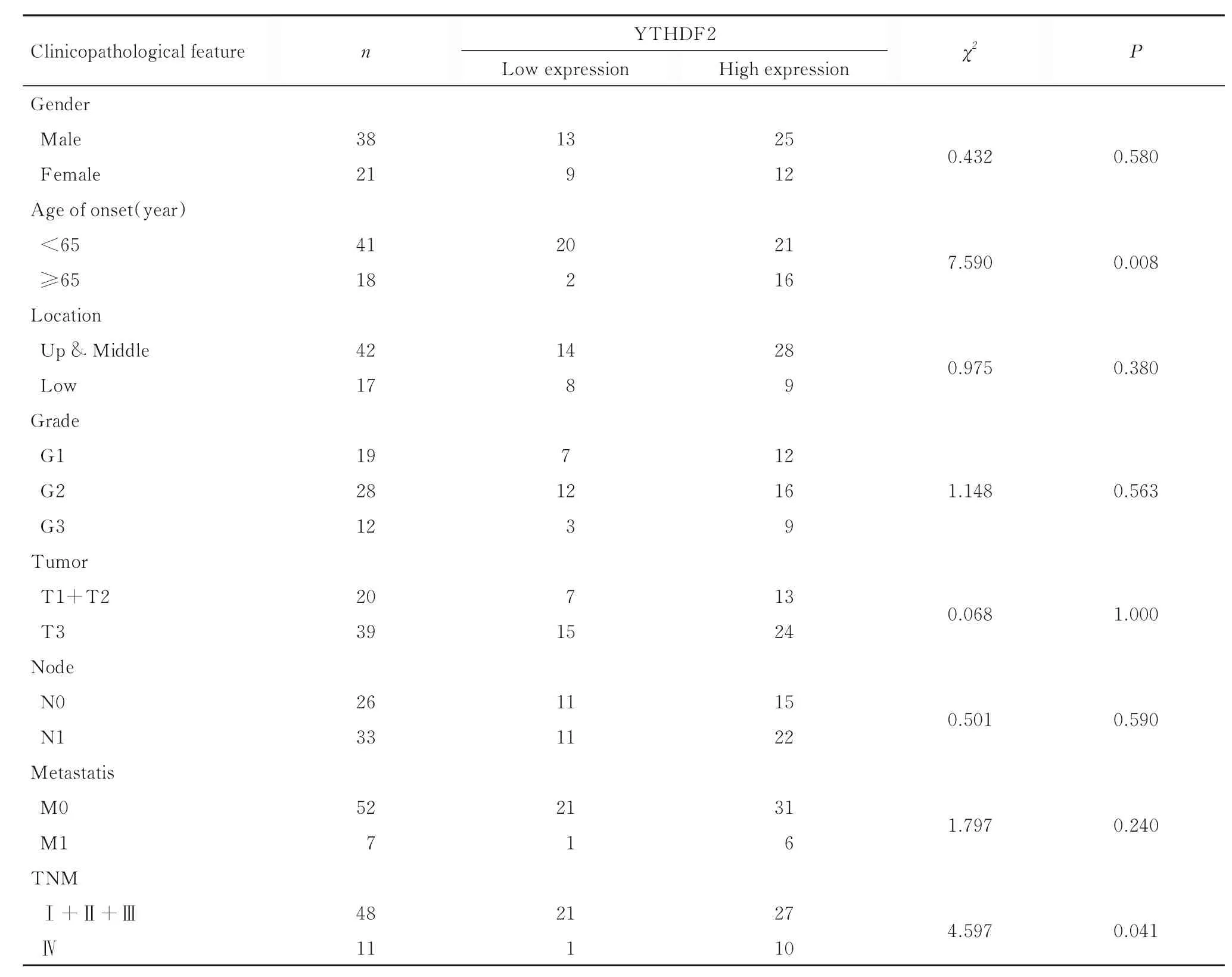
表3 不同临床病理特征ESCC患者癌组织中YTHDF2蛋白表达情况Tab. 3Expressions of YTHDF 2 in cancer tissue of ESCC patients with different clinicopathological features
2.3 YTHDF2表达强度与ESCC患者预后的关系113例ESCC中,59例患者获得完整的临床随访信息。随访截止日期为2020年8月或死亡日期。Kaplan-Meier生存分析结果显示:与YTHDF2低表达组比较,YTHDF2高表达组ESCC患者的生存率明显降低(P=0.035),即YTHDF2高表达组ESCC患者预后较差。见图2。
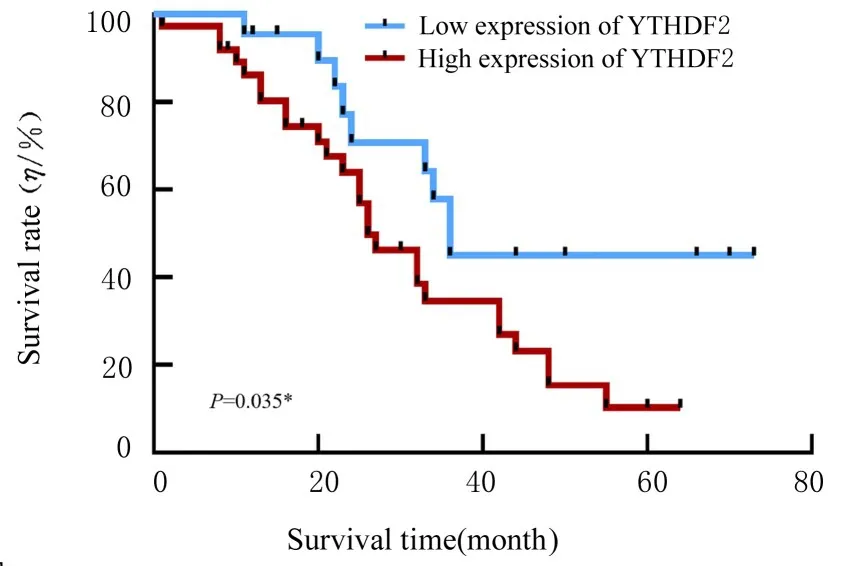
图2 YTHDF2蛋白表达强度与ESCC患者预后的关系Fig. 2 Relationship between YTHDF2 protein expression and prognosis of ESCC patients
2.4 各组食管癌细胞转染情况 分别用50、75和100 nmol·L-1的 YTHDF2 siRNA 和 50 nmol·L-1的si-NC转染Eca109和EC9706细胞,转染24和48 h后检测各组细胞中YTHDF2蛋白的表达水平。与对照组比较,YTHDF2 siRNA组(si-YTHDF2#1组和si-YTHDF2#2组)细胞中YTHDF2蛋白表达水平 明 显 降 低 (P<0.05或P<0.01)。 其 中50 nmol·L-1的 si-YTHDF2#1和 si-YTHDF2#2作用24 h后对YTHDF2的干扰效果最明显,因此后续实验选定该浓度和作用时间。见图3。
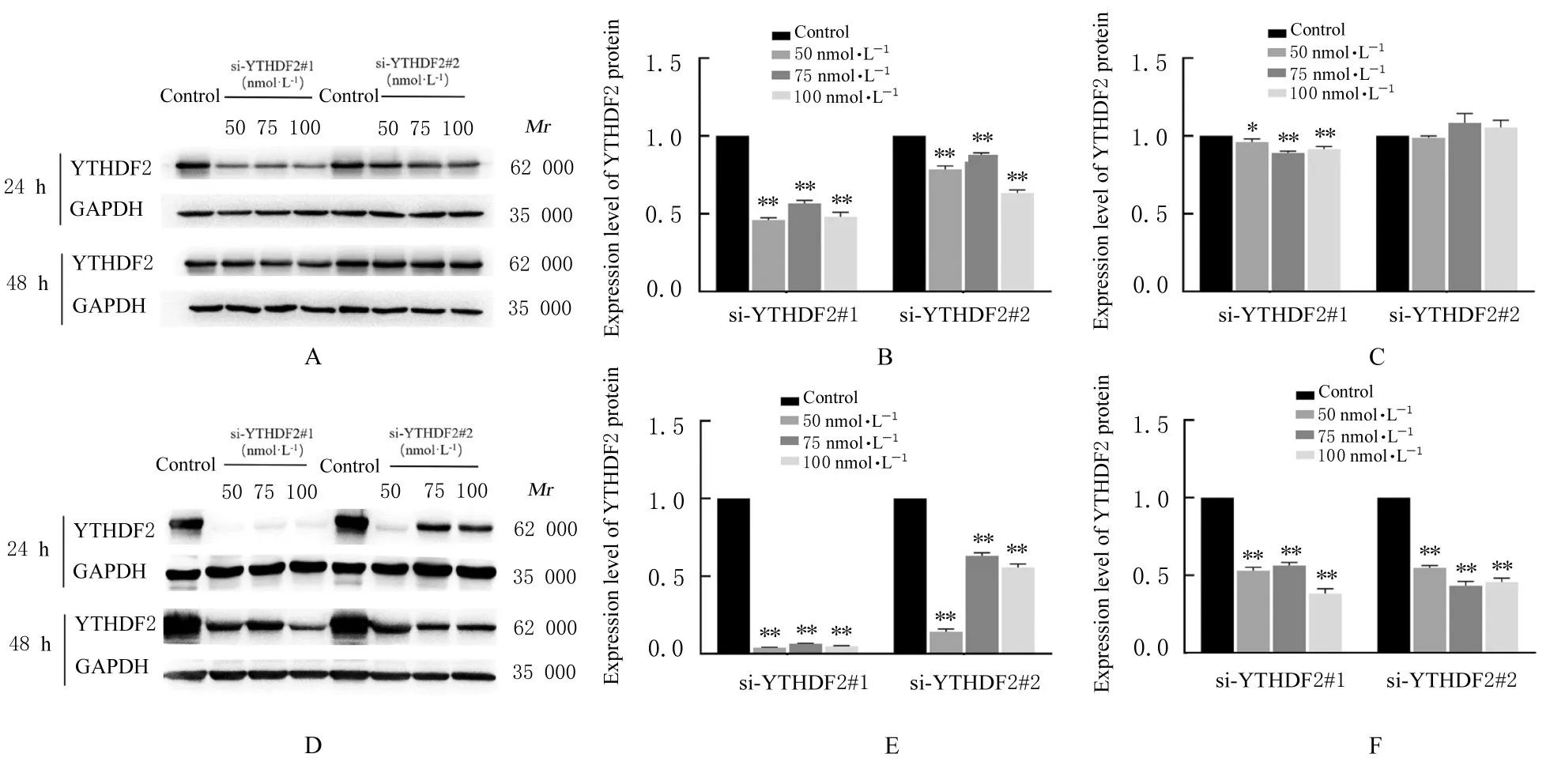
图3 不同浓度siRNA转染后各组Eca109细胞和EC9706细胞中YTHDF2蛋白表达电泳图和直条图Fig.3 Electrophoregram and histogram of expressions of YTHDF2 protein in Eca109 and EC9706 cells in various groups after transfected with different concentrations of siRNA
2.5 各组食管癌细胞的增殖活性 与对照组比较,转染2~5 d时si-YTHDF2#1组和si-YTHDF2#2组Eca109细胞增殖活性随着时间的延长明显降低(P<0.05);转染1~5 d时si-YTHDF2#1组 和si-YTHDF2#2组EC9706细胞增殖活性随着时间的延长明显降低(P<0.05)。见表4和5。
表4 各组Eca109细胞增殖活性Tab. 4 Proliferation activities of Eca 109 cells in various groups(n=3,±s)
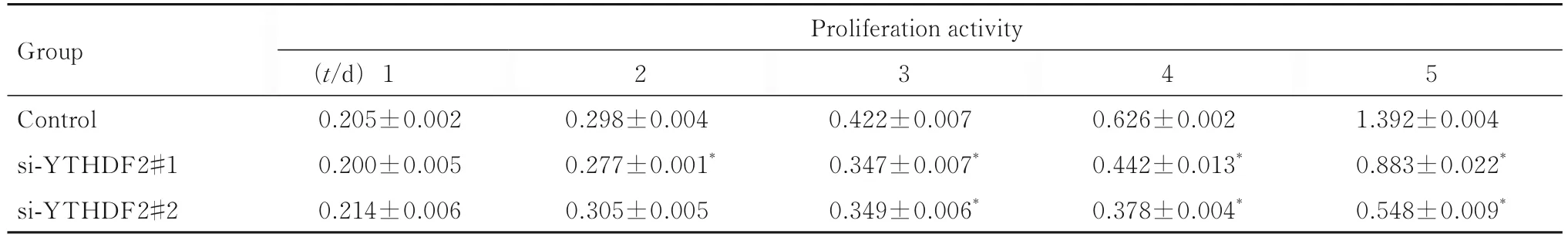
表4 各组Eca109细胞增殖活性Tab. 4 Proliferation activities of Eca 109 cells in various groups(n=3,±s)
*P<0.05 vs control group.
Group Proliferation activity 2 3 4 5 Control si-YTHDF2#1 si-YTHDF2#2 1.392±0.004 0.883±0.022*0.548±0.009*(t/d)1 0.205±0.002 0.200±0.005 0.214±0.006 0.298±0.004 0.277±0.001*0.305±0.005 0.422±0.007 0.347±0.007*0.349±0.006*0.626±0.002 0.442±0.013*0.378±0.004*
2.6 各组食管癌细胞克隆形成数 与对照组比较,si-YTHDF2#1组和si-YTHDF2#2组Eca109和EC9706细胞克隆形成数均明显减少。与对照组Eca109细 胞 [ (311.0±11.0) 个] 比 较,si-YTHDF2#1组和si-YTHDF2#2组Eca109细胞克隆形成数[(176.3±11.5)个和(35.3±2.5)个]明显减少 (P<0.01);与对照组EC9706细胞[(244.7±8.0)个]比较,si-YTHDF2#1组和si-YTHDF2#2组EC9706细胞克隆形成数[(99.7±2.5)个和(32.7±2.5)个]明显减少(P<0.01)。见图4。
表5 各组EC9706细胞增殖活性Tab. 5Proliferation activities of EC9706 cells in various groups(n=3,±s)
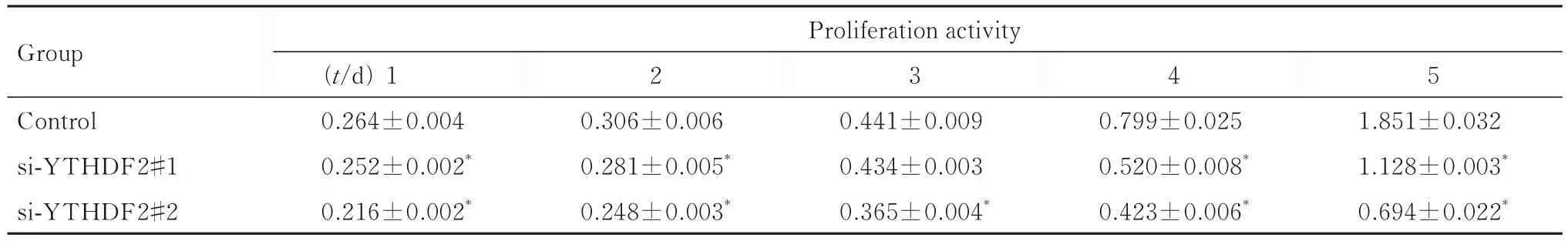
表5 各组EC9706细胞增殖活性Tab. 5Proliferation activities of EC9706 cells in various groups(n=3,±s)
*P<0.05 vs control group.
Group Proliferation activity 2 3 4 5 Control si-YTHDF2#1 si-YTHDF2#2 1.851±0.032 1.128±0.003*0.694±0.022*(t/d)1 0.264±0.004 0.252±0.002*0.216±0.002*0.306±0.006 0.281±0.005*0.248±0.003*0.441±0.009 0.434±0.003 0.365±0.004*0.799±0.025 0.520±0.008*0.423±0.006*
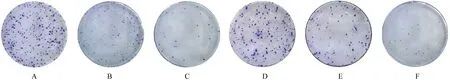
图4 各组食管癌细胞克隆形成情况(结晶紫)Fig.4 Colony formation abilities of Eca109 and EC9706 in various groups(Crystal violet)
2.7 各组食管癌细胞中迁移细胞数 与对照组比较,si-YTHDF2#1组和si-YTHDF2#2组Eca109和EC9706细胞中迁移细胞数均明显减少。与对照组Eca109细胞 [(315.3±4.9) 个] 比较,si-YTHDF2#1组和si-YTHDF2#2组Eca109细胞中迁移细胞数 [(116.3±4.0) 个和 (109.3±15.9) 个] 明显减少 (P<0.01);与对照组EC9706细 胞 [ (225.3±17.2) 个] 比 较,si-YTHDF2#1组和si-YTHDF2#2组EC9706细胞中迁移细胞数[(94.3±7.1)个和(121±24.1)个]明显减少(P<0.01)。见图5。
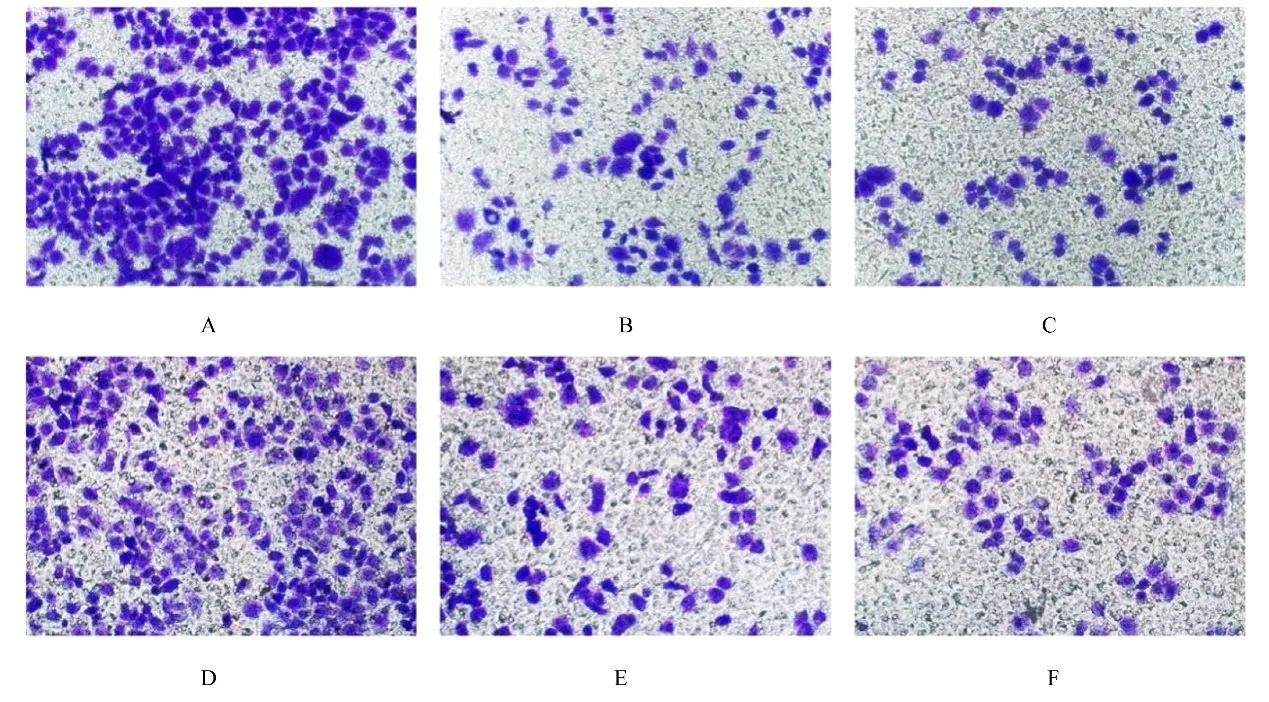
图5 各组Eca109和Ec9706细胞迁移情况(结晶紫,×200)Fig.5 Migration of Eca109 and EC9706 cells in various groups(Crystal violet,×200)
3 讨 论
近年来,虽然食管癌的发病率和死亡率已有明显的降低,但食管癌患者术后的总体生存率仍然较低,预后较差[6]。研究食管癌发生发展的分子生物学机制,可为食管癌提供新的靶向治疗策略,从而达到精准治疗食管癌的目的,改善患者的预后和总体生存时间,因此是食管癌领域的研究热点[7-8]。m6A甲基化修饰作为最常见的RNA修饰方式之一,可在转录后水平调控基因表达,近年来其相关的酶或蛋白在食管癌发生发展的功能也被学者广泛关注。研究[9-12]显示:m6A甲基化修饰结合蛋白YTHDF2在多种肿瘤中特异性高表达,且其上调表达能促进肿瘤增殖、迁移和侵袭。但YTHDF2在食管癌中作用的研究尚未见报道,其在食管癌中的作用机制仍不明确。
为探讨m6A甲基化修饰结合蛋白YTHDF2在食管癌中的作用,本研究采用免疫组织化学染色检测ESCC组织中YTHDF2蛋白表达情况,结果显示:在ESCC组织中,YTHDF2蛋白特异性高表达;进一步分析ESCC组织中YTHDF2表达强度与ESCC患者临床病理特征的关系,结果显示:不同发病年龄和TNM分期ESCC患者癌组织中YTHDF2蛋白表达强度比较差异有统计学意义;生存分析显示:YTHDF2高表达患者有相对较低的生存率,进一步证实m6A甲基化修饰结合蛋白YTHDF2可能为促进ESCC患者的肿瘤进展的重要分子之一。本文作者进一步研究了YTHDF2能否促进食管癌细胞的生物学行为,采用YTHDF2 siRNA转染食管癌Eca109和EC9706细胞后,细胞的增殖能力明显受到抑制,克隆形成能力和细胞迁移能力明显降低,表明YTHDF2可能促进食管癌细胞的增殖、克隆形成和迁移能力,提示下调YTHDF2表达可能是治疗食管癌的潜在策略。
增殖和迁移是恶性肿瘤的重要特征,其过程复杂,涉及多种机制[13-16],YTHDF2作为m6A甲基化修饰主要的阅读器,其高表达能够促进某些抑癌基因或促癌基因相应靶标mRNA的降解或合成,进而导致食管癌的发生。研究[17]表明:YTHDF2通过降解膀胱癌中的含SET域蛋白7(SET Domain Containing 7,SETD7) 和 Krüppel样因子 4(Krüppel-like factor 4,KLF4) mRNA 促进肿瘤发生。在小鼠精原细胞中,YTHDF2基因敲除能下调基质金属肽酶(matrix metalloproteinases,MMPs),并通过m6A/mRNA降解途径影响细胞的黏附和增殖[18]。研究[19]显示:YTHDF2 通过调节肺腺癌组织中的轴抑制蛋白1(axis inhibitor factor 1,Axin1)进而激活Wnt/β-catenin信号通路,促进肺腺癌细胞的增殖和迁移。在肝癌中YTHDF2通过上调八聚体结合转录因子4(octamer-binding transcription factor 4,Oct4)表达促进肝癌细胞的增殖和转移[20]。但在ESCC中,m6A甲基化修饰结合蛋白YTHDF2调节食管癌增殖和迁移的机制有待进一步研究。
综上所述,在ESCC组织中,m6A甲基化修饰结合蛋白YTHDF2特异性高表达,YTHDF2蛋白高表达患者有相对较低的生存率,敲低YTHDF2能抑制食管癌细胞的增殖和迁移。本研究结果提示,敲低YTHDF2可能是食管癌的潜在治疗策略。

