丁酸钠联合电离辐射对肺癌A549细胞凋亡的影响及其机制
郎庆旭,牛雪霜,杨凯文,张 韧,王思腾,祖米热提古丽·吾买尔,王珍琦
(1.吉林大学公共卫生学院 国家卫健委放射生物学重点实验室,吉林 长春 130021;2.北华大学医学技术学院,吉林 吉林 132013)
肺癌是最常见的恶性肿瘤,也是引起癌症患者死亡的主要原因[1-2]。约70%的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者确诊时为晚期[1,3],多数患者确诊时难以切除,其治疗主要依靠化疗与放疗相结合。放射治疗是临床癌症的主要治疗方法之一,但肿瘤的放射抵抗和放射治疗的不良反应限制了其治疗效果和应用。联合应用放射增敏剂可提高放射治疗的疗效。丁酸钠(sodium butyrate,NaBt)是一种组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor, HDACi),已被证明在多种癌症中抑制肿瘤细胞的增殖,促进细胞凋亡,延缓肿瘤细胞的侵袭和转移,包括肝癌、乳腺癌、胃癌、膀胱癌、结直肠癌、慢性髓细胞白血病和肺癌等,但其在很多癌症中的确切作用尚未阐明[4-10]。 本 课 题 组 前 期 研 究[11]揭 示 了 NaBt对NSCLC A549细胞具有增殖抑制作用,并呈浓度和时间依赖性,且NaBt和X射线联合应用抑制效果明显优于二者单独应用,其机制可能与二者联合引起A549细胞G2/M期阻滞有关。为了进一步揭示NaBt和X射线的联合对肺癌A549细胞的作用及其潜在机制,本研究探讨了二者单独或联合应用时对细胞 凋 亡、 线 粒 体 膜 电 位 (mitochondrial membrane potential, Δψm)、 活 性 氧 (reative oxygen species,ROS)水平和相关基因表达水平的影响,以期为NSCLC的放射治疗提供新的策略和实验室依据。
1 材料与方法
1.1 细胞、主要试剂和仪器 人A549细胞购自中国科学院上海细胞库,采用高糖DMEM常规培养。NaBt(美国Sigma公司),胎牛血清(浙江杭州四季青生物制品分公司),高糖DMEM(美国GIBCO公司),胰蛋白酶(上海生物技术有限公司),Annexin-Ⅴ/FITC凋亡检测试剂盒(美国BD公司),罗丹明123试剂盒(北京索莱宝生物科技公司),ROS试剂盒(中国碧云天生物技术有限公司),TRIzol(美国Invitrogen公司),逆转录试剂盒和实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)检测试剂盒(中国Novoprotein公司),其他试剂为国产分析纯。X射线深部辐照仪(X-RAD 320 ix,德国PXI公司),Epoch酶标仪(美国BioTek公司),FACSCalibur流式细胞仪(美国BD公司),RT-qPCR仪(美国Bio-Tek公司)。
1.2 实验分组和照射处理 人A549细胞分为对照组、NaBt组、4 Gy X射线照射组和NaBt联合4 Gy X射线照射组。采用X射线深部辐照仪照射,电压180 kV,电流20 mA,单次源靶距70 cm,剂量率 1.0 Gy·min-1,照 射时间 4 min,照射 剂量4 Gy。
1.3 流式细胞术检测各组细胞凋亡率、Δψm和ROS水平 将对数生长期A549细胞接种于6孔细胞培养板中,24 h 后加入 NaBt(10 mmol·L-1),作用24 h后给予4 Gy X射线照射,24和48 h后用0.25% 胰酶消化后,1 000 r·min-1离心 5 min,弃上清,加入1 mL预冷的PBS缓冲液洗涤2次。Annexin Ⅴ/PI双染色,加入Annexin Ⅴ-FITC 5 μL,室温避光孵育 10 min,加入 PI(20 mg·L-1)10 μL,室温避光孵育5 min,尼龙网过滤后上机检测各组细胞凋亡率,细胞凋亡率以百分率表示。照射后6 h按照上述方法收集细胞,加入500 μL稀释后的罗丹明123,在37℃恒温培养箱中孵育40 min,重悬细胞用300目尼龙布过滤细胞至流式管,立即上机检测Δψm,以平均荧光强度(meanfluorescence intesnsity,MFI)表示。照射后6 h,加入适当体积的2′,7′-二氯二氢荧光素二乙酸 酯 (2′, 7′-dichlorodihydrofluorescein diacetate,DCFH-DA),37℃细胞培养箱内孵育20 min,用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA,0.25%胰酶消化细胞,加入完全培养基终止消化,制成细胞悬液,1 500 r·min-1离心5 min,用PBS缓冲液洗涤1~2次,过滤后上机检测ROS水平,以MFI表示。采用CellQuest软件收集细胞,ModFit软件分析结果,至少收集1×104个细胞。
1.4 RT-qPCR法检测各组细胞中caspase-3和p21 mRNA表达水平 将经NaBt处理和4 Gy X射线照射的A549细胞继续培养24 h之后,采用TRIzol法提取各组细胞总RNA,按照美国Invitrogen公司的TRIzol操作说明书步骤进行。用Epoch酶标仪测定总RNA浓度和纯度,-80℃冰箱保存备用。制备cDNA,RT-qPCR法检测各组细胞中caspase-3和p21 mRNA表达水平,以GAPDH基因为内参。caspase-3, 正 向 引 物 5′-AAGGCAGAGCCATGGACCAC-3′, 反 向 引 物 5′-CTGGCAGCATCATCCACACATA-3′;p21,正向引物 5′-AGGCCAAAGCCTATGGTGGAC-3′, 反 向 引 物 5′-TCTAGCAGGCCGTTGATGGAG-3′;GAPDH,正向引物5′-GCACCGTCAAGGCTGAGAAC-3′, 反 向 引 物5′-TGGTGAAGACGCCAGTGGA-3′。 实 时 定 量PCR反应条件:95℃、1 min,95℃、20 s,60℃、20 s,72℃、30 s,共40个循环。采用相对标准曲线进行结果分析,利用Ct值和相对标准曲线可以得到初始模板量,以目的基因与GAPDH基因初始模板之比表示目的基因mRNA表达水平。
1.5 统计学分析 采用SPSS 24.0统计软件进行统计学分析。各组细胞凋亡率、Δψm、ROS水平和caspase-3及p21 mRNA表达水平均以±s表示,经正态性检验均符合正态分布,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞凋亡率 NaBt单独或联合4 Gy X射线作用A549细胞24和48 h,与对照组、NaBt组和4 Gy X射线照射组比较,NaBt联合4 Gy X射线照射组细胞凋亡率均明显升高(P<0.05或P<0.01)。作用48 h,与对照组比较,NaBt组细胞凋亡率明显升高(P<0.01)。见图1和表1。
表1 各组细胞凋亡率Tab.1 Apoptotic rates of cells in various groups (n=3,±s,η/%)

表1 各组细胞凋亡率Tab.1 Apoptotic rates of cells in various groups (n=3,±s,η/%)
*P<0.05,**P<0.01 vs control group;△P<0.05,△△P<0.01 vs NaBt group;#P<0.05,##P<0.01 vs 4 Gy X-ray irradiation group.
Group Apoptotic rate Control NaBt 4 Gy X-ray irradiation NaBt combined with 4 Gy X-ray irradiation 48 14.33±1.57 79.08±2.56**20.71±7.21 89.29±0.36**△##(t/h) 24 11.51±4.59 25.92±1.92 10.99±4.33 43.60±5.86*△△#

图1 流式细胞术检测各组细胞凋亡率Fig.1 Apoptotic rates of A549 cells in various groups detected by flow cytometry
2.2 各组细胞Δψm和ROS水平 NaBt单独或联合4 Gy X射线作用A549细胞6 h后,分别与对照组、NaBt组和4 Gy X射线照射组比较,NaBt联合4 Gy X射线照射组细胞Δψm均明显降低(P<0.05或P<0.01);与对照组比较,NaBt组和NaBt联合4 Gy X射线照射组细胞ROS水平均升高(P<0.05);与4 Gy X射线照射组比较,NaBt联合4 Gy X射线照射组细胞ROS水平升高(P<0.05);与NaBt组比较,NaBt联合4 Gy X射线照射组细胞ROS水平有升高趋势,但差异无统计学意义(P>0.05)。见图2和表2。
表2 各组细胞Δψm和ROS水平Tab.2 Levels of Δψm and ROS in cells in various groups(n=3,±s,MFI)
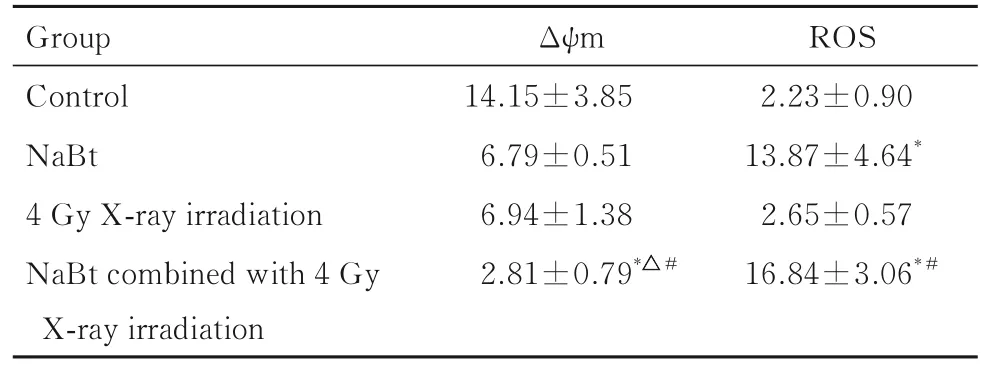
表2 各组细胞Δψm和ROS水平Tab.2 Levels of Δψm and ROS in cells in various groups(n=3,±s,MFI)
*P<0.05 vs control group;△P<0.01 vs NaBt group;#P<0.05 vs 4 Gy X-ray irradiation group.
Group Control NaBt 4 Gy X-ray irradiation NaBt combined with 4 Gy X-ray irradiation Δψm 14.15±3.85 6.79±0.51 6.94±1.38 2.81±0.79*△#ROS 2.23±0.90 13.87±4.64*2.65±0.57 16.84±3.06*#
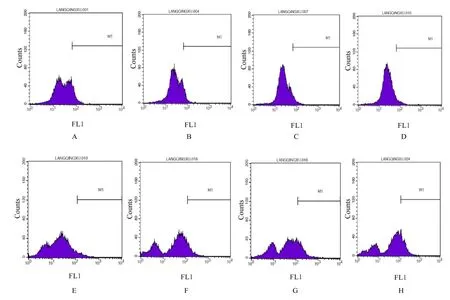
图2 流式细胞术检测各组细胞Δψm和ROS水平Fig.2 Levels of Δψm and ROS in cells in various groups detected by flow cytometry
2.3 各组细胞中caspase-3和p21 mRNA表达水平 NaBt单独或联合4 Gy X射线作用A549细胞24 h后,与对照组、NaBt组和4 Gy X射线照射组比较,NaBt联合4 Gy X射线照射组细胞中caspase-3和p21 mRNA表达水平均明显升高(P<0.05或P<0.01);与对照组比较,NaBt组和4 Gy X射线照射组细胞中p21 mRNA表达水平均明显升高(P<0.01);与4 Gy X射线照射组比较,NaBt组细胞中p21 mRNA表 达 水 平 明 显 升 高 (P<0.01)。见表3。
表3 各组细胞中caspase--3和p21mRNA表达水平Tab.3 Expression levels of caspase -3 and pp2211 mRNA of cells in various groups (n=3,±s)

表3 各组细胞中caspase--3和p21mRNA表达水平Tab.3 Expression levels of caspase -3 and pp2211 mRNA of cells in various groups (n=3,±s)
*P<0.01 vs control group;△P<0.05,△△P<0.01 vs NaBt group;#P<0.05,##P<0.01 vs 4 Gy X-ray irradiation group.
Group Control NaBt 4 Gy X-ray irradiation NaBt combined with 4 Gy X-ray irradiation P21 1.00±0.16 6.85±0.30*##3.68±0.19*16.09±1.67*△△##Caspase-3 1.00±0.18 1.32±0.10 0.92±0.19 2.75±0.53*△#
3 讨 论
越 来 越 多 的 证 据[5-7,12-14]表 明 : HDACi中 的NaBt具有抗肿瘤活性,且HDACi介导的肿瘤细胞死亡通常是诱导细胞凋亡。而凋亡途径的缺陷和凋亡蛋白的失调,在癌症的发生和治疗耐药中起着决定性的作用[15-16]。
本课题组前期研究[11]显示:NaBt对NSCLC A549细胞具有增殖抑制作用,并呈浓度和时间依赖性,可引起细胞G1/G0期阻滞。为进一步探索其肿瘤抑制机制,本研究检测了NaBt作用后A549细胞凋亡率、ROS水平、Δψm和 caspase-3及 p21 mRNA表达水平,结果显示:NaBt可诱导肺癌A549细胞凋亡,且呈时间依赖性,表明NaBt在A549细胞中的细胞毒作用是通过细胞凋亡引起的。NATONI等[17]在胰腺癌细胞中也发现:NaBt通过内源性和外源性凋亡途径致敏。同时,在本研究中,NaBt引起A549细胞ROS水平升高。ROS积累会导致某些细胞功能受损并有促进细胞凋亡作用[18]。以往有研究[19]证实:NaBt通过氧化应激诱导细胞凋亡,与本研究结果一致。本研究结果显示:NaBt作用后,A549细胞Δψm下降,与ROS水平升高相一致,提示ROS和线粒体膜参与该过程。线粒体是ROS攻击的靶点之一,ROS可导致Δψm下降[20]。同时,本研究结果显示:NaBt作用后,A549细胞中caspase-3和p21 mRNA表达水平升高。caspases活性信号分子的功能与细胞凋亡和炎症相关,其中,caspases-3是凋亡的执行者[21]。本研究中caspase-3 mRNA表达水平升高与凋亡率升高结果相一致。以上结果提示:NaBt通过ROS水平升高和线粒体损伤进而导致A549细胞凋亡。p21 mRNA表达水平升高提示NaBt对细胞周期的影响。CHEN等[22]发现:NaBt与多西紫杉醇丙酸钠联合对A549细胞有增殖抑制和促进凋亡作用。所以NaBt可能是一种有效的NSCLC临床治疗药物。
本研究同时检测了4 Gy X射线照射对A549细胞的作用,结果显示:各组细胞上述各检测指标均无明显变化,可能是由于A549细胞的辐射抗性。而NaBt和4 Gy X射线联合作用,则引起A549细胞凋亡,且呈时间依赖性,细胞中ROS水平升高,Δψm降低,caspase-3和p21 mRNA表达水平升高,且二者联合作用效果更优,表明NaBt通过增加辐射诱导的A549细胞线粒体损伤而引起细胞凋亡增加,与本课题组之前的研究[11]结果相一致。有研究[23]显示:HDACi CUDC-101和SAHA在胰腺癌细胞中可增强辐射引起的细胞毒作用。HDACi能够增加甲状腺癌的辐射敏感性[24]。
综上所述,NaBt可能是一种有效的NSCLC临床治疗药物,同时可能有助于提高辐射敏感性。本研究为NSCLC的治疗提供了新的策略,对NSCLC患者的治疗具有重要的临床意义。

