丹参酮ⅡA对缺氧缺血性脑病新生大鼠海马组织中miR-132表达的调节作用及其机制
张 洋,陈美月,崔 莹,刘 娜
(吉林大学第一医院二部儿科,吉林 长春 130031)
缺氧缺血性脑病是一种严重的新生儿脑损伤,由产程中窒息缺乏脑供氧和缺氧而发生,可导致新生儿过早死亡或各种终身疾病,包括急性症状,如癫痫发作、意识改变、呼吸微弱、肌肉张力差和代谢紊乱,以及慢性疾病,如脑瘫、癫痫、智力残疾和行为障碍[1-4]。缺氧缺血性脑病发生的病理生理学机制包括氧化应激、细胞内钙离子(Ca2+)积累、线粒体功能障碍、兴奋性毒性和炎症[5]。目前临床上唯一被认可的治疗新生儿缺氧缺血性脑病的方法是降低体温,但其治疗的有效率不超过50%[6],所以探索新生儿缺氧缺血性脑病新的治疗方法十分必要。丹参酮ⅡA(tanshinone ⅡA,Tan Ⅱ A)是丹参中最丰富的脂溶性成分,Tan Ⅱ A及其衍生物Tan Ⅱ A磺酸钠已被证明具有抗炎、抗氧化和抗纤维化功能,已在临床上广泛应用[7-9]。Tan Ⅱ A对缺氧缺血性脑病的治疗作用已在动物模型[10]中证明,但其发挥作用的具体机制尚不完全明确。微小RNA(microRNA,miRNA)是基因表达的关键调节因子,主要在转录后水平调节大量靶信使RNA(messenger RNA,mRNA)的表达。miR-132是一种miRNA,其表达是神经元正常发育、成熟和功能所必需的,其表达失调与多种神经系统疾病有关。研究[11]表明:miR-132对缺血性卒中小鼠脑损伤有保护作用。miR-132上调可减轻缺血性神经元损伤[12]。本研究建立了新生大鼠缺氧缺血性脑病模型,探讨Tan Ⅱ A对模型大鼠海马组织中miR-132表达的影响,阐明其发挥作用的可能机制,为新生儿缺氧缺血性脑病的治疗提供理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器 40只SPF级SD大鼠,7日龄,雌雄不限,体质量12~18 g,购自辽宁省长生生物有限公司,动物生产许可证号:SCXK(辽)2019-0001,新生鼠母乳喂养。Tan Ⅱ A注射液(上海第一生化药业有限公司),miR-132阴性对照质粒(miR-132 NC)和miR-132抑制剂(miR-132 antagomir)(上海吉玛制药技术有限公司),总RNA提取试剂盒、实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)试剂盒和逆转录试剂盒(南京诺唯赞生物科技股份有限公司),BCA试剂盒(美国Thermo公司),PCR引物[生工生物(上海)股份工程有限公司],酶联免疫吸附测定(enzymelinked immunosorbent assay, ELISA)试剂盒(武汉优尔生科技股份有限公司),突触后致密蛋白95(postsynaptic density-95,PSD-95)抗体、生长相关蛋白 43(growth-associated protein-43, GAP-43)抗体、微管相关蛋白2(microtubule-associated protein-2,MAP-2)抗体和脑源性神经营养因子(brain derived neurotrophic factor, BDNF) 抗 体(武汉三鹰生物技术有限公司),快速高尔基染色试剂盒(美国FD NeuroTechnologies公司)。-80℃超低温冰箱(美国Thermo公司),台式低温高速离心机、脱水机、石蜡包埋机和切片机(德国Leica公司),组织研磨仪(北京托摩根生物科技有限公司),荧光显微镜(日本Olympus公司),酶标仪(上海中庸检验设备有限公司),RT-qPCR仪(瑞士Roche公司),普通PCR仪(美国ABI公司),微量分光光度计(美国Thermo公司),全自动化学发光分析系统(上海天能科技有限公司)。
1.2 新生大鼠缺氧缺血性脑病模型建立和实验动物分组 建立缺氧缺血性脑病模型具体方法如下:将大鼠麻醉后颈正中切开皮肤,分离颈总动脉后,用5-0无创缝合线进行双重结扎,从结扎线中间剪断血管,消毒后缝合,手术后恢复2 h,将恢复后大鼠置于缺氧舱,向舱内通入92%氮气和8%氧气混合气体,持续缺氧2 h[13]。40只新生SD大鼠随机分为假手术组、模型组、Tan IIA组和miR-132 antagomir组,每组10只。假手术组大鼠腹腔注射戊巴比妥钠麻醉后,颈正中切开皮肤,分离颈总动脉后不做处理,消毒后缝合,将恢复后大鼠置于正常氧舱2 h。模型组、Tan Ⅱ A组和miR-132 antagomir组大鼠建立缺氧缺血性脑病模型。Tan Ⅱ A组大鼠造模成功后腹腔注射Tan Ⅱ A注射液 (24 mg·kg-1体质量),双侧脑室注射2 μg miR-132 NC[11]。假手术组和模型组大鼠造模成功后腹腔注射与Tan IIA注射液等量的生理盐水,双侧脑室注射与miR-132 NC等量的生理盐水。miR-132 antagomir组大鼠造模成功后腹腔注射Tan Ⅱ A注射液 (24 mg·kg-1体质量),双侧脑室注射 2 μg miR-132 antagomir[11]。各组大鼠连续注射 7 d。
1.3 RT-qPCR法检测各组大鼠海马组织中miR-132表达水平 Trizol法提取组织总RNA,反转录成cDNA,按SYBR试剂盒说明书配制PCR反应体系,反应条件:95℃预变性10 min;95℃、10 s,60℃、30 s,72℃、10 s,40个循环。以U6为内参,根据2-△△Ct法计算miR-132表达水平。
1.4 荧光原位杂交检测各组大鼠海马组织中miR-132表达强度 组织标本均冰冻切片,室温干燥,多聚甲醛固定,DEPC-PBS缓冲液洗涤,0.2 mol·L-1盐酸作用 10 min,蛋白酶 K 工作液孵育 15 min,0.1 mol·L-1三乙醇胺作用 5 min,乙酰化10 min,SCC缓冲液孵育5 min,杂交探针避光42℃过夜,SCC缓冲液洗涤,DAPI孵育20 min,荧光显微镜观察,miR-132表达强度通过Image J软件计算,以平均荧光强度表示,miR-132表达强度=该区域荧光强度总和/该区域面积。
1.5 大鼠改良神经功能缺失评分 各组大鼠处死前进行改良神经功能缺失评分[14],由运动、感觉、反射和平衡试验组成,按0~18分进行评分,分值越高,损害程度越严重。评分标准如下:提起鼠尾后前肢屈曲、后肢屈曲和30 s内头部运动并偏离垂直线大于10°各计1分;将大鼠置于地板上,头与身体呈10°角观察30 s,正常爬行计0分,不能径直向前爬行计1分,向患侧旋转计2分,向患侧倒下计3分;大鼠爬至桌边时肢体不能收缩或支持身体计1分;大鼠向桌面边沿推鼠爪,四肢活动跃计1分;横梁实验,正常计0分,紧抓横梁边缘计1分,紧握横梁但一只肢体掉下计2分,紧握横梁但两只肢体掉下或在上旋转60 s计3分,试图在横梁上保持平衡但仅能维40 s计4分,试图在横梁上保持平衡但仅能维20 s计5分,从横梁上掉下计6分;刺激耳道后摇头计1分;棉絮刺激角膜后眨眼计1分;听到突然声响后运动或尖叫计1分;抽搐、肌阵挛张力异常计1分。
1.6 HE染色观察各组大鼠海马组织病理形态表现 将4%多聚甲醛固定的大鼠海马组织经梯度酒精脱水和二甲苯透明后,石蜡包埋,切成5 μm厚的薄片并烘干。二甲苯脱蜡,梯度酒精水化,蒸馏水洗涤。将切片放入苏木素染色3 min,自来水洗涤,1%盐酸乙醇分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗,伊红染色3 min。梯度乙醇脱水,二甲苯透明,中性树胶封片。采用光学显微镜观察切片并拍照。
1.7 TUNEL法检测各组大鼠海马组织中神经元凋亡率 应用TUNEL试剂盒检测大脑海马组织凋亡率。大脑海马组织石蜡切片经二甲苯脱蜡2次,梯度乙醇浸泡,加入20 g·L-1无DNase的蛋白酶K,37℃孵育30 min,PBS缓冲液洗涤。切片后加入50 μL TUNEL检测液,37℃避光孵育6 min;PBS缓冲液洗涤3次,加DAPI,室温孵育15 min;PBS缓冲液洗涤3次,用抗荧光淬灭液封片,荧光显微镜观察并拍照。神经元凋亡率=TUNEL阳性细胞数/DAPI阳性细胞数×100%。
1.8 ELISA法检测各组大鼠海马组织中去甲肾上腺素、多巴胺和5-羟色胺水平 严格按照ELISA试剂盒说明书操作,检测大鼠大脑海马组织匀浆中去甲肾上腺素、多巴胺和5-羟色胺水平。
1.9 高尔基染色检测各组大鼠海马组织中树突棘密度 按照快速高尔基染色试剂盒说明书操作[15]。取大鼠脑组织置于固定液中固定48 h以上,根据需要观察的组织部位将大鼠脑组织切成2~3 mm厚的组织块,用生理盐水将脑组织轻轻漂洗几遍,置于45 mL的圆底EP管中,加入高尔基染液将脑组织完全浸没,放置阴凉通风处避光处理14 d;蒸馏水浸洗3次,倒入80%冰醋酸浸没组织,过夜,待组织变软后蒸馏水洗,置于30%蔗糖中;甲切片机将组织切成100 μm厚的切片,贴在明胶玻片上;将晾干后的组织玻片以浓氨水处理15 min,蒸馏水洗1 min,酸性坚膜定影液处理15 min,蒸馏水洗3 min,晾干,甘油明胶封片。采用Image J软件计算大鼠海马组织中树突棘密度,树突棘密度=树突长度/树突棘数量。
1.10 Western blotting法检测各组大鼠海马组织中 PSD-95、GAP-43、MAP-2和 BDNF 蛋白表达水平 使用RIPA裂解液提取组织总蛋白,将裂解液加入组织中,冰上孵育30 min,匀浆机匀浆,4℃、12 000 r·min-1离心 20 min,取上清,BCA 法定量蛋白,煮样,上样于聚丙烯酰胺凝胶,电泳分离蛋白,将蛋白转移到PVDF膜上,5%脱脂奶粉封闭,一抗4℃孵育过夜,PBST洗膜,二抗室温孵育1 h,PBST洗膜,ECL化学发光,采用Image J软件进行灰度值分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.11 统计学分析 采用SPSS 22.0统计软件进行统计学分析。各组大鼠海马组织中miR-132表达水平,各组大鼠神经功能缺失评分,各组大鼠海马组织中神经元凋亡率,各组大鼠海马组织中去甲肾上腺素、多巴胺和5-羟色胺水平,树突棘密度以及PSD-95、GAP-43、MAP-2和BDNF蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用Tukey事后检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠海马组织中miR-132表达水平和表达强度 RT-qPCR结果显示:假手术组、模型组、Tan Ⅱ A组和miR-132 antagomir组大鼠海马组织中miR-132表 达 水 平 分 别 为 1.00±0.02、0.27±0.05、0.79±0.11和0.32±0.08。荧光原位杂交结果显示:假手术组、模型组、Tan Ⅱ A组和miR-132 antagomir组大鼠海马组织miR-132表达强度分别为 0.85±0.05、0.11±0.01、0.53±0.15和0.14±0.03。与假手术组比较,模型组大鼠海马组织中miR-132表达水平和表达强度明显降低(P<0.05);与模型组比较,Tan Ⅱ A组大鼠海马组织中miR-132表达水平和表达强度明显升高(P<0.05);与Tan Ⅱ A组比较,miR-132 antagomir组大鼠海马组织中miR-132表达水平和表达强度明显降低(P<0.05)。见图1。
2.2 各组大鼠神经功能缺失评分 假手术组大鼠神经功能缺失评分为0,无神经功能缺失;与假手术组比较,模型组大鼠神经功能缺失评分(9.70分±1.16分)明显升高(P<0.05);与模型组比较,Tan Ⅱ A组大鼠神经功能缺失评分(4.20分±0.63分)明显降低(P<0.05);与Tan Ⅱ A组比较,miR-132 antagomir组大鼠神经功能缺失评分(8.40分±1.51分)明显升高(P<0.05)。
2.3 各组大鼠海马组织病理形态表现 假手术组大鼠海马组织中神经元形态结构清晰完整,核仁清楚,神经元无水肿,无胶质细胞浸润;模型组大鼠海马组织出现神经元肿胀,胞核偏位,排列紊乱,深染,数量减少,胶质细胞增生;Tan Ⅱ A组大鼠海马组织中神经元形态结构较完整,水肿改善,排列较整齐,胶质细胞增生改善;与Tan Ⅱ A组比较,miR-132 antagomir组大鼠海马组织中神经元损伤加重。见图2。
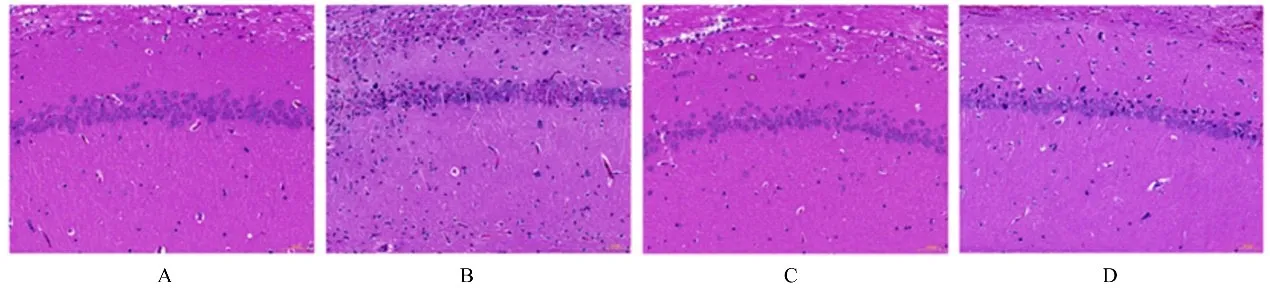
图2 各组大鼠海马组织病理形态表现(HE,×100)Fig.2 Pathomorphology of hippocampus tissue of rats in various groups(HE,×100)
2.4 各组大鼠海马组织中神经元凋亡率 与假手术组(2.83%±0.74%)比较,模型组大鼠海马组织中神经元凋亡率(48.93%±2.92%)明显升高(P<0.05);与模型组比较,Tan Ⅱ A组大鼠海马组织中神经元凋亡率(13.25%±1.95%)明显降低 (P<0.05); 与 Tan Ⅱ A组比 较,miR-132 antagomir组大鼠海马组织中神经元凋亡率(35.82%±2.77%) 明 显 升 高 (P<0.05)。见图3。
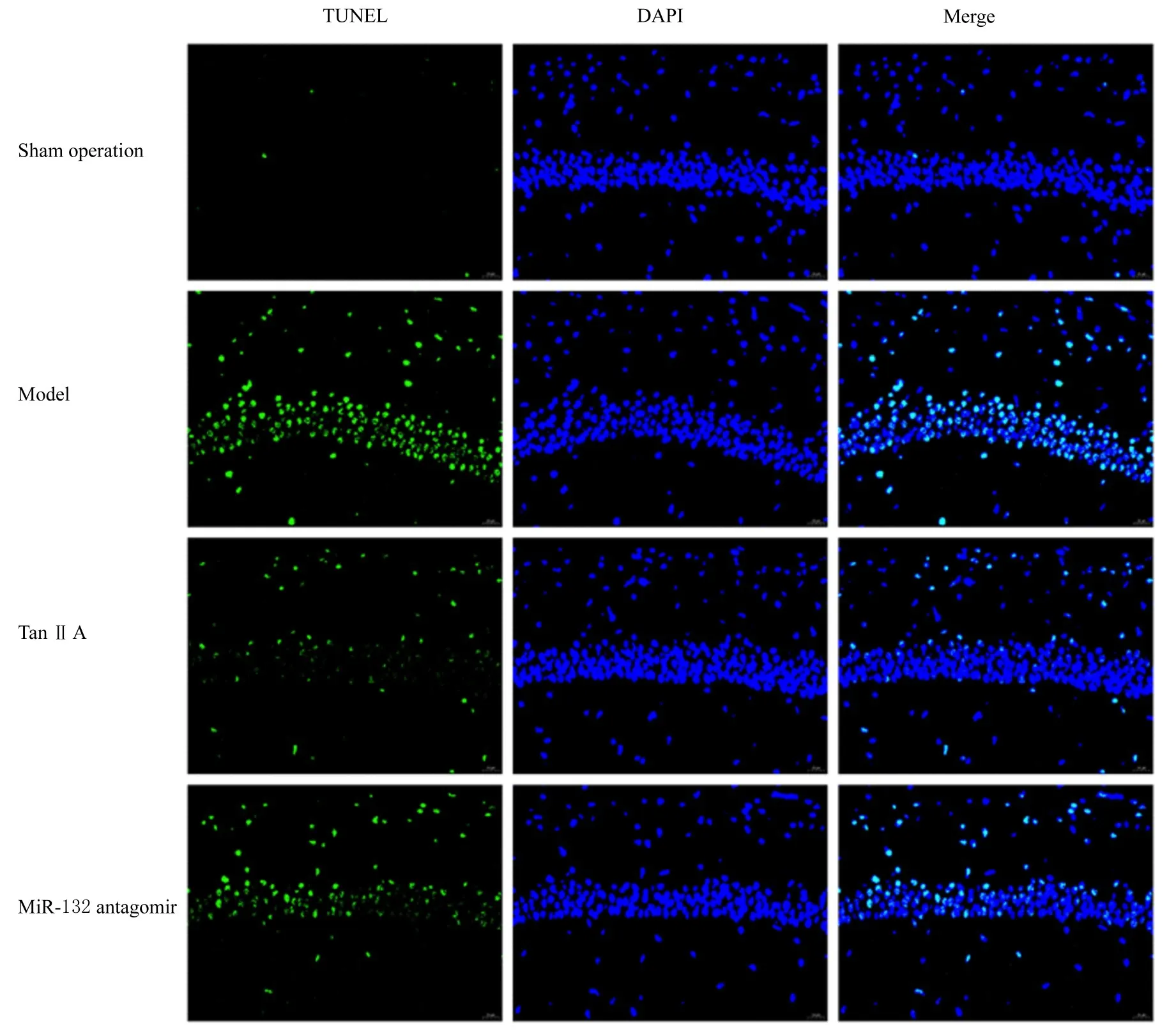
图3 各组大鼠海马组织TUNEL免疫荧光染色结果(×200)Fig.3 Results of TUNEL immunofluorescence staining of hippocampus tissue of rats in various groups(×200)
2.5 各组大鼠海马组织中去甲肾上腺素、多巴胺和5-羟色胺水平 与假手术组比较,模型组大鼠海马组织中去甲肾上腺素、多巴胺和5-羟色胺水平明显降低(P<0.05);与模型组比较,Tan Ⅱ A组大鼠海马组织中去甲肾上腺素、多巴胺和5-羟色胺水平明 显 升 高 (P<0.05); 与 Tan Ⅱ A组 比 较,miR-132 antagomir组大鼠海马组织中去甲肾上腺素、多巴胺和5-羟色胺水平明显降低(P<0.05)。见表1。
表1 各组大鼠海马组织中去甲肾上腺素、多巴胺和5--羟色胺水平Tab. 1 Levels of noradrenaline, dopamine, and 5-hydroxytryptamine in hippocampus tissue of rats in various groups[n=10,±s, ρB/(μg·L-1)]

表1 各组大鼠海马组织中去甲肾上腺素、多巴胺和5--羟色胺水平Tab. 1 Levels of noradrenaline, dopamine, and 5-hydroxytryptamine in hippocampus tissue of rats in various groups[n=10,±s, ρB/(μg·L-1)]
*P<0.05 compared with sham operation group;△P<0.05 compared with model group;#P<0.05 compared with Tan Ⅱ A group.
Group Sham operation Model Tan Ⅱ A MiR-132 antagomir 5-Hydroxytryptamine 31.23±2.14 19.82±1.35*28.77±2.01△20.05±1.28#Noradrenaline 16.23±1.77 8.94±0.85*14.82±1.23△9.11±0.91#Dopamine 0.38±0.05 0.14±0.03*0.33±0.07△0.18±0.04#
2.6 各组大鼠海马组织中树突棘密度 假手术组、模型组、Tan Ⅱ A组和miR-132 antagomir组大鼠海马组织中树突棘密度分别为(1.35±0.08)、(0.61±0.05)、(0.98±0.07) 和 (0.65±0.06) μm-1;与假手术组比较,模型组大鼠海马组织中树突棘密度明显降低(P<0.05);与模型组比较,Tan Ⅱ A组大鼠海马组织中树突棘密度明显升高(P<0.05);与Tan Ⅱ A组比较,miR-132 antagomir组大鼠海马组织中树突棘密度明显降低(P<0.05)。见图4。

图4 各组大鼠海马组织高尔基染色结果(×400)Fig.4 Results of Golgi-cox staining of hippocampus tissue of rats in various groups(×400)
2.7 各组大鼠海马组织中PSD-95、GAP-43、MAP-2和BDNF蛋白表达水平 与假手术组比较,模型组大鼠海马组织中PSD-95、GAP-43、MAP-2和BDNF蛋白表达水平明显降低(P<0.05);与模型组比较,Tan Ⅱ A组大鼠海马组织中PSD-95、GAP-43、MAP-2和BDNF蛋白表达水平明显升高(P<0.05);与Tan Ⅱ A组比较,miR-132 antagomir组大鼠海马组织中PSD-95、GAP-43、MAP-2和BDNF蛋白表达水平明显降低(P<0.05)。见图 5。

图5 Western blotting法检测各组大鼠海马组织中PSD-95、GAP-43、MAP-2和BDNF蛋白表达电泳图(A)和直条图(B)Fig.5 Electrophoregram (A)and histogram (B)of expressions of PSD-95,GAP-43,MAP-2,and BDNF proteins in hippocampus tissue of rats in various groups detected by Western blotting method
3 讨 论
缺氧缺血性脑病由脑血流中断和随后缺氧导致的患病区域引起,是导致死亡和视力障碍、学习障碍、癫痫、智力低下、失明和脑瘫等终身残疾风险增加的主要原因之一。由于大脑含有高浓度的不饱和脂肪酸、高耗氧量、低浓度的抗氧化剂、高含量的金属催化自由基形成以及大量敏感的未成熟细胞,大脑需要高水平的氧气供应,因此对缺氧极为敏感,缺氧缺血事件后,氧化应激触发氧和氮的释放、钙超载、自由基生成、兴奋性毒性、酸毒性、离子失衡、炎症、细胞凋亡、自噬和坏死,在发病机制中起重要作用[5]。miRNA与正常的大脑发育有关,可能参与缺氧缺血性损伤的机制。研究[11]表明:miR-132对缺血性卒中小鼠脑损伤有保护作用。miR-132上调可减轻缺血性神经元损伤[12]。本研究结果显示:缺氧缺血性脑病新生大鼠海马组织中miR-132表达水平降低,Tan Ⅱ A可以上调大鼠海马组织中miR-132表达水平,抑制miR-132表达可降低Tan Ⅱ A处理的缺氧缺血性脑病新生大鼠海马组织miR-132表达,表明miR-132可能在Tan Ⅱ A对新生大鼠缺氧缺血性脑病的治疗中发挥作用。
神经元是神经系统发挥功能的基本单位,缺氧缺血性脑病发生后,海马血供下降,神经元线粒体短期内能量衰竭,造成神经元死亡,神经炎症参与各种细胞死亡机制,在急慢性神经损伤中发挥重要作用[16]。本研究结果显示:缺氧缺血性脑病新生大鼠海马组织损伤加重且神经元凋亡率增加,Tan Ⅱ A可以改善大鼠海马组织损伤,降低神经元凋亡率,抑制miR-132表达可削弱Tan Ⅱ A对大鼠海马组织脑损伤的改善作用,增加神经元凋亡率,提示Tan Ⅱ A可能通过上调miR-132表达,减轻缺氧缺血性脑病所致的脑损伤,降低海马神经元凋亡率。
单胺类神经递质是记忆形成及存储中不可或缺的环节之一,主要包括去甲肾上腺素、多巴胺和5-羟色胺等,脑内缺氧缺血时,脑组织中单胺类神经递质代谢发生紊乱,导致神经功能障碍[17]。本研究结果显示:缺氧缺血性脑病新生大鼠海马组织单胺类神经递质紊乱,Tan Ⅱ A可以降低新生大鼠海马组织单胺类神经递质水平,抑制miR-132表达可增加Tan Ⅱ A处理后缺氧缺血性脑病新生大鼠海马组织中已降低的单胺类神经递质水平,提示Tan Ⅱ A可能通过上调miR-132表达,减轻缺氧缺血性脑病所致的单胺类神经递质紊乱。
树突棘是树突分支上的棘状突起,是神经元间形成突触的主要部位,其数量和形态结构的变化与神经系统发育及学习记忆功能密切相关。研究[18]表明:缺血性脑损伤可造成树突棘数量减少。突触可塑性是神经元改变突触结构和强度的能力,对于完善神经元回路以响应发育过程中的感官体验及成人的学习和记忆形成至关重要[19]。PSD-95位于突触后膜,在刺激和维持突触结构和功能可塑性中起着重要作用[20],其参与维持正常的突触功能和可塑性[21]。GAP-43是一种突触前膜蛋白,参与神经元细胞外生长和突触发育,介导轴突伸长和改变细胞形态[22]。本研究结果显示:Tan Ⅱ A可以增加缺氧缺血性脑病新生大鼠海马组织中树突棘密度及突触相关蛋白GAP-43和PSD-95蛋白表达水平,抑制miR-132表达可降低Tan Ⅱ A处理的新生大鼠海马组织树突棘密度及GAP-43和PSD-95蛋白表达,提示Tan Ⅱ A可能通过上调miR-132表达,增加缺氧缺血性脑病新生大鼠突触可塑性。
MAP-2是一种重要的细胞骨架蛋白,主要在神经元的胞体和树突中表达,具有组装微管、构成并稳定细胞骨架结构和改变突触可塑性的作用,其表达水平降低可导致微管变形堆积,影响细胞骨架完整性,最终导致神经元死亡[23]。BDNF已被证明可以保护缺氧缺血性脑病诱导的脑损伤[24]。本研究结果显示:Tan Ⅱ A可以增加缺氧缺血性脑病新生大鼠海马组织中MAP-2和BDNF蛋白表达水平,抑制miR-132表达可降低Tan Ⅱ A处理的新生大鼠海马组织中MAP-2和BDNF蛋白表达,进一步证明了Tan Ⅱ A可能通过上调miR-132保护缺氧缺血性脑病所致的大鼠脑损伤。
综上所述,Tan Ⅱ A可上调缺氧缺血性脑病新生大鼠海马组织中miR-132表达,改善新生大鼠神经功能及海马组织病理损伤,其机制可能与抑制海马神经元凋亡以及增加海马神经递质水平、树突棘密度、突触前蛋白及MAP-2和BDNF蛋白表达有关。

