不同模式神经阻滞复合PCIA对非小细胞肺癌手术患者术后疼痛、免疫指标的影响
李光耀,李伟,张雅磊
空军军医大学唐都医院麻醉手术科,陕西 西安 710038
肺癌是一类危害性极高的恶性肿瘤,据2018年全球癌症统计数据[1]显示,肺癌的发病率和病死率已跃居癌症排行榜的榜首。其中非小细胞肺癌(non-smallcell lung cancer,NSCLC)是肺癌的常见病理类型,占比可达80%。随着国家对疾病预防重视,广大群众对疾病的预防意识加深,随着低剂量螺旋CT 等筛查技术的发展,越来越多早期肺癌被发现,可进行手术治疗的NSCLC 患者逐渐增加[2]。电视辅助胸腔镜技术(video-assisted thoracic surgery,VATS)相较于传统开胸手术对患者的损伤明显更低,可通过现代电视高清摄像技术放大胸腔组织,且不受角度影响,手术视野清晰。三孔、单孔胸腔镜及达芬奇机器人等新技术的应用是微创手术的重大进展,克服了大切口、大创伤、术后切口剧痛的缺点,也从根本上改变了胸外科疾病的治疗模式[3]。尽管如此,接受VATS的患者仍无法避免剧烈疼痛症状,为尽量降低疼痛对患者身心状况和预后造成的负面影响,需采取良好的术后镇痛手段。近年来,联合使用不同作用机制的镇痛药物或不同模式的镇痛措施在临床取得了良好的效果,多种机制叠加的“多模式镇痛”概念已得到广大临床医师的认可[4]。本研究旨在对比分析不同模式神经阻滞复合静脉自控镇痛(patient controlled intravenous analgesia,PCIA)的临床效果,以寻求最佳的镇痛方法。
1 资料与方法
1.1 一般资料 选择 2019 年 3 月至 2021 年 2 月于空军军医大学唐都医院治疗的95例NSCLC患者为研究对象。纳入标准:①均符合《肿瘤综合诊疗新进展》(第3 版)[5]中早期NSCLC的诊断标准,且经病理检查确诊;②ASA分级Ⅰ~Ⅱ级;③择期行胸腔镜肺癌根治术治疗;④初中及以上文化程度;⑤均对本研究知情同意。排除标准:①合并严重高血压、心脏病、糖尿病等重大脏器疾病;②有慢性疼痛病史者;③合并中枢神经、精神类疾病;④肝肾功能异常者;⑤滥用药物、麻醉药物史和酗酒史。按照随机数字表法将患者分为A组(n=32)、B组(n=32)和C组(n=31),A组行肋间神经阻滞,B组行胸内直视下椎旁神经阻滞,C组行超声引导下经皮椎旁神经阻滞。本研究经我院医学伦理审查委员会审查批准。
1.2 麻醉方法 所有患者术前常规禁食8 h、禁水4 h,入室后常规监测患者生命体征,使用2%利多卡因(邯郸康业制药有限公司,国药准字H13021218)局麻下行桡动脉穿刺置管,进行全身麻醉,使用芬太尼(河南羚锐制药股份有限公司,国药准字H20163278)0.4 μg/kg、丙泊酚(宜昌人福药业有限责任公司,国药准字H20210017)1.5 mg/kg和顺式阿曲库铵0.2 mg/kg进行静脉麻醉诱导,气管插管使用呼吸机控制呼吸,然后行深静脉置管,并使用丙泊酚10 mg/(kg·h)和瑞芬太尼(宜昌人福药业有限责任公司,国药准字H20030197)6 mg/(kg·h)进行麻醉维持,并在手术结束时停止给药。转入复苏室观察,待患者清醒后开启镇痛泵。A 组行肋间神经阻滞,手术完成后关胸前由施术者在肋间切口上下及放置引流管的肋间上下,自壁层胸膜向外依次注药,每个肋间使用5 mL 0.75%罗哌卡因(济川药业集团有限公司,国药准字H20203094);B组行胸内直视下椎旁神经阻滞,关胸前,施术者在胸腔镜下分别于相应手术肋间上下共6个肋间所对应的椎体旁行胸椎旁神经阻滞,使用血管钳夹住头皮针,于相应椎体的肋间隙进针并注意避开胸膜毛细血管,回抽无血后推注0.75%罗哌卡因直至肋间隙胸膜充盈。C 组行超声引导下经皮椎旁神经阻滞,麻醉医师在气管插管完成后将手术切口所在的肋间水平距椎体横图1.5~2 cm椎旁间隙作为穿刺点,使用超声探头在穿刺点附近进行扫查,获得椎旁间隙图像后观察胸膜移动情况,确定椎旁间隙后使用局麻针于超声探头上进针,并在超声指导下随时调整位置,进针至椎旁间隙,回抽无血后向每个椎旁间隙注入5 mL 0.75%的罗哌卡因。
1.3 观察指标与评价(检测)方法 ①疼痛程度:分别于术后1 h、2 h、3 h、24 h 和48 h 进行视觉模拟疼痛评分(Visual Analogue Scale,VAS)[6]评估患者术后疼痛程度,该量表分值0~10 分,得分越高则疼痛程度越高。②免疫功能:分别于术前1 d 和术后48 h 抽取患者外周静脉血,检测外周血CD4+、CD8+、CD4+/CD8+T淋巴细胞比值。③应激水平:分别于术前1 d 和术后48 h 抽取患者外周静脉血,使用全自动血液生化分析仪检测患者血清皮质醇(Cor)和前列腺素E2(PGE2)水平。
1.4 统计学方法 应用SPSS19.0 统计学软件进行数据分析。计数资料比较采用χ2检验,计量资料符合正态分布,以均数±标准差()表示,相同时间点组间比较采用单因素方差分析,三组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组患者的一般资料比较 三组患者的性别、年龄、体质量指数(BMI)、ASA 分级比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 三组患者的一般资料比较[,例(%)]

表1 三组患者的一般资料比较[,例(%)]
组别A组B组C组χ2/F值P值例数32 32 31性别(男/女)19/13 20/12 19/12 0.067 0.967年龄(岁)61.03±4.64 61.93±5.03 60.88±4.75 0.443 0.644 BMI(kg/m2)23.61±2.10 22.86±2.41 23.47±2.33 0.974 0.382 ASA分级(Ⅰ级/Ⅱ级)5/27 7/25 7/24 0.582 0.747
2.2 三组患者术后各时间点疼痛程度比较 术后1 h、2 h、3 h、24 h、48 h,B组和C组患者的VAS评分明显低于A组,差异均有统计学意义(P<0.05),但B组和C 组患者术后各时点的VAS 评分比较差异均无统计学意义(P>0.05),见表2。
表2 三组患者术后各时间点的VAS评分比较(,分)

表2 三组患者术后各时间点的VAS评分比较(,分)
注:与A组比较,aP<0.05。
组别A组B组C组χ2/F值P值例数32 32 31术后1 h 4.66±0.87 1.33±0.43a 1.62±0.49a 274.122 0.001术后2 h 4.05±0.90 1.25±0.37a 1.46±0.41a 207.305 0.001术后3 h 3.34±0.65 1.17±0.32a 1.33±0.53a 173.600 0.001术后24 h 2.45±0.43 0.97±0.30a 1.10±0.44a 137.447 0.001术后48 h 1.67±0.46 1.37±0.39a 1.25±0.37a 8.859 0.001
2.3 三组患者手术前后的免疫指标比较 术前1 d,三组患者的CD4+、CD8+、CD4+/CD8+比较差异均无统计学意义(P>0.05);术后48 h,三组患者的CD4+、CD4+/CD8+和 CD8+与术前 1 d 比较,CD4+、CD4+/CD8+均降低,而CD8+升高,且B 组和C 组患者的CD4+和CD4+/CD8+明显高于 A 组,CD8+明显低于 A 组,差异均有统计学意义(P<0.05),但B组和C两组患者间比较差异均无统计学意义(P>0.05),见表3。
表3 三组患者手术前后的免疫指标比较()
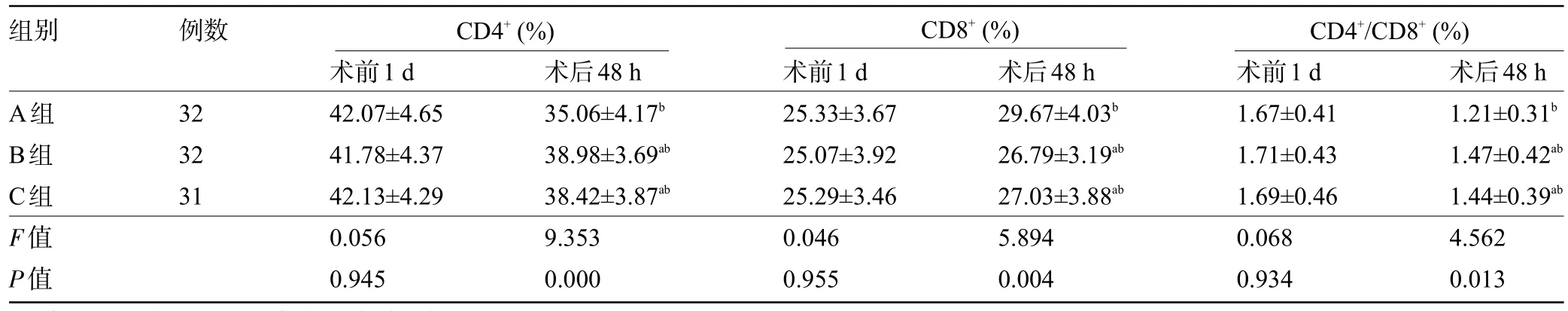
表3 三组患者手术前后的免疫指标比较()
注:与A组比较,aP<0.05;与本组术前比较,bP<0.05。
组别 例数CD4+(%) CD8+(%) CD4+/CD8+(%)A组B组C组F值P值术后48 h 1.21±0.31b 1.47±0.42ab 1.44±0.39ab 4.562 0.013 32 32 31术前1 d 42.07±4.65 41.78±4.37 42.13±4.29 0.056 0.945术后48 h 35.06±4.17b 38.98±3.69ab 38.42±3.87ab 9.353 0.000术前1 d 25.33±3.67 25.07±3.92 25.29±3.46 0.046 0.955术后48 h 29.67±4.03b 26.79±3.19ab 27.03±3.88ab 5.894 0.004术前1 d 1.67±0.41 1.71±0.43 1.69±0.46 0.068 0.934
2.4 三组患者手术前后的应激指标比较 术前1 d,三组患者Cor 和PGE2 水平比较差异均无统计学意义(P>0.05);术后48 h,三组患者的Cor和PGE2水平与术前比较,Cor 和 PGE2 均升高,且 B 组和 C 组患者的Cor和PGE2水平明显低于A组,差异均有统计学意义(P<0.05),但B组和C组患者间比较差异无统计学意义(P>0.05),见表4。
表4 三组患者手术前后的应激指标比较()

表4 三组患者手术前后的应激指标比较()
注:与A组比较,aP<0.05;与本组术前比较,bP<0.05。
组别 例数Cor(ng/mL) PGE2(pg/mL)术后48 h术前1 d 术后48 h 术前1 d A组B组C组F值P值149.26±15.74b 124.39±13.67ab 123.67±13.28ab 33.589 0.001 32 32 31 67.49±8.69 67.81±9.06 68.03±8.75 0.030 0.971 99.67±10.48b 91.43±9.27ab 90.97±9.44ab 8.021 0.001 104.46±13.26 103.79±12.96 104.18±13.51 0.021 0.980
3 讨论
随着我国工业化进程加快和吸烟人群低龄化等因素影响,肺癌已成为发病率和致死率排名最高的恶性肿瘤,NSCLC 作为肺癌最常见的病理类型,严重威胁到人们的生命健康[7]。随着人们体检意识增强和CT 技术的不断进步,越来越多早期肺癌患者被发现,对于早期NSCLC 患者而言,手术仍为最主要的治疗手段。传统开胸手术因创口大、术后恢复慢、疼痛剧烈等负面作用在临床应用中受到了一定的限制,部分患者因对开胸手术存在恐惧而选择保守治疗,从而延误了最佳救治时机,严重影响治疗效果[8]。与传统开胸手术相比,VATS 手术具有创伤小、出血少、疼痛较轻等优点,VATS 肺癌根治术现已成为外科医生常用的治疗手段。但VATS 肺癌根治术仍具有较大的创伤,若术后疼痛控制不佳,极易诱发血压升高、心率加快、肺不张等不良反应,严重影响预后[9]。因胸外科疼痛多由肋间神经传导,但肋间神经多发生变异,加之受其他因素导致的疼痛影响,单一镇痛方式难以达到理想的镇痛效果,这就需要采用区域组织联合全身给药的镇痛方式[10]。目前胸外科区域阻滞主要包括两种类型:一是直接组织手术切口周围的肋间神经,二是阻滞胸神经、背根神经节或其他神经传导通路。胸椎旁神经阻滞又分为盲探、CT 引导和超声引导,超声引导下可实时动态检测,进行精确的神经阻滞,此外还可以对血管、胸膜等成像,提高椎旁神经阻滞的安全性[11]。有研究表明,肋间神经阻滞联合PCIA 可有效缓解胸外科术后急性疼痛,其作用机制可能为肋间神经阻滞可直接阻断由脊神经根传导的疼痛信息,适当剂量的罗哌卡因可在短期维持一定的血药浓度,起维持镇痛作用,还不会造成因局麻药导致的不良事件[12-13]。
本研究就不同模式神经阻滞复合PCIA的镇痛效果进行分析比较,旨在将患者术后疼痛降到最低,促进患者术后快速康复,缩短住院时间。本研究结果显示,胸内直视下椎旁神经阻滞和超声引导下经皮椎旁神经阻滞的术后疼痛程度、免疫指标和应激指标均要明显优于肋间神经阻滞,表明胸内直视下椎旁神经阻滞和超声引导下经皮椎旁神经阻滞复合PCIA镇痛效果更为优越;胸内直视下椎旁神经阻滞和超声引导下经皮椎旁神经阻滞的术后镇痛效果无明显差异。椎旁神经阻滞应用历史悠久,阻滞区域小,术中循环系统稳定,对血流动力学影响较小[14]。胸内直视下椎旁神经阻滞由经验丰富的住院医师进行操作,且无须其他设备辅助进行,操作较为简单;而超声引导下经皮椎旁神经阻滞可减少术中麻醉药物的使用,从而可有效避免麻醉药物带来的副作用[15]。
综上所述,胸内直视下椎旁神经阻滞和超声引导下经皮椎旁神经阻滞复合PCIA 的镇痛效果均明显优于肋间神经阻滞复合PCIA,且对患者各免疫指标影响较小。而胸内直视下椎旁神经阻滞和超声引导下经皮椎旁神经阻滞复合PCIA 的镇痛效果无明显差异。

