刺五加提取物及其活性成分免疫调节作用的研究进展
梁子涵,王旖瑶,赖逸翔,张靖怡,宋银宏*
刺五加提取物及其活性成分免疫调节作用的研究进展
梁子涵1, 2, 3,王旖瑶1, 2, 3,赖逸翔1, 2, 3,张靖怡1, 2, 3,宋银宏1, 2, 3*
1. 肿瘤微环境与免疫治疗湖北省重点实验室(三峡大学),湖北 宜昌 443002 2. 三峡大学感染与炎症损伤研究所,湖北 宜昌 443002 3. 三峡大学医学院,湖北 宜昌 443002
免疫力下降及免疫失衡是临床多种疾病发生的根源,调节机体免疫力成为许多疾病的有效治疗方法。刺五加属于五加科五加属传统药用植物,在临床上常用于病后恢复、改善睡眠和增强机体免疫力等。刺五加提取物一般分为水提取物和醇提取物,其活性成分主要有刺五加多糖、萜类、木脂素类、黄酮类和香豆素类等。刺五加提取物及其活性成分可在增强机体免疫力的同时发挥抗炎作用,体现在刺激细胞因子产生、增强巨噬细胞吞噬功能以及调节多种炎性细胞因子水平等方面。主要对刺五加提取物及其活性成分的免疫作用进行综述,为刺五加临床免疫应用提供一定理论基础。
刺五加;免疫调节;刺五加多糖;紫丁香苷;金丝桃苷;槲皮素;芦丁;异嗪皮啶
免疫为机体的基本生理功能,可清除入侵机体的抗原物质并对体内衰老或突变的细胞进行识别和清除。而免疫力下降会导致机体免疫系统出现各种缺陷,从而导致机体单核细胞和巨噬细胞数量发生变化,并影响其吞噬能力和趋化反应,使机体更易被病原体侵袭,造成一系列临床症状[1]。目前临床常用免疫增强剂包括胸腺法新、乌苯美司、重组人白细胞介素-11、香菇多糖和胸腺五肽等[2]。上述药物虽能显著提升机体免疫力,但对机体肝功能、胃肠功能和肾功能有一定影响且不良反应较高[3]。因此临床急需不良反应较小、成本较低的新免疫增强剂来改善现状。
刺五加(Rupr. Et Maxim.) Harms,俗称坎拐棒子或西伯利亚人参,是1种小型灌木,属五加科,原产于中国、朝鲜、日本和俄罗斯[4-5]。刺五加根茎和叶具有特殊香气,其味微苦、稍辛,归脾、肾、心经,具有益气健脾、补肾安神的功效[6],尤其在抗疲劳、抗炎、抗应激和增强免疫力方面有显著作用,同时对心血管、糖尿病和神经衰弱等方面疾病有一定疗效[4-5]。因其具有极高药用价值,在东亚地区已有2000多年药用历史[4]。
目前已从刺五加的根、茎、叶、果实和种子等不同部位分离提取并鉴定出380余种有效成分,包括萜类(紫丁香苷等)、木脂素类(刺五加苷E等)、黄酮类(金丝桃苷、槲皮素等)、多糖类和香豆素类(异嗪皮啶等)[7-8]。同时研究表明刺五加提取物也具有一定的生物活性[9]。基于此,本文对刺五加的提取物和活性成分的免疫调节作用进行综述,为刺五加的临床免疫应用提供参考。
1 刺五加提取物的免疫调节作用
刺五加提取物一般分为水提取物和醇提取物,二者皆有一定免疫调节作用。王瑞强等[10]进行小鼠抗炎和诱导迟发型超敏反应实验显示,刺五加水提取物在低于免疫增强作用剂量下即能产生良好的抗急性炎症作用,并能增加小鼠网状内皮系统吞噬指数,促进二硝基氟苯诱导的小鼠迟发型超敏反应,并且显著增加了小鼠的脾脏和胸腺的脏器系数。Kim等[11]通过小鼠强制游泳实验发现,刺五加根的水提取物可增加小鼠游泳时间并恢复脾脏和胸腺质量,同时可提高脾细胞的数量和免疫相关细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和γ干扰素(interferon-γ,IFN-γ)的水平,但对白细胞介素-2(interleukin-2,IL-2)无明显影响。Zhang等[12]研究发现,在正常小鼠饮食中添加刺五加根碾碎干燥后的粉末,小鼠血清中分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)和IFN-γ的含量增加并与添加量呈正比。Jin等[13]通过体外实验发现,刺五加根和树皮的乙醇提取物可增强人巨噬细胞对大肠杆菌的吞噬能力,证明其可促进人巨噬细胞向抗炎表型M2a及M2b极化,这可能是其免疫调节活性的基础,并可能促进伤口愈合。Smalinskiene等[14]发现,在长期暴露于镉的小鼠饮食中添加刺五加根乙醇提取物,小鼠脾脏中镉水平显著降低,同时增加了脾脏中巨噬细胞和T、B淋巴细胞的数量。以上研究均证实了刺五加提取物有免疫调节作用,其中促进巨噬细胞活化以及相关免疫因子的分泌增多可能起到了关键作用,具体表现为抗急性炎症、抗菌能力增强、脾脏和胸腺脏器系数增加等。
2 刺五加多糖的免疫调节作用
刺五加多糖(polysaccharide,ASPS)是从刺五加根及根茎中提取的植物多糖,由葡萄糖、果糖、木糖、阿拉伯糖等成分组成,分为水溶性多糖和碱溶性多糖两大类,具有免疫调节、抗肿瘤、抗氧化、抗辐射、降低血糖及抗疲劳等功效[15]。
ASPS具有较强的免疫活性,Li等[16]研究发现,在环磷酰胺诱导的免疫抑制小鼠模型中,刺五加多糖纳米乳具有刺激脾细胞增殖和增强免疫功能的作用;同时其纳米乳可以诱导多种细胞因子(TNF-α、IFN-γ、IL-2和IL-6)的表达,并可激活p65、c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)和核因子-κB抑制蛋白激酶α(inhibitor of nuclear factor-κB kinase α,IKKα),调节辅助性T细胞1(T helper cell 1,Th1)/Th2型细胞因子的表达,提示刺五加多糖纳米乳在药物传输和诱导有效持续的免疫反应中有巨大潜能。翟旭楠等[17]通过碳粒廓清实验和溶血素抗体实验证明,ASPS可明显增强小鼠巨噬细胞的吞噬功能,并能促进绵羊红细胞产生溶血素,增强小鼠的体液免疫作用。在抗肿瘤方面,周丽菁等[18]发现,Lewis荷瘤小鼠经ASPS ig处理后,其胸腺指数、脾脏指数及外周血中TNF-α、IL-1β和IL-6的分泌量显著升高,其机制可能与ASPS促进Toll样受体4(Toll-like receptor 4,TLR4)信号通路关键节点基因的表达有关。Meng等[19]研究发现,ASPS对小鼠Crocker肉瘤S180、肝癌H22和宫颈癌U14移植瘤有抑制作用,其机制可能与调节血清IL-2、IL-12和INF-γ水平有关。在抗感染方面,Han等[20]研究表明,内毒素血症模型小鼠口服ASPS可能通过激活核因子-κB(nuclear factor-κB,NF-κB)/肌球蛋白轻链激酶(myosin light chain kinase,MLCK)信号通路,减轻内毒素对小鼠肠上皮细胞紧密连接及其相关蛋白的破坏,从而降低模型小鼠革兰阴性菌感染的易感性。然而ig给予ASPS在卡拉胶致小鼠足趾肿胀、棉球致小鼠肉芽肿和醋酸致小鼠腹腔毛细血管通透性增加等炎症模型中,通过ig给予ASPS,发现调节血清IL-6、TNF-α及IL-1β的水平可改善炎症状况[21-22]。张娜等[23]研究还发现ASPS可以升高超氧化物歧化酶(superoxide dismutase,SOD)和还原性谷胱甘肽(reduced glutathione,GSH-Px)活性、降低丙二醛(malondialdehyde,MDA)水平、抑制NF-κB表达,从而下调与IκB-α位点结合有关的炎性因子TNF-α、IL-1β和NO的分泌,抑制细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)的表达和转录,从而减轻刀豆蛋白A(concanavalin A,ConA)引起的肝损伤。病理检查显示ASPS可减轻ConA所致肝脏形态学改变,减轻炎性细胞浸润和核固缩浓染,提示ASPS对免疫性肝损伤有保护作用[23]。高鹏等[24]也报道,ASPS可能通过抑制TLR4/髓样分化因子(myeloid differentiation factor 88,MyD88)信号通路,发挥保护自身免疫性肝炎(autoimmune hepatitis,AIH)小鼠肝功能、减轻炎症反应和调节Th22细胞比例的作用,且呈剂量相关性。这些报道和上述ASPS作用有所不同,可能是制作动物模型及ASPS给药程序及剂量有所差异造成的。综上所述,ASPS药理作用广泛且毒性低,作用机制复杂(图1),有较好临床应用价值,其增强机体免疫力的具体机制仍有待进一步完善。

图1 刺五加多糖的主要免疫作用机制
3 刺五加小分子类成分的免疫调节作用
3.1 萜类
紫丁香苷又名刺五加苷B,属萜类化合物,广泛存在于刺五加叶中[8],为《中国药典》2020年版中规定刺五加的指标成分。根据规定,干燥刺五加样品中紫丁香苷质量分数应不低于0.05%[6,8]。
研究表明,除去补体成分C3并与紫丁香苷混合的豚鼠血清与纯化的C3蛋白共孵育实验显示,紫丁香苷可通过抑制补体的经典活化途径的C3转化酶,抑制豚鼠血清抗体包被的绵羊红细胞体外免疫溶血,并呈剂量相关性。同时紫丁香苷还可使血清中的IgG含量显著增加,并活化巨噬细胞,进一步发挥免疫调节作用[25]。Dai等[26]建立的鸡卵清蛋白(ovalbumin,OVA)诱导的小鼠哮喘模型显示,紫丁香苷可剂量相关性地降低Th2趋化因子和细胞因子(IL-4、IL-5、IL-13和IFN-γ)含量,抑制Th2介导的气道炎症反应,降低嗜酸性粒细胞、巨噬细胞、淋巴细胞和中性粒细胞数量,同时降低NO的水平并通过调控诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)的表达,最终抑制哮喘的发生,提示紫丁香苷或具有抗炎作用。紫丁香苷还可以降低过氧化产物MDA和髓过氧化物酶(myeloperoxidase,MPO),阻止炎症组织进一步损伤[26]。紫丁香苷可剂量相关性地抑制由脂多糖(lipopolysaccharide,LPS)刺激的小鼠巨噬细胞RAW264.7的增殖、TNF-α的产生和小鼠T细胞CTLL-2的增殖,发挥抗过敏作用。但高浓度紫丁香苷对NO和CD4 T细胞增殖均无抑制作用[27]。近期Zhang等[28]发现紫丁香苷可通过抑制葡聚糖硫酸钠(dextran sulfate sodium,DSS)或LPS诱导的IL-1β、IL-6、TNF-α和环氧化酶-2(cyclooxygenase-2,COX-2)的过度产生而发挥抗炎作用,并可通过降低IκBα Ser 32位点磷酸化抑制NF-κB p65通路,促进抗氧化核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号通路的激活,对肠道炎症发挥保护作用。另外,Zang等[29]证实紫丁香苷可降低顺铂诱导的人肾小管上皮细胞HK-2的肾损伤分子-1(kidney injury molecular-1,KIM-1)、TNF-α、IL-6、单核细胞趋化蛋白-1(monocyte chemotactic protein,MCP-1)水平和程序性坏死相关蛋白的表达,减轻炎症并抑制细胞凋亡和程序性坏死,这可能与紫丁香苷下调人胰岛素样生长因子结合蛋白-7(insulin-like growth factor-binding protein 7,IGFBP-7)的表达、激活胰岛素样生长因子(insulin-like growth factor,IGF)通路有关。紫丁香苷还能降低急性肾损伤小鼠模型中肌酐和尿素氮水平,减轻顺铂所致的肾脏损伤[29]。
这些研究表明,紫丁香苷具有免疫调节和抗炎作用,其机制主要与激活细胞因子,下调NF-κB信号通路,上调Nrf2和IGF信号通路有关(图2),表明紫丁香苷在治疗炎症相关疾病和增强巨噬细胞吞噬功能方面具有极大潜力。

图2 紫丁香苷的主要免疫作用机制
3.2 木脂素类
刺五加苷E是从刺五加中提取得到的一类木脂素单体,主要存在于刺五加的果实中[8]。刺五加苷E可降低胶原诱导的关节炎模型小鼠的炎细胞浸润、血管翳形成、软骨损伤和骨侵蚀,这可能与刺五加苷E体内外降低TNF-α水平,改善小鼠关节炎相关指标如关节肿胀、压痛、急性期反应、红细胞沉降率和C反应蛋白水平有关[30]。同时,Zhao等[31]最新研究发现,刺五加苷E可提高抗炎细胞因子转化生长因子-β(transforming growth factor-β,TGF-β)和IL-10水平,降低TNF-α水平,降低肠上皮紧密连接的通透性,从而改善猪小肠上皮细胞IPEC-J2的机械屏障功能并产生保护作用,显著改善肠道炎症。Kimura等[32]研究发现,刺五加苷E还可以恢复游泳应激引起的自然杀伤(natural killer,NK)细胞活性降低,并升高皮质酮水平。
刺五加苷E具有显著的抗炎作用并恢复游泳应激小鼠NK细胞活性,这主要与刺五加苷E降低TNF-α水平、升高抗炎细胞因子水平有关(图3)。提示刺五加苷E可能在骨关节炎和肠道炎症等方面有一定作用。
3.3 黄酮类
3.3.1 金丝桃苷 金丝桃苷化学名为槲皮素-3--β-吡喃半乳糖苷,是从刺五加叶分离出来的第1个黄酮类化合物,属于黄酮醇类。刺五加各部位均含有黄酮类化合物,叶中含量最高,在刺五加叶中金丝桃苷的平均质量分数为0.037 6%[33-34]。金丝桃苷具有抑癌、抗氧化、抗抑郁、保护心/脑缺血、保肝和免疫调节等作用[35]。
金丝桃苷可促进机体非特异性免疫功能。在体外实验中发现,金丝桃苷可通过显著增加T淋巴细胞的增殖能力,从而增强机体的特异性免疫功能[36]。此外,研究发现小剂量金丝桃苷增强体液免疫作用效果最佳[36]。胡小艳等[37]研究发现金丝桃苷还能提高免疫抑制小鼠体内各项免疫指标,如胸腺指数、脾脏指数等,以上结果提示金丝桃苷具有免疫增强作用。金丝桃苷可降低免疫抑制小鼠体内过氧化物MDA、H2O2水平,提高过氧化物酶、总超氧化物歧化酶(Total Superoxide Dismutase,T-SOD)活性及总抗氧化力,从而发挥清除机体过氧化物的作用;金丝桃苷还可通过降低黄嘌呤氧化酶活性,减少过氧化物的产生,提高小鼠抗氧化能力,达到免疫增强作用。金丝桃苷对非小细胞肺癌(non-small cell lung cancer,NSCLC)具有一定作用,金丝桃苷在促进T细胞对H1975细胞的杀伤作用的同时,可降低NSCLC细胞中c-Myc(cellular-myelocytomatosis viral oncogene)的蛋白表达量,在转录水平抑制程序性死亡-配体1(programmed cell death-ligand 1,PD-L1)的表达,显示出抗非小细胞肺癌的作用[38]。上述结果提示,金丝桃苷在肿瘤免疫治疗中可发挥一定作用,并对机体起免疫调节作用(图4)。

图3 刺五加苷E的主要免疫作用机制
3.3.2 槲皮素 槲皮素为黄酮类化合物,广泛存在于刺五加的果实和叶中[8]。槲皮素是天然的抗氧化剂,可调节许多细胞内和细胞外信号通路,并发挥抗炎、抗病毒、抗癌和防治心脑血管疾病的作用[39]。
在对系统性红斑狼疮(systemic lupus erythematosus,SLE)模型小鼠的研究中,槲皮素可提高SLE小鼠脾脏树突状细胞和Th1细胞比例,减少Th2细胞比例,从而增强SLE小鼠细胞免疫功能[40]。还有研究报道,槲皮素可有效改善因环磷酰胺造成的小鼠免疫低下状态[41]。对槲皮素的抗炎免疫机制进一步研究发现,槲皮素是COX-2的选择性抑制剂,能抑制T、B细胞的增殖,并且抑制T细胞分泌TNF-α、IL-6、INF-γ[42]。此外,Veith等[43]也发现,槲皮素可抑制NOS、COX-2和C反应蛋白的表达,从而发挥抗炎作用。Zhang等[44]报道,槲皮素能够抑制NF-κB通路和核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3(nucleotide binding oligomerization domain-like receptor family pyrin domain protein 3,NLRP3)炎性小体的激活,缓解大鼠下丘脑炎症,从而改善大鼠下丘脑的胰岛素信号传导缺陷,同时可减少炎症因子IL-6、TNF-α和纤溶酶原激活物抑制因子(plasminogen activator inhibitor-1,PAI-1)的表达,降低肾组织的炎症反应,发挥抗纤维化功能,对肾组织起到保护作用。因此,槲皮素作用广泛,对机体免疫起到显著的调节作用(图4),也为非小细胞肺癌、卵巢癌和宫颈癌等疾病的临床免疫治疗提供了新的方向。
3.3.3 芦丁 芦丁主要分布在刺五加的叶和根茎中[8],是刺五加中含量最丰富的黄酮类化合物之一,有文献报道,在伊春带岭区产出的刺五加叶中芦丁的质量分数可达4.6%[45]。
已有研究证明芦丁可以通过细胞免疫和体液免疫2方面机制增强机体的免疫力。在环磷酰胺处理的大鼠中,芦丁可显著增加大鼠血凝试验抗体滴度,升高免疫球蛋白水平并增强迟发型超敏反应。芦丁还可恢复环磷酰胺处理后的大鼠的白细胞数量,并增强巨噬细胞的吞噬指数[46]。此研究表明,芦丁具有免疫调节的潜力。Nafees等[47]研究报道,环磷酰胺处理后的大鼠在芦丁的作用下,可改善环磷酰胺所导致的肝毒性,并观察到TNF-α、IL-6水平下调,以及肝脏中p38酪氨酸激酶(mitogen-activated protein kinase,MAPK)、NF-κB、iNOS和COX-2的表达降低。这说明芦丁对环磷酰胺诱导的大鼠肝脏具有保护作用。最近又有研究报道,芦丁能够通过介导TLR4-MyD88-肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)-NF-κB炎症信号通路,调节细胞因子和炎症介质,发挥抗炎作用[48]。上述研究提示,芦丁可改善机体免疫低下的状态,并通过调节细胞因子分泌和保护免疫器官,发挥对小鼠免疫功能的调节作用(图4)。

图4 黄酮类单体的主要免疫作用机制
3.4 香豆素类
异嗪皮啶是一种羟基香豆素类单体物质,广泛存在于刺五加的根茎、叶和果实中,具有多种生理和药理活性[8,49]。异嗪皮啶具有抗肝癌、抑制人结直肠癌细胞增殖、治疗神经退行性疾病的作用,并对高脂饮食诱导的脂代谢紊乱和非酒精性脂肪肝起保护作用[49-50]。
在免疫作用方面,异嗪皮啶主要发挥抗炎作用。Niu等[51]通过二甲苯和卡拉胶诱导的小鼠耳水肿和足肿胀模型显示,异嗪皮啶主要通过抑制小鼠腹腔巨噬细胞和血清中TNF-α水平,降低小鼠腹腔巨噬细胞中磷酸化p38和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2蛋白的表达,调节MAPK信号通路以抑制炎症。而后续研究表明,异嗪皮啶能降低血清中的炎症介质和细胞因子,包括NO、iNOS、COX-2、前列腺素E2(prostaglandin E2,PGE2)、TNF-α和IL-6水平,可减轻IL-1β诱导的神经细胞前体炎症并对LPS诱导的急性肺损伤具有保护作用[52]。此外,异嗪皮啶还能抑制IL-1β对基质金属蛋白酶-3(matrix metalloproteinases-3,MMP-3)和MMP-13的诱导作用,同时抑制血小板反应蛋白解整合素金属肽酶-4(a disintegrin and metalloproteinase with thrombospondin- 4,ADAMTS-4)和ADAMTS-5的表达,增加蛋白聚糖和II型胶原的聚集水平;又能显著抑制IL-1β诱导的IκB-α降解和NF-κB活化,调节NF-κB信号通路,抑制骨关节炎(osteoarthropathy,OA)的发展[52-53]。免疫共沉淀研究还发现,异嗪皮啶可竞争性结合髓样分化蛋白-2(myeloid differential protein-2,MD-2),显著减弱TLR4和MD-2之间的相互作用,抑制MyD88、IL-1受体相关激酶-1(interleukin-1 receptor associated kinase 1,IRAK-1)和TRAF-6的表达,抑制Toll信号通路和NF-κB的激活,促进细胞增殖,提示异嗪皮啶可能是OA的潜在治疗药物[54]。Chen等[55]的最新研究还表明,异嗪皮啶可作为NLRP3炎性小体抑制剂减轻心肌梗死程度并对糖氧剥夺损伤的心肌产生保护作用。
综上所述,异嗪皮啶具有一定的抗炎作用,其机制主要与降低炎症介质和细胞因子含量、调节MAPK信号通路和NF-κB信号通路、抑制Toll信号通路有关(图5)。上述研究表明异嗪皮啶可能是治疗炎症相关疾病如神经前体细胞炎症、骨关节炎和急性肺损伤等的潜在药物。
4 结语与展望
临床导致免疫低下的情况呈现多样化趋势,其中术后免疫力低下导致多种并发症的发生较为常见,且预后极差甚至导致患者死亡。随着化学药的耐药性以及副作用问题的频发,刺五加作为一味传统中药再次受到关注。《本草纲目》记载刺五加具有“补中益气,坚筋骨,强意志,久服轻身耐老”的功效。基于此记载,临床上常将刺五加用于病后恢复、改善睡眠和刺激机体免疫力,并能一定程度上治疗两脚疼痹风弱、水肿和心律失常。
刺五加提取物及有效成分的体内外实验均证明刺五加具有一定的免疫调节作用,并可通过多种途径发挥作用(表1)。刺五加多靶点的药理活性有望使其成为临床增强免疫力的潜在药物,但目前对于刺五加提取物及有效成分免疫作用的研究大部分处于基础性研究阶段,缺乏相应的临床实验数据,因此,仍需对其作用机制进行深入研究以及有效解决临床新药的开发利用。同时刺五加的种类繁多,各部位成分的组成和含量各不相同,如何进行标准化配比也成为一个亟待解决的问题。综上所述,刺五加免疫作用的开发虽具有良好的应用前景,可为未来的免疫疗法提供更多的选择,但仍有许多问题需要解决。
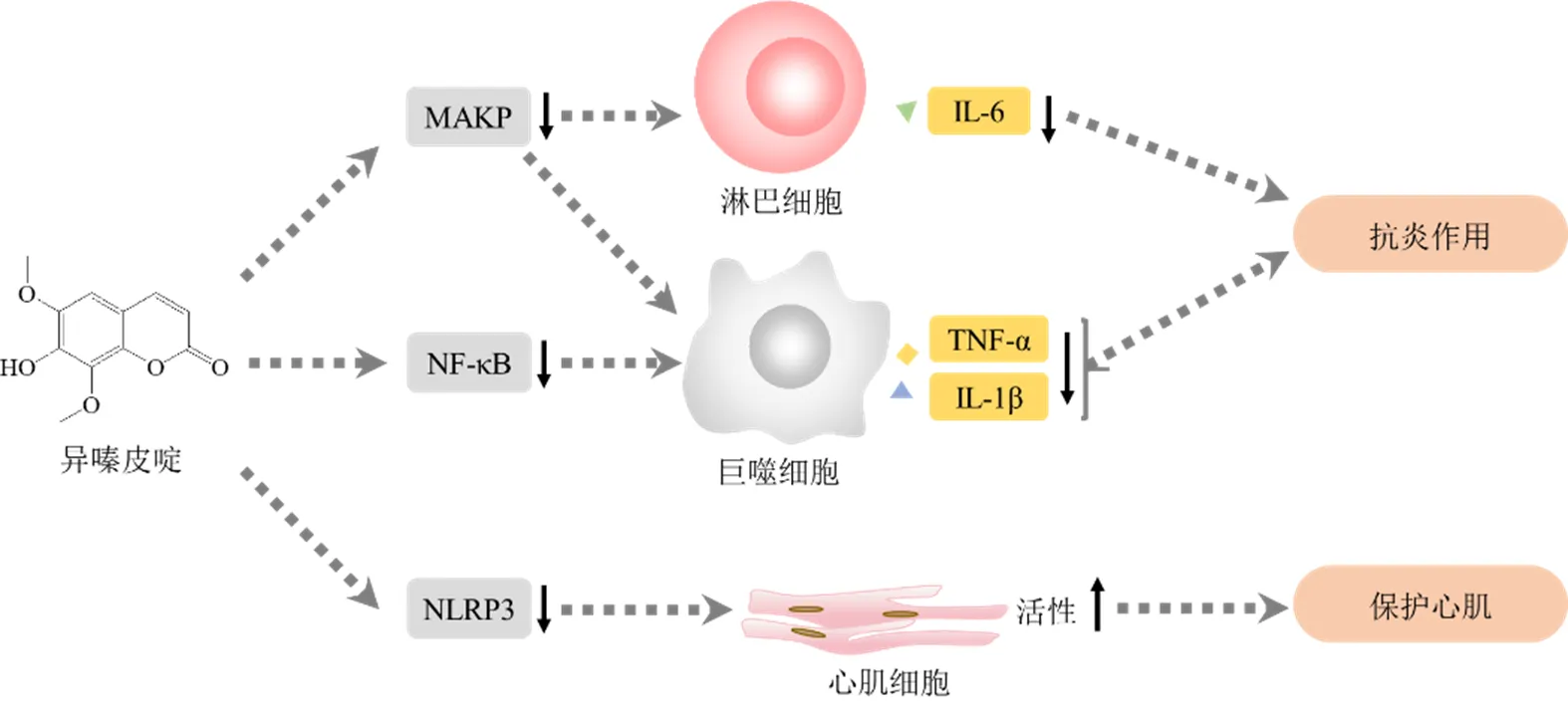
图5 异嗪皮啶的免疫作用机制
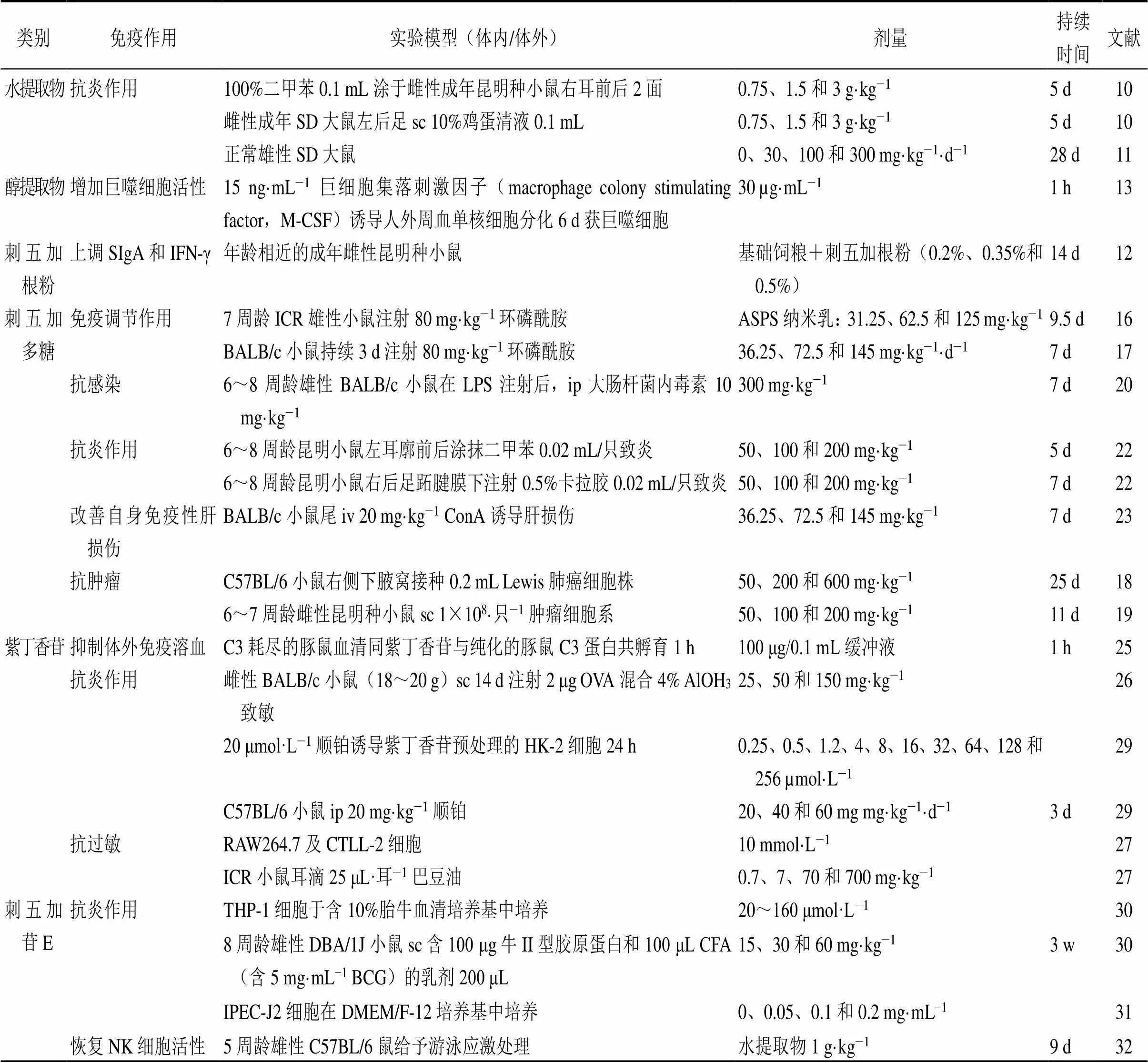
表1 刺五加提取物及其活性成分在不同实验模型中的免疫作用

续表1
利益冲突 所有作者均声明不存在利益冲突
[1] Tuchendler E, Tuchendler P K, Madej G. Immunodeficiency caused by cirrhosis [J]., 2018, 4(3): 158-164.
[2] 孙娇, 辛文秀, 孔思思, 等. 2013—2017年杭州市12家医院肺癌患者免疫增强药物应用分析 [J]. 药物流行病学杂志, 2019, 28(7): 460-463.
[3] 李洪亮. 免疫增强剂胸腺五肽联合常规抗结核药物治疗耐药性结核病患者的疗效 [J]. 中国医药指南, 2020, 18(29): 71-72.
[4] Li T, Ferns K, Yan Z Q,.: Photochemistry and anticancer potential [J]., 2016, 44(8): 1543-1558.
[5] Wang Y H, Meng Y H, Zhai C M,. The chemical characterization ofand ci-wu-Jia tea using UHPLC-UV-QTOF/MS [J]., 2019, 20(3): 475.
[6] 中国药典 [S]. 一部. 2020: 215.
[7] 张宇航, 邱智东, 傅超美, 等. 刺五加化学成分药动学特性及其体内代谢过程研究进展 [J]. 食品工业科技, 2020, 41(16): 334-339.
[8] 韩明虎, 胡浩斌, 芦娅妮, 等. 五加属植物化学成分的研究进展 [J]. 中药材, 2019, 42(11): 2720-2729.
[9] Liu S P, An J T, Wang R,. Simultaneous quantification of five bioactive components ofand its extract by ultra performance liquid chromatography with electrospray ionization time-of-flight mass spectrometry [J]., 2012, 17(7): 7903-7913.
[10] 王瑞强, 常晓强, 温占勇. 刺五加水提物的抗急性炎症及免疫增强作用 [J]. 天津中医药, 2013, 30(2): 109-111.
[11] Kim J H, Shin E H, Lee H Y,. Immunostimulating effects of extract of[J]., 2013, 62(3): 247-253.
[12] Zhang Y Q, Zhang Y L, Liu Z K. Effects ofsupplementation on innate immunity and changes of related immune factors in healthy mice [J]., 2021, 27(6): 461-469.
[13] Jin L, Schmiech M, El Gaafary M,. A comparative study on root and bark extracts ofand their effects on human macrophages [J]., 2020, 68: 153181.
[14] Smalinskiene A, Savickiene N, Zitkevicius V,. Effect ofon the accumulation of cadmium and on the immune response of spleen cells [J]., 2014, 77(21): 1311-1318.
[15] 刘树民, 张娜. 刺五加多糖的现代研究进展 [J]. 中医药信息, 2014, 31(2): 116-119.
[16] Li X H, Zhang Z Q, Guo Z H,. Macrophage immunomodulatory activity ofpolysaccharide nanoemulsion via activation of P65/JNK/ikkαsignaling pathway and regulation of Th1/Th2 Cytokines [J]., 2021, 9: e12575.
[17] 翟旭楠, 刘永武, 张娜, 等. 刺五加多糖对小鼠免疫功能的影响 [J]. 中医药信息, 2020, 37(6): 42-45.
[18] 周丽菁, 龙婷婷, 周星, 等. 刺五加多糖对Lewis荷瘤小鼠抗肿瘤免疫调节作用及机制的研究 [J]. 中国免疫学杂志, 2017, 33(6): 849-853, 858.
[19] Meng Q L, Pan J Z, Liu Y J,. Anti-tumour effects of polysaccharide extracted fromand cell-mediated immunity [J]., 2018, 15(2): 1694-1701.
[20] Han J, Li J H, Bai G,.polysaccharides-induced intestinal tight junction injury alleviation via inhibition of NF-κB/MLCK pathway in a mouse endotoxemia model [J]., 2017, 23(12): 2175-2184.
[21] 潘景芝, 金莎, 刘雅婧, 等. 刺五加多糖镇痛抗炎作用及其免疫调节机制的研究 [J]. 上海中医药杂志, 2019, 53(10): 74-82.
[22] 孟庆龙, 刘雅婧, 崔文玉, 等. 刺五加多糖抗炎作用的研究 [J]. 时珍国医国药, 2019, 30(11): 2621-2624.
[23] 张娜, 赵良友, 毛迪, 等. 刺五加多糖调控炎性因子对小鼠免疫性肝损伤的保护作用 [J]. 中国中药杂志, 2019, 44(14): 2947-2952.
[24] 高鹏, 周凤蕊, 刘俊华, 等. 刺五加多糖对自身免疫性肝炎小鼠肝损伤的改善作用及机制研究 [J]. 浙江中医药大学学报, 2021, 45(7): 705-712.
[25] Kapil A, Sharma S. Immunopotentiating compounds from[J]., 1997, 58(2): 89-95.
[26] Dai R, Niu M M, Wang N L,. Syringin alleviates ovalbumin-induced lung inflammation in BALB/c mice asthma model via NF-κB signaling pathway [J]., 2021, 36(3): 433-444.
[27] Cho J Y, Nam K H, Kim A R,.andimmunomodulatory effects of syringin [J]., 2001, 53(9): 1287-1294.
[28] Zhang H H, Gu H J, Jia Q H,. Syringin protects against colitis by ameliorating inflammation [J]., 2020, 680: 108242.
[29] Zang H M, Yang Q, Li J. Eleutheroside B protects against acute kidney injury by activating IGF pathway [J]., 2019, 24(21): 3876.
[30] He C Y, Chen X H, Zhao C Y,. Eleutheroside E ameliorates arthritis severity in collagen-induced arthritis mice model by suppressing inflammatory cytokine release [J]., 2014, 37(5): 1533-1543.
[31] Zhao B, Fan Y L, Li H J,. Mitigative effects of eleutheroside E against the mechanical barrier dysfunction induced by soybean agglutinin in IPEC-J2 cell line [J].(), 2022, 106(3): 664-670.
[32] Kimura Y, Sumiyoshi M. Effects of variouscortex on swimming time, natural killer activity and corticosterone level in forced swimming stressed mice [J]., 2004, 95(2/3): 447-453.
[33] 陈宏昌, 魏文峰, 王伟明. 刺五加叶中金丝桃苷的薄层鉴别和含量测定 [J]. 黑龙江医药, 2015, 28(4): 703-705.
[34] 吕洪飞, 初庆刚, 胡正海. 金丝桃属植物的化学成分研究进展 [J]. 中草药, 2002, 33(12): 1135-1138.
[35] 李敏芳, 李慧, 王学美. 金丝桃苷药理作用研究进展 [J]. 中国中医药信息杂志, 2008, 15(4): 102-104.
[36] 黄凯, 杨新波, 黄正明, 等. 金丝桃苷对正常小鼠免疫功能的影响 [J]. 解放军药学学报, 2009, 25(2): 133-135.
[37] 胡小艳, 李博文. 金丝桃苷对免疫抑制小鼠抗氧化能力和免疫功能的影响 [J]. 安徽农业科学, 2015, 43(34): 170-172.
[38] 董靖雯, 况泽安, 殷明晓, 等. 金丝桃苷通过下调PD-L1表达发挥抗非小细胞肺癌作用研究 [J]. 药学学报, 2021, 56(10): 2817-2824.
[39] 刘晟文, 刘建英. 槲皮素药理学作用的研究进展 [J]. 中华肺部疾病杂志: 电子版, 2020, 13(1): 104-106.
[40] Lugli E, Ferraresi R, Roat E,. Quercetin inhibits lymphocyte activation and proliferation without inducing apoptosis in peripheral mononuclear cells [J]., 2009, 33(1): 140-150.
[41] 田瑞雪, 孙耀宗, 姚有昊, 等. 槲皮素对免疫低下小鼠免疫功能的影响 [J]. 中国现代医药杂志, 2019, 21(9): 13-16.
[42] 司丽君, 王雪, 王林林, 等. 槲皮素的抗炎免疫及部分机制研究 [J]. 中国医药导报, 2021, 18(27): 26-29.
[43] Veith C, Drent M, Bast A,. The disturbed redox-balance in pulmonary fibrosis is modulated by the plant flavonoid quercetin [J]., 2017, 336: 40-48.
[44] Zhang Q Y, Pan Y, Wang R,. Quercetin inhibits AMPK/TXNIP activation and reduces inflammatory lesions to improve insulin signaling defect in the hypothalamus of high fructose-fed rats [J]., 2014, 25(4): 420-428.
[45] 吴高松, 匡海学, 王知斌, 等. RP-HPLC法同时测定刺五加叶中芦丁、金丝桃苷和槲皮素的含量 [J]. 化学工程师, 2017, 31(2): 32-34.
[46] Ganeshpurkar A, Saluja A K. Protective effect of rutin on humoral and cell mediated immunity in rat model [J]., 2017, 273: 154-159.
[47] Nafees S, Rashid S, Ali N,. Rutin ameliorates cyclophosphamide induced oxidative stress and inflammation in Wistar rats: Role of NFκB/MAPK pathway [J]., 2015, 231: 98-107.
[48] 杨杰. 芦丁的体外抗炎作用及机制研究 [D]. 沈阳: 沈阳农业大学, 2019.
[49] Majnooni M B, Fakhri S, Shokoohinia Y,. Isofraxidin: synthesis, biosynthesis, isolation, pharmacokinetic and pharmacological properties [J]., 2020, 25(9): 2040.
[50] Li J, Li X F, Li Z K,. Isofraxidin, a coumarin component improves high-fat diet induced hepatic lipid homeostasis disorder and macrophage inflammation in mice [J]., 2017, 8(8): 2886-2896.
[51] Niu X F, Xing W, Li W F,. Isofraxidin exhibited anti-inflammatory effectsand inhibited TNF-α production in LPS-induced mouse peritoneal macrophagesvia the MAPK pathway [J]., 2012, 14(2): 164-171.
[52] Su X Q, Liu B, Gong F T,. Isofraxidin attenuates IL-1β-induced inflammatory response in human nucleus pulposus cells [J]., 2019, 120(8): 13302-13309.
[53] Lin J, Li X B, Qi W H,. Isofraxidin inhibits interleukin-1β induced inflammatory response in human osteoarthritis chondrocytes [J]., 2018, 64: 238-245.
[54] Jin J L, Yu X F, Hu Z C,. Isofraxidin targets the TLR4/MD-2 axis to prevent osteoarthritis development [J]., 2018, 9(11): 5641-5652.
[55] Chen G, Song X, Lin D,. Isofraxidin alleviates myocardial infarction through NLRP3 inflammasome inhibition [J]., 2020, 43(2): 712-721.
Research progress on immunomodulatory effects of extracts and active ingredients of
LIANG Zi-han1, 2, 3, WANG Yi-yao1, 2, 3, LAI Yi-xiang1, 2, 3, ZHANG Jing-yi1, 2, 3, SONG Yin-hong1, 2, 3
1. Hubei Key Laboratory of Tumor Microenvironment and Immunotherapy, China Three Gorges University, Yichang 443002, China 2. Institute of Infection and Inflammation, China Three Gorges University, Yichang 443002, China 3. Medical College, China Three Gorges University, Yichang 443002, China
Decreased immune and immune imbalance are the root causes of many clinical diseases, and regulation of body immunity has become an effective treatment for many diseases. Ciwujia () is a traditional medicinal plant belonging to the genusin Araliaceae, and is commonly used in clinical practice to recover from illness, improve sleep and enhance body’s immunity. The extractsofdivided into aqueous and ethanol extracts. Its active ingredients mainly include polysaccharides, terpenoids, lignans, flavonoids and coumarins, etc. The extracts and active ingredients ofcan exert anti-inflammatory effects while enhancing the immunity of the body, which are reflected in stimulating the production of cytokines, enhancing the phagocytic function of macrophages and regulating the levels of various of inflammatory cytokines. A review of the immunological effects of the extracts and active ingredients fromwas mainly conducted to provide a theoretical basis for the immunological application ofin clinic.
(Rupr. et Maxim.) Harms; immunomodulatory;polysaccharide; syringin; hyperin; quercetin; rutin; isofraxidin
R285
A
0253 - 2670(2022)15 - 4895 - 10
10.7501/j.issn.0253-2670.2022.15.033
2022-03-11
国家自然科学基金面上项目(81671397);湖北省卫健委重点项目(WJ2019H528)
梁子涵(2001—),女,临床医学本科生。E-mail: wcgwzx@163.com
通信作者:宋银宏(1972—),教授,主要从事免疫系统的发育与感染免疫研究。Tel: (0717)6397348 E-mail: syh728@126.com
[责任编辑 潘明佳]