基于药效团模型的龙血竭潜在降糖活性成分筛选
莫钧茹,覃 淼#,朱素梅,黄金梅,奉建芳, 2,黎 芳, 3*,梁健钦, 2, 3*
基于药效团模型的龙血竭潜在降糖活性成分筛选
莫钧茹1,覃 淼1#,朱素梅1,黄金梅1,奉建芳1, 2,黎 芳1, 3*,梁健钦1, 2, 3*
1. 广西中医药大学,广西 南宁 530200 2. 广西优势中成药与民族药开发工程技术研究中心,广西 南宁 530023 3. 广西中药制剂共性技术研发重点实验室,广西 南宁 530200
基于药效团模型筛选龙血竭潜在降糖活性成分。采用葡萄糖氧化酶法测定龙血竭含药血清对HepG2细胞胰岛素抵抗模型的葡萄糖消耗量。通过液相色谱-质谱联用技术(liquid chromatography-mass spectrometry,LC-MS)鉴定和检索中国知网(CNKI)、Web of Science数据库建立龙血竭的化合物库,通过Discovery Studio的吸收、分布、代谢、排泄、毒性(absorption,distribution,metabolism,excretion,toxicity,ADMET)模块预过滤化合物,通过钠-葡萄糖协同转运蛋白2(sodium-glucose cotransporter 2,SGLT2)、二肽基肽酶4(dipeptidyl peptidase 4,DPP4)药效团模型和分子对接筛选候选有效成分,通过细胞实验验证候选有效成分的降糖活性。与模型组比较,龙血竭含药血清能使胰岛素抵抗的HepG2细胞葡萄糖消耗量显著增加(<0.05)。经ADMET模块筛选到179个化合物,经最优药效团模型SGLT2-02、DPP4-03从中筛选出SGLT2、DPP4潜在抑制剂14个,其中5'-甲氧基松脂素(medioresinol)、开环异落叶松树脂酚[(+)-secoisolariciresinol]、1-palmitoylglycerophosphocholine、-茶氨酸(-theanine)的结合能均优于对照配体,分别为−852.285、−798.060、−916.116、−667.356 kJ/mol。与模型组相比,开环异落叶松树脂酚、-茶氨酸能显著提高HepG2细胞葡萄糖消耗量(<0.05、0.01)。体外实验证实龙血竭显示良好的降糖活性,龙血竭中的5'-甲氧基松脂素、开环异落叶松树脂酚是SGLT2的潜在抑制剂,1-palmitoylglycerophosphocholine、-茶氨酸是DPP4的潜在抑制剂,开环异落叶松树脂酚、-茶氨酸具有降糖活性。
龙血竭;降糖;ADMET;药效团;分子对接;钠-葡萄糖协同转运蛋白2;二肽基肽酶4;开环异落叶松树脂酚;-茶氨酸
龙血竭(Chinese dragon’s blood)是从百合科剑叶龙血树(Lour.) S. C. Chen的含脂木材经提取得到的树脂,具有活血散瘀、定痛止血、敛疮生肌的功效[1]。研究表明,龙血竭提取物能够降低四氧嘧啶[2]、链尿佐菌素[3]诱导的糖尿病小鼠血糖水平,但是,龙血竭的降糖活性成分及作用机制尚未清楚。本研究通过体外的胰岛素抵抗细胞模型评价龙血竭含药血清对HepG2细胞胰岛素抵抗的作用,通过液相色谱-质谱联用技术(liquid chromatography-mass spectrometry,LC-MS)检测,结合文献筛选龙血竭化学成分,通过吸收、分布、代谢、排泄、毒性(absorption,distribution,metabolism,excretion,toxicity,ADMET)性质对化合物进行初筛,基于分子共同特征的药效团模型和分子对接筛选钠-葡萄糖协同转运蛋白2(sodium-glucose cotransporter 2,SGLT2)、二肽基肽酶4(dipeptidyl peptidase 4,DPP4)的潜在抑制剂,最后通过体外实验验证潜在降糖活性成分的降糖作用。本研究为从龙血竭中筛选SGLT2、DPP4抑制剂提供依据。
1 材料
1.1 细胞株
人肝癌HepG2细胞株(SCSP-5036),中国科学院上海生命科学研究院。
1.2 动物
昆明种小鼠,雄性,SPF级,体质量18~22 g,购于北京斯贝福生物技术有限公司(SCXK京2019-001)。动物实验经广西中医药大学实验动物福利伦理委员会批准(批准号DW20210628-072)。
1.3 试剂与药物
龙血竭(批号20170101)购自广西中医药大学制药厂;二甲双胍(批号419K026)、胰岛素(批号830M021)、PBS缓冲液(批号20210920)、MTT试剂(批号1123A0517)均购自Solarbio公司;开环异落叶松树脂酚[(+)-secoisolariciresinol,批号PHL80532,质量分数≥95%]、-茶氨酸(-theanine,批号SMB00395,质量分数≥98%)均购自Sigma-Aldrich公司;高糖培养基(DMEM)、胎牛血清均购自Biological Industries公司;葡萄糖试剂盒(批号20211012)购自南京建成生物工程研究所。
1.4 仪器
Thermo Vanquish超高效液相系统(Thermo Fisher Scientific公司,美国);ACQUITY UPLC HSS T3色谱柱(Waters公司,美国);Thermo Q Exactive Focus 质谱检测器(Thermo Fisher Scientific公司,美国);MCO-18AIC CO2培养箱(Panasonic公司);Infinite 200 PRO酶标仪(TECAN Austria GmbH公司)。
1.5 软件与数据库
PubChem数据库(https://pubchem.ncbi.nlm.nih. gov/);PubMed数据库(https://pubmed.ncbi.nlm.nih. gov/);Drugbank数据库(https://go.drugbank.com/);PDB数据库(https://www.rcsb.org/);Discovery Studio(2016)软件。
2 方法
2.1 细胞实验[4]
2.1.1 龙血竭含药血清的制备 8只小鼠ig给予龙血竭混悬液(取5.67 g龙血竭加入适量水、0.1%羧甲基纤维素钠,均质,加水调至质量浓度为0.27 g/mL混悬液)4.438 8 g/(kg·d),连续7 d,末次给药1 h后摘除眼球取血,3000 r/min离心10 min,即得龙血竭含药血清。
2.1.2 不同浓度胰岛素对细胞活性的影响 取对数生长期的HepG2细胞,以2×105个/mL的细胞密度接种于96孔板中,每孔100 μL,分别用1.00、0.10、0.01 μmol/L浓度胰岛素处理,以正常培养液处理作为对照,每组5个复孔,于37 ℃、5% CO2培养箱中培养36 h,每孔加入20 μL 0.5% MTT溶液,培养箱中孵育4 h后加入150 μL DMSO,于490 nm下测定吸光度(),计算细胞存活率。
细胞存活率=给药/对照
2.1.3 胰岛素作用浓度筛选 取对数生长期的HepG2细胞,以2×105个/mL的细胞密度接种于96孔板中,每孔100 μL。分别用1.00、0.10、0.01 μmol/L浓度胰岛素处理,以正常培养液处理作为对照,每组5个复孔,于37 ℃、5% CO2培养箱中培养36 h,弃去原培养液,换上不完全培养基饥饿处理24 h,按葡萄糖检测试剂盒法测定各组葡萄糖含量,计算葡萄糖消耗量。
2.1.4 胰岛素作用时间筛选 取对数生长期的HepG2细胞,以2×105个/mL的细胞密度接种于96孔板中,每孔100 μL。用筛选出的最佳浓度胰岛素处理,以正常培养液处理作为对照,每组5个复孔,于37 ℃、5% CO2培养箱中培养12、24、36、48 h,弃去原培养液,换上不完全培养基饥饿处理24 h,按葡萄糖检测试剂盒法测定各组葡萄糖含量,计算葡萄糖消耗量。
2.1.5 龙血竭含药血清对HepG2细胞胰岛素抵抗的作用 以二甲双胍作为阳性对照,判断龙血竭含药血清对胰岛素抵抗是否有作用。取对数生长期的HepG2细胞,以2×105个/mL的细胞密度接种于96孔板中,每孔100 μL。随机分为对照组(正常培养液处理)、模型(最佳浓度胰岛素)组、二甲双胍阳性(1 mmol/L)组及龙血竭含药血清低、高剂量(2.5%、5.0%含药血清,剂量经预试验确定)组。每组5个复孔。除对照组外,其他组建立胰岛素抵抗模型,给药24 h,弃去原培养液,换上不完全培养基饥饿处理24 h,按葡萄糖检测试剂盒说明书测定各组葡萄糖含量,计算葡萄糖消耗量。
2.2 化合物库的建立
2.2.1 基于LC-MS的成分检测
(1)龙血竭溶液的制备:精密称量100 mg龙血竭粉末样品于2 mL离心管中,加入600 μL甲醇(含2-氯--苯丙氨酸),涡旋振荡30 s,加入100 mg玻璃珠,放入组织研磨器中,55 Hz研磨90 s,室温超声10 min,4 ℃、12 000 r/min离心10 min,取上清液经0.22 μm膜滤过,取滤液即得。
(2)色谱条件:ACQUITY UPLC HSS T3色谱柱(150 mm×2.1 mm,1.8 μm);体积流量0.25 mL/min,柱温40 ℃,进样量2 μL;正离子模式流动相为0.1%甲酸乙腈(C)-0.1%甲酸水(D),梯度洗脱程序:0~1 min,2% C;1~9 min,2%~50% C;9~12 min,50%~98% C;12~13.5 min,98% C;13.5~14 min,98%~2% C;14~20 min,2% C;负离子模式流动相为乙腈(A)-5 mmol/L甲酸铵水(B),梯度洗脱程序:0~1 min,2% A;1~9 min,2%~50% A;9~12 min,50%~98% A;12~13.5 min,98% A;13.5~14 min,98%~2% A;14~17 min,2% A。
(3)质谱条件:电喷雾离子源,正离子喷雾电压3.50 kV,负离子喷雾电压−2.50 kV,鞘气流速30 arb,辅助气体流速10 arb,毛细管温度325 ℃,一级全扫描(81~1000)分辨率70 000,碰撞能量30 eV,二级分辨率17 500。
2.2.2 基于文献的成分筛选 于中国知网(CNKI)、Web of Science数据库中以“龙血竭”并“化学成分”进行主题检索,通过阅读摘要,选择经核磁共振色谱法鉴定的龙血竭成分,合并数据库检索与本研究LC/MS分析所得成分。
2.2.3 化合物的ADMET筛选 从PubChem数据库获得化合物2D结构,保存为SDF格式,导入Discovery Studio,使用ADMET Descriptors功能,得到人体肠道吸收性(human intestinal absorption,HIA)、血脑屏障通透性(blood brain barrier,BBB)等结果,筛选位于HIA及BBB 99%置信区间内的化合物建库。
2.2.4 龙血竭化合物库的建立 经ADMET初筛的化合物,通过“Prepare Ligands”及“Minimize Ligands”进行加氢、结构优化,利用“Build 3D Database”功能构建龙血竭化合物数据库,参数number of conformations设置为200,conformation method选择BEST。
2.3 药效团筛选
2.3.1 基于配体的药效团模型的构建 通过DrugBank数据库“targets”项输入靶点名称SGLT2及DPP4,选取已经得到认可、药理作用明确的抑制剂作为训练集分子(SGLT2抑制剂5个、DPP4抑制剂4个),从PubChem数据库获得分子的SDF格式文件,导入Discovery Studio,利用“Pharmacophore”模块的“Edit and Cluster Features”识别所有特征元素,并通过该模块下“Common Feature Pharmacophore Generation”构建基于分子共同特征的药效团模型。参数conformation generation选择BEST,maximum conformation设置为200,energy threshold设置为10,其他设为默认值。
2.3.2 药效团模型的验证 通过测试集分子(测试集包括活性分子、非活性分子)对药效团模型可靠性进行评价。SGLT2的测试集分子由18个活性分子、18个非活性分子构成,DPP4的测试集分子由16个活性分子、17个非活性分子构成。通过Discovery Studio中“Pharmacophore”下的“Ligand Profiler”模块对所有模型进行验证。Conformation generation选择BEST,maximum conformation设置为200,energy threshold设置为10。
2.3.3 潜在活性分子的虚拟筛选 利用“Search,Screen and Profile”模块筛选潜在活性分子,“Search 3D Database”参数列表“Database”选择龙血竭化合物库,“Pharmacophore”选择最优药效团模型,搜索与药效团相匹配的化学成分。
2.4 分子对接
2.4.1 受体与配体分子的准备 运用“Prepare Ligands”和“Minimize Ligands”模块优化与药效团匹配的化合物,作为配体分子。通过PDB数据库检索,获得SGLT2与DPP4蛋白的PDB格式文件,“Clean Protein”和“Prepare Protein”模块去除蛋白多构象,“Add Polar”为蛋白加氢,以蛋白质共晶化合物所在空间为活性中心,将蛋白质分子定义为受体分子。
2.4.2 分子对接 通过LibDock分子对接模式将受体与配体分子进行快速精准的对接,参数number of hotspots设置为100,docking tolerance设置为0.25,conformation method选择BEST,minimization algorithm选择smart minimizer。根据LibDock score筛选化合物排名前3的构型,通过“Calculate Binding Energies”计算结合能,将蛋白质共晶化合物作为对照配体,筛选潜在抑制剂。
2.5 潜在抑制剂的降糖活性实验验证
按照“2.1.5”项方法测定潜在抑制剂的降糖活性,其中实验组龙血竭含药血清替换为潜在抑制剂,剂量为50、100 μmol/L。
3 结果
3.1 龙血竭对胰岛素抵抗HepG2细胞葡萄糖消耗的影响
由图1-A可知,胰岛素浓度为1.00 μmol/L时,HepG2细胞存活率显著下降(<0.01),显示该浓度下细胞的生长被抑制;与此相反,浓度为0.10、0.01 μmol/L时胰岛素对细胞生长无显著抑制。由图1-B可知,在胰岛素浓度为1.00、0.10、0.01 μmol/L时,浓度越小,葡萄糖消耗量越少,与对照组相比,胰岛素浓度为0.01 μmol/L时,细胞葡萄糖消耗量显著下降(<0.05),提示该浓度下细胞处于胰岛素抵抗状态。由图1-C可知,时间越长,葡萄糖消耗量越大,与对照组相比,36 h的细胞葡萄糖消耗量显著下降(<0.05),提示胰岛素处理36 h为细胞的最佳造模时间。胰岛素抵抗模型最佳条件:0.01 μmol/L胰岛素处理36 h。如图1-D所示,与对照组相比,模型组的葡萄糖消耗量显著降低(<0.01),提示胰岛素抵抗模型成功建立,与模型组相比,二甲双胍、龙血竭含药血清组葡萄糖消耗量显著增加(<0.05、0.01),说明二甲双胍与龙血竭均能促进HepG2细胞对葡萄糖的摄入,具有改善胰岛素抵抗的作用,龙血竭含药血清高剂量组作用更明显。
3.2 龙血竭化合物库
3.2.1 成分分析 通过LC-MS技术分析,共得到176个龙血竭化学成分,总离子流色谱图如图2所示,3个平行龙血竭样品的色谱峰响应强度与保留时间基本重合,表明仪器误差较小;通过文献检索得到经核磁验证的龙血竭化学成分257个,与LC-MS分析得到的176个成分合并、去重,删除无CAS号的成分,最终得到龙血竭化学成分209个[5-16]。
3.2.2 化合物ADMET预过滤 SGLTs是人体中重要的葡萄糖转运蛋白,SGLT2能促进葡萄糖转运体对葡萄糖的吸收,在中枢神经系统中可检测到该类蛋白的表达[17]。如图3所示,从209个龙血竭化学成分中,筛去30个化学成分(它们位于BBB及HIA的99%置信区间外),剩余179个化合物被认为BBB和HIA较好。
3.3 药效团筛选
3.3.1 药效团模型的构建 如表1所示,通过识别SGLT2、DPP4的训练集分子的共同特征元素,分别建立2个靶点的10个药效团模型,其中R表示芳环中心,P表示正点离子中心,H表示疏水特征,A表示氢键受体特征,D表示氢键供体特征,Rank值表示该药效团模型的打分情况。在SGLT2的10个药效团中,编号01、02、03模型Rank值最高(61.355分),SGLT2潜在抑制剂的结构应具备1个芳环中心、1个疏水基团以及2个氢键受体的特征;DPP4药效团中01模型Rank值最高(77.401分),预测DPP4的潜在抑制剂应同时具备1个正离子中心、1个疏水基团以及2个氢键受体的特征。

A-细胞活性实验 B-胰岛素浓度筛选 C-胰岛素作用时间筛选 D-龙血竭含药血清对胰岛素抵抗作用 与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01

A-正离子模式 B-负离子模式
3.3.2 药效团模型的验证 如图4所示,匹配热图中不同颜色代表Fitvalue大小,颜色越趋近于红色,值越大,说明该分子对药效团的匹配度越高。由图4-A可知,近一半的活性分子可与SGLT2的10个药效团匹配,且匹配度达到2.500以上,显示10个药效团均具备良好的区分能力,其中以SGLT2-02药效团模型最优。由图4-B可知,绝大多数活性分子与药效团匹配度在2.250以上,DPP4-03药效团模型可匹配最多数量的活性分子,且多为Fit value高的橙色区域,对非活性分子多为Fit value低的蓝色区域。SGLT2-02药效团模型、DPP4-03药效团模型见图5。

图3 龙血竭化学成分BBB与HIA的95%、99%置信区间筛选
3.3.3 潜在活性分子的虚拟筛选 在179个化学成分中,化合物丁香树脂酚(syringaresinol,L1,2.572 29)、松脂酚(pinoresinol,L2,2.478 66)、5′-甲氧基松脂素(medioresinol,L3,2.457 06)、表松脂酚(epipinoresinol,L4,2.381 18)、开环异落叶松树脂酚(L5,2.144 68)、3,2′,4′-三羟基-4-甲氧基查耳酮(3,2′,4′-trihydroxy-4-methoxychalcone,L6,0.475 80)与SGLT2-02药效团相匹配;-茶氨酸(L7,/173.093 1,3.362 70)、1-palmitoylglycerophosphocholine(L8,/496.344 8,3.350 16)、practolol(L9,/265.148 5,2.952 77)、metanephrine(L10,/180.101 3,2.680 57)、epinephrine(L11,/166.084 9,2.365 02)、thymidine(L12,/242.176 4,2.333 85)、nalbuphine(L13,/358.208 7,1.904 56)、mepyramine(L14,/286.187 4,1.225 61)能够与DPP4-03药效团模型匹配,Fit value及部分潜在活性分子质荷比见括号内数值。
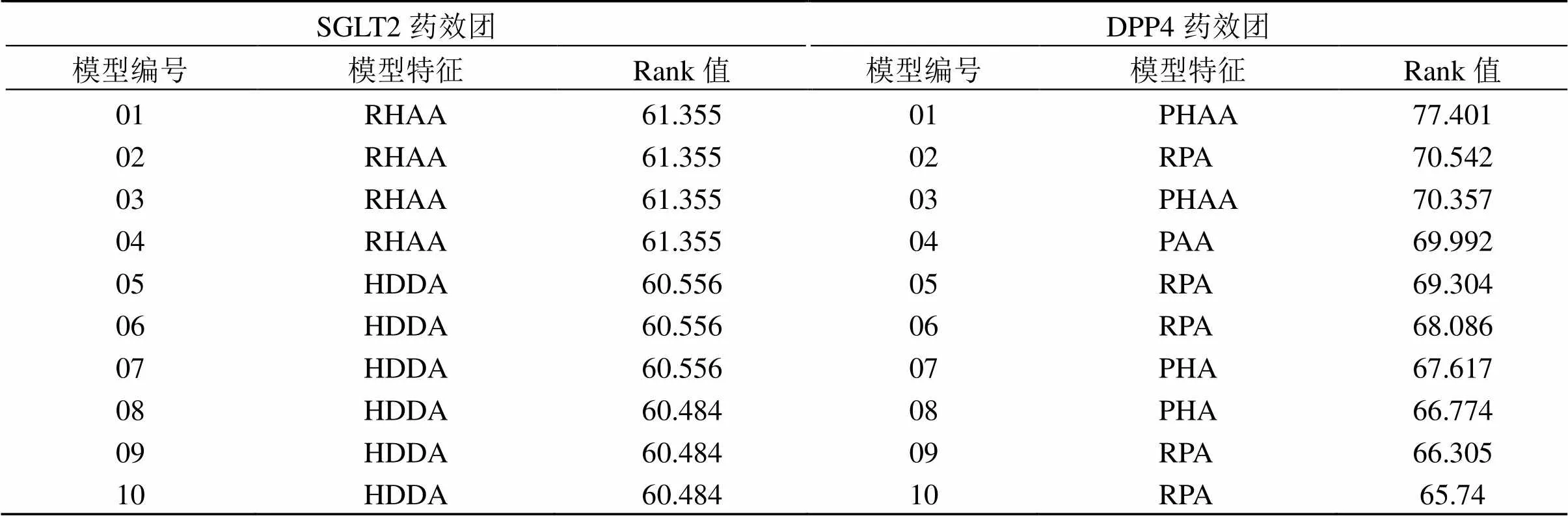
表1 药效团构建结果

A-SGLT2的匹配热图 B-DPP4的匹配热图

图5 SGLT2最优药效团模型(SGLT2-02) 与DPP4最优药效团模型(DPP4-03)
3.4 潜在抑制剂筛选
将SGLT2、DPP4受体与潜在活性分子进行对接,其中7R3、D3C分别为受体的共晶化合物。如表2所示,5′-甲氧基松脂素(L3)、开环异落叶松树脂酚(L5)与SGLT2的结合能小于对照配体7R3,分别为−852.285、−798.060 kJ/mol,主要与氨基酸残基VAL157、ASP158、HIS80发生碳氢键、离子交换、疏水相互作用等(图6-A、B);1-palmitoyl- glycerophosphocholine(L8)、-茶氨酸(L7)与DPP4的结合能分别为−916.116、−667.356 kJ/mol,低于对照配体D3C,两分子主要与氨基酸残基TYR547形成氢键、与ARG125形成吸电荷相互作用、与SER630形成氢键相互作用(图6-C、D)。提示TYR547、ARG125与SER630是DPP4与抑制剂相互作用的关键氨基酸残基。

表2 潜在活性分子与靶点的对接结合能

A-L3与SGLT2的相互作用图 B-L5与SGLT2的相互作用图 C-L8与DPP4的相互作用图 D-L7与DPP4的相互作用图
3.5 潜在抑制剂L5、L7的降糖活性验证
采用细胞实验对潜在抑制剂进行降糖活性验证,因中国食品药品检定研究院、Sigma-Aldrich公司不提供5′-甲氧基松脂素、1-palmitoylglycero-phosphocholine,无法购买,故只对开环异落叶松树脂酚、-茶氨酸进行验证,结果如图7所示,与模型组相比,二甲双胍组、开环异落叶松树脂酚(L5)、-茶氨酸(L7)组葡萄糖消耗量显著增加(<0.05、0.01),其中,L5、L7的100 mmol/L剂量组葡萄糖消耗量与二甲双胍组相似,提示L5、L7均具有改善胰岛素抵抗的作用,且高剂量组促葡萄糖吸收能力更强。
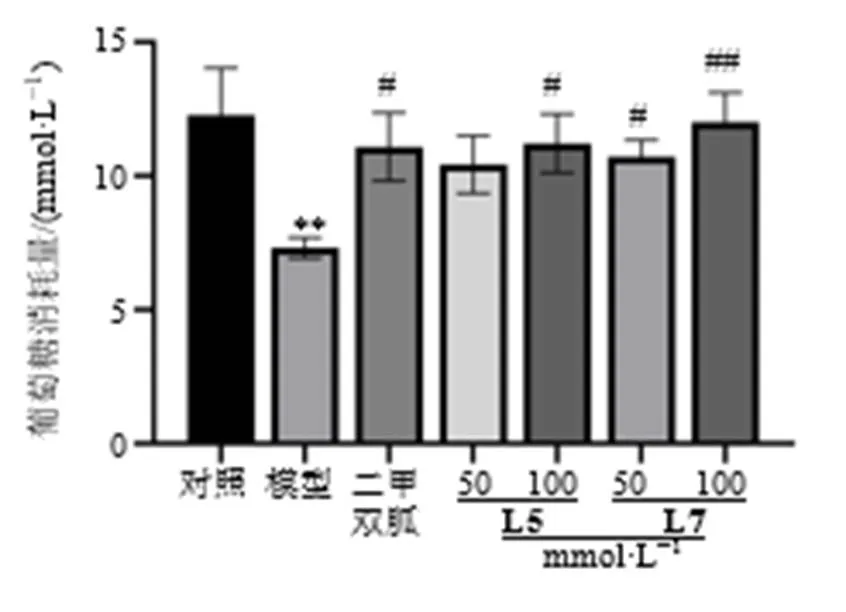
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01
4 讨论
靶向葡萄糖代谢途径的降糖药物筛选,一直是降糖药物研发领域的热点。目前糖尿病药物除了有传统的胰岛素、双胍类、α-糖苷酶抑制剂、磺脲类及格列奈类药物以及过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)激动剂以外,还有近年来上市的DPP-4抑制剂、胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)类似物和SGLT-2抑制剂等药物。胃肠道中SGLTs的主要功能是将葡萄糖转运至循环血液系统中。在高糖患者体内,若能抑制SGLTs活性,则可达到降低血糖的目的,SGLT2抑制剂能够通过缓解糖毒性造成的氧化应激,增强胰岛素信号通路的传导,改善胰岛素抵抗[18]。肠道中的GLP-1可作用于受体促进胰岛素合成分泌,但其极易被DPP4快速降解失去活性,且DPP4在肝脏中的过度表达降低了胰岛素敏感性,从而导致胰岛素抵抗[19]。因此,有必要开发研究出更多的SGLT-2、DPP4抑制剂改善胰岛素抵抗,降低血糖。龙血竭中酚类化合物可抑制SGLT2活性,通过增加尿糖降低血糖[20],但未见龙血竭抑制DPP4靶点的相关报道。本研究通过体外实验已验证龙血竭可显著增加胰岛素抵抗模型的HepG2细胞葡萄糖消耗量,龙血竭中降糖活性化合物和靶点尚未清楚。
计算机辅助药物设计技术(computer aided drug design,CADD)通过计算机使用数学模型进行计算、模拟,预测药物分子与靶点间的相互作用,从大量预选化合物中筛选出有潜力的先导化合物,大大提高了药物开发的速度。药效团作为寻找先导化合物的重要手段,应用于虚拟筛选数据库、判断分子的某类药效特征、辅助改造分子结构、推断受体与配体间可能的作用模式等[21]。基于药效团的活性靶点和作用成分筛选是近年研究热点,已经应用在降糖靶点PPAR、G蛋白偶联受体40(G-protein-coupled receptor 40,GPR40)激动剂的高通量筛选上。本研究建立基于SGLT2、DPP-4抑制剂分子共同特征的药效团,从龙血竭化合物库筛选得到潜在活性分子,再与靶点进行分子对接筛选得到4个潜在的SGLT2、DPP-4抑制剂,分别为5′-甲氧基松脂素、开环异落叶松树脂酚、1-palmitoylglycerophos-phocholine和-茶氨酸。其中,5′-甲氧基松脂素、开环异落叶松树脂酚均为木脂素类化合物,5′-甲氧基松脂素主要存在于杜仲,具有抗肿瘤、降压等作用;开环异落叶松树脂酚具有降糖、抗氧化、预防乳腺癌及前列腺癌等作用,开环异落叶松树脂酚通过清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picylhydrazyl,DPPH)自由基使由链脲佐菌素诱导的糖尿病小鼠的空腹血糖降低33.4%[22];1-palmitoylglycerophosphocholine主要在肝磷脂分解代谢中发挥作用;-茶氨酸为酰胺类化合物,最早于绿茶叶中发现,具有降糖、抗肿瘤、神经保护等作用,可通过促进糖原合成、抑制糖异生及促进糖酵解,从而降低葡萄糖含量[23]。以上提示,4个化合物显示降糖潜力,龙血竭降糖活性可能与4个化合物的活性相关,它们是SGLT2、DPP-4的潜在抑制剂。
5 结论
本研究通过细胞实验证实了龙血竭具有改善HepG2细胞胰岛素抵抗的作用,利用LC-MS技术与文献检索建立了龙血竭的成分库,通过构建基于共同特征的药效团虚拟筛选出6个SGLT2的潜在抑制活性分子、8个DPP4的潜在抑制活性分子,再将活性分子与靶点进行分子对接,筛选得到5′-甲氧基松脂素、开环异落叶松树脂酚、1-palmitoylglycerophosphocholine与-茶氨酸是SGLT2、DPP-4的潜在抑制剂,最后通过细胞实验证实开环异落叶松树脂酚、-茶氨酸具有降糖活性,为揭示龙血竭降糖作用和机制提供依据。
志谢:广西大学于凯博士为分子对接和药效团分析提供帮助。
利益冲突 所有作者均声明不存在利益冲突
[1] 林忆龙, 文亦磊, 黄洪, 等. 龙血竭化学成分及药理作用研究进展 [J]. 中国民族民间医药, 2020, 29(6): 50-55.
[2] 刘培培, 雍克岚, 吕敬慈, 等. 龙血竭提取物对正常及四氧嘧啶糖尿病模型小鼠的影响 [J]. 时珍国医国药, 2006, 17(10): 1886-1888.
[3] 陈洪涛, 刘源焕, 覃学谦, 等. 龙血竭不同提取部位对高血糖模型小鼠血糖水平的影响 [J]. 时珍国医国药, 2014, 25(9): 2077-2078.
[4] 魏萍, 薛春苗, 潘霖, 等. 甲基莲心碱对胰岛素抵抗的HepG2细胞降糖的影响 [J]. 临床和实验医学杂志, 2020, 19(12): 1283-1286.
[5] 罗应. 海南龙血竭化学成分及其生物活性的研究 [D]. 海口: 海南大学, 2011.
[6] 王芳芳. 剑叶龙血树的化学成分及其生物活性研究 [D]. 昆明: 云南民族大学, 2015.
[7] 苏小琴, 李曼曼, 顾宇凡, 等. 龙血竭酚类成分研究 [J]. 中草药, 2014, 45(11): 1511-1514.
[8] 郎光振, 李创军, 张东明. 龙血竭化学成分研究 [A] // 中国化学会第十二届全国天然有机化学学术会议论文摘要集 [C]. 杭州: 中国化学会, 2018: 373.
[9] 董恩双. 龙血竭化学研究及降血糖有效部位的筛选 [D]. 北京: 北京中医药大学, 2008.
[10] 刘芳, 戴荣继, 吕芳, 等. 龙血竭总酚提取物化学成分的分离鉴定 [J]. 北京理工大学学报, 2014, 34(1): 102-105.
[11] 杨宁, 王辉, 刘寿柏, 等. 人工诱导海南龙血竭的化学成分研究 [J]. 热带亚热带植物学报, 2019, 27(2): 219-224.
[12] González A G, León F, Sánchez-Pinto L,. Phenolic compounds of Dragon's blood from[J]., 2000, 63(9): 1297-1299.
[13] Hao Q, Saito Y, Matsuo Y,. Three new flavans in dragon's blood from[J]., 2015, 29(15): 1419-1425.
[14] Wang H, Luo G Y, Wang J Y,. Flavonoids produced by tissue culture of[J]., 2014, 9(1): 39-40.
[15] Wang H, Jiang H M, Li F X,. Flavonoids from artificially induced dragon's blood of[J]., 2017, 121: 1-5.
[16] Masaoud M, Ripperger H, Himmelreich U,. Cinnabarone, a biflavonoid from dragon’s blood of[J]., 1995, 38(3): 751-753.
[17] 文松, 阮氏琼娥, 贺艳菊, 等. 钠-葡萄糖共转运体2抑制剂改善心力衰竭的研究进展 [J]. 同济大学学报: 医学版, 2021, 42(1): 130-135.
[18] 温小花, 鞠霖杰, 王春俊, 等. SGLT2抑制剂代谢调控作用的相关研究进展 [J]. 中国新药杂志, 2018, 27(4): 417-421.
[19] Baumeier C, Schlüter L, Saussenthaler S,. Elevated hepatic DPP4activity promotes insulin resistance and non-alcoholic fatty liver disease [J]., 2017, 6(10): 1254-1263.
[20] Williamson G. Effects of polyphenols on glucose-induced metabolic changes in healthy human subjects and on glucose transporters [J]., 2022: 2022: e2101113.
[21] 乔连生, 张燕玲. 计算机辅助药物设计在天然产物多靶点药物研发中的应用 [J]. 中国中药杂志, 2014, 39(11): 1951-1955.
[22] Banskota A H, Nguyen N T, Tezuka Y,. Hypoglycemic effects of the wood ofon streptozotocin-induced diabetic rats and its active components [J]., 2006, 13(1/2): 109-114.
[23] Lin L, Zeng L, Liu A,. l-Theanine regulates glucose, lipid, and protein metabolism via insulin and AMP-activated protein kinase signaling pathways [J]., 2020, 11(2): 1798-1809.
Screening of potential hypoglycemic active ingredients fromon pharmacophore model
MO Jun-ru1, QIN Miao1, ZHU Su-mei1, HUANG Jin-mei1, FENG Jian-fang1, 2, LI Fang1, 3, LIANG Jian-qin1, 2, 3
1. Guangxi University of Chinese Medicine, Nanning 530200, China 2. Guangxi Superior Proprietary Chinese Medicine and Ethnic Medicine Development Engineering Technology Research Center, Nanning 530023, China 3. Guangxi Key Laboratory of Common Technology of Traditional Chinese Medicine Preparation in Laboratory, Nanning 530200, China
To screen potential hypoglycemic active ingredients of Longxuejie (, Chinese dragon’s blood) based on pharmacophore model.The glucose consumption of serum containingon insulin resistance model of HepG2 cells was determined by glucose oxidase method. The compound database ofwas established by liquid chromatography-mass spectrometry (LC-MS) identify and searching CNKI and Web of Science database. Then compounds were filtered by ADMET (absorption, distribution, metabolism, excretion and toxicity) module of Discovery Studio. The candidate active ingredients were screened by pharmacophore models for sodium-glucose cotransporter 2 (SGLT2) and dipeptidyl peptidase 4 (DPP4) and molecular docking. Finally, the activity of candidate active ingredients were verified by cellular experiments.The serum containingsignificantly increased glucose consumption of insulin-resistant HepG2 cells compared with the model group (< 0.05). A total of 179 compounds fromwere screened by ADMET module. A total of 14 potential inhibitors of SGLT2 and DPP4 were screened by the optimal pharmacophore model of SGLT2-02 and DPP4-03. The binding energies of medioresinol, (+)-secoisolariciresinol, 1-palmitoylglycerophosphocholine and-theanine were lower than the control ligands, which were −852.285, −798.060, −916.116, −667.356 kJ/mol, respectively. (+)-Secoisolariciresinol and-theanine could significant increase glucose consumption of HepG2 cells compared with the model group (< 0.05, 0.01).showed goodhypoglycemic activity. Medioresinol and (+)-secoisolariciresinol were the potential inhibitors of SGLT2, and 1-palmitoylglycerophosphocholine and-theanine were the potential inhibitors of DPP4. (+)-Secoisolariciresino and-theanine showed goodhypoglycemic activity.
; hypoglycemic effect; ADMET; pharmacophore; molecular docking; sodium-glucose cotransporter 2 (SGLT2); dipeptidyl peptidase 4 (DPP4); (+)-secoisolariciresino;-theanine
R284;R285
A
0253 - 2670(2022)15 - 4764 - 09
10.7501/j.issn.0253-2670.2022.15.020
2022-05-11
国家自然科学基金项目(81960872);广西研究生教育计划项目(YCSW2021240)
莫钧茹(1997—),女,2020级在读硕士生,从事中药新药研究与开发。Tel: 15578681531 E-mail: 2423413578@qq.com
通信作者:黎 芳,讲师,从事中药新药研究与开发。Tel: 18978362162 E-mail: 273228824@qq.com
梁健钦,研究员,从事中药新药研究与开发。Tel: 15977775577 E-mail: 80004622@qq.com
#共同第一作者:覃 淼(1998—),女,2020级在读硕士生,从事中药新药研究与开发。Tel: 15676117696 E-mail: 1670698188@qq.com
[责任编辑 潘明佳]