石菖蒲根茎化学成分及抗炎活性研究
邱路雅,杨 刚,金 琼,罗晓东,刘亚平3, ,王易芬
石菖蒲根茎化学成分及抗炎活性研究
邱路雅1, 4,杨 刚1, 4,金 琼4,罗晓东4,刘亚平3, 4*,王易芬1, 2*
1. 云南中医药大学中药学院,云南 昆明 650500 2. 中国科学院昆明动物物研究所,云南 昆明 650201 3. 昆明理工大学食品科学与工程学院,云南 昆明 650500 4. 中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,云南 昆明 650201
对石菖蒲干燥根茎的化学成分及其抗炎活性进行研究。采用硅胶、YMC、Sephadex LH-20等多种柱色谱填料进行分离纯化,根据理化性质结合波谱数据鉴定化合物结构。通过检测脂多糖(lipopolysaccharide,LPS)诱导的RAW 264.7巨噬细胞中白细胞介素6(interleukin 6,IL-6)、IL-1β、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)炎症因子的表达和一氧化氮(NO)的抑制能力,来评估所分离化合物的抗炎作用。从石菖蒲中分离得到18个单体化合物,包括9个苯丙素类、4个酚类、2个木脂素类、1个倍半萜、1个甾体及1个其他类型化合物,分别鉴定为原儿茶醛(1)、3,5-二甲氧基-4-羟基苯丙酮(2)、4-(乙氧基甲基)苯酚(3)、(2)-3-(4-羟基-3-甲氧基苯基)-2-丙烯酸戊酯(4)、反式-阿魏酸二十二烷基酯(5)、反式-阿魏酸二十烷基酯(6)、4-羟基-3-甲氧基肉桂酸乙酯(7)、3-(2-甲氧基乙基)苯酚(8)、反式松柏醛(9)、对甲氧基苯酚(10)、β-细辛醚(11)、α-细辛醚(12)、2-乙酰基-菖蒲烯酮(13)、对羟基苯甲酸(14)、5,8,11,14,17-二十碳五烯酸(15)、(−)-丁香树脂(16)、(−)-松脂醇(17)、胡萝卜苷(18)。化合物2~9均为首次从该属植物中分离获得。此外,单体化合物的抗炎活性与阳性对照组地塞米松比较,化合物1~4、6~12、14~16在20 μg/mL质量浓度下能显著降低LPS诱导的RAW 264.7巨噬细胞中IL-6、IL-1β、TNF-α炎性细胞因子分泌和NO的释放,具有较好的体外抗炎作用。
石菖蒲;抗炎活性;炎症因子;3,5-二甲氧基-4-羟基苯丙酮;4-(乙氧基甲基)苯酚;反式松柏醛
石菖蒲Schott为天南星科(Araceae)菖蒲属L.植物。全国各省区均产,其干燥根茎被《中国药典》2020年版收录具有开窍豁痰、醒神益智、化湿开胃的功效,用于治疗痰涎壅闭、神识不清、腹胀腹痛、食欲不振、风寒湿痹等症[1-2]。现代药理研究表明,石菖蒲根茎具有显著的抗炎、免疫抑制、抗真菌、抗抑郁等作用[3-4],其主要化学成分为苯丙素、倍半萜、木脂素、生物碱、萜类和甾体、多糖等[5-6]。为进一步揭示石菖蒲根茎的化学成分,研究丰富该植物的化学多样性,本实验从石菖蒲干燥根茎中分离获得了18个单体化合物,通过核磁共振、质谱等手段分别鉴定为原儿茶醛(protocatechualdehyde,1)、3,5-二甲氧基-4-羟基苯丙酮(3,5-dimethoxy-4-hydroxypropiophenone,2)、4-(乙氧基甲基)苯酚 [4-(ethoxymethyl) phenol,3]、(2)-3-(4-羟基-3-甲氧基苯基)-2-丙烯酸戊酯 [pentyl (2)-3-(4-hydroxy-3-methoxyphenyl)-2- propenoate,4]、反式-阿魏酸二十二烷基酯(-ferulic acid docosyl ester,5)、反式-阿魏酸二十烷基酯(-ferulic acid eicosyl ester,6)、4-羟基-3-甲氧基肉桂酸乙酯(4-hydroxy-3-methoxy cinnamic acid ethyl ester,7)、3-(2-甲氧基乙基)苯酚 [3-(2- methoxyethyl)phenol,8]、反式松柏醛(-coniferyl aldehyde,9)、对甲氧基苯酚(4-methoxyphenol,10)、β-细辛醚(β-asarone,11)、α-细辛醚(α-asarone,12)、2-乙酰基-菖蒲烯酮(2-acetoxyacorenone,13)、对羟基苯甲酸(-hydroxybenzoic acid,14)、5,8,11,14,17-二十碳五烯酸(5,8,11,14,17-eicosapen- taenoic acid,15)、(−)-丁香树脂 [(−)-syringaresinol,16]、(−)-松脂醇 [(−)-pinoresinol,17]、胡萝卜苷(daucosterol,18)。其中,化合物2、4~9、11~12为苯丙素类化合物,化合物1、3、10、14为酚类化合物,化合物16、17为木脂素类化合物,化合物13为倍半萜,化合物18为甾体类化合物,化合物15为其他类型化合物,化合物2~9为首次从该属中分离得到。利用脂多糖(lipopolysaccharide,LPS)诱导的RAW 264.7巨噬细胞评估了18个单体化合物的体外抗炎活性,结果表明,与阳性对照组地塞米松(dexamethasone,DXM)比较,化合物1~4、6~12、14~16在20 μg/mL能显著降低LPS诱导的RAW 264.7巨噬细胞中白细胞介素6(interleukin 6,IL-6)、IL-1β、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)炎症因子分泌和NO的释放,具有潜在的体外抗炎作用。
1 仪器与材料
1290 UPLC/6540 Q-TOF串联四极杆飞行时间质谱仪(美国Agiletn公司),Bruker AVANCE-III(400、500、600 MHz)型核磁共振波谱仪(德国Bruker公司),Waters 600半制备型高效液相色色谱仪和Shimadzu SIL-20A制备型HPLC,两者均为双波长紫外检测器,色谱柱为COSMOSILRP-C18(250 mm×10 mm,5 µm,COSMOSIL,日本)及Ultimate XB-C18(250 mm×10 mm,5 µm,Welch,上海月旭),MCI-凝胶(75~150 µm,日本三菱化学公司),YMC-凝胶(50 μm,日本YMC有限公司),Sephadex LH-20葡聚糖凝胶(40~150 µm,瑞典乌朴萨拉Amersham Pharmacia Biotech AB公司),反相常压和中压填充材料为Lichroprep RP-18(40~63 μm,德国达姆施塔特Merck公司),拌样硅胶及柱色谱色谱硅胶(200~300目,青岛谱科分离材料有限公司)。LPS(Solarbio公司,中国北京),磷酸盐缓冲液(PBS)、胎牛血清(FBS)、Eagle培养基(DMEM)(Servicebio Technology,中国武汉)。NO试剂盒(南京建成生物工程研究所),MTT(Sigma-Aldrich公司,中国上海),TNF-α、IL-6和IL-1β试剂盒(MultiSciences Biotech公司,中国杭州)。地塞米松(批号D1001A,大连美仑生物技术有限公司),甲醇和乙腈(色谱纯,美国Fisher公司),其余工业级别试剂均为重蒸后使用。
实验用石菖蒲于2020年11月购买于云南省昆明市菊花村药材市场,植物由昆明理工大学刘亚平副研究员鉴定为石菖蒲Schott的干燥根茎,目前植物标本(Liu20201103)存放于中国科学院昆明植物研究所植物化学与西部资源可持续利用国家重点实验室。
2 方法
2.1 提取与分离
石菖蒲干燥根茎1 kg,粉碎后加入90%甲醇水溶液,先冷浸12 h,然后加热(60 ℃左右)回流提取4次,每次约3 h,滤过,合并提取液,减压浓缩得粗提物浸膏约200 g。将浸膏用适量水混悬分散,加入适量的醋酸乙酯,萃取3次,将得到醋酸乙酯部分浓缩得到浸膏19 g。硅胶拌样后经硅胶柱色谱粗分,以氯仿-甲醇(1∶0~1∶1)进行梯度洗脱,TLC检测分为4个流分(Fr A~D)。
Fr A(2.7 g)在MCI柱上分离,用甲醇-水(70∶30→100∶0)梯度洗脱后,经TLC检识合并再经过硅胶柱色谱分离,石油醚-醋酸乙酯(30∶1)等度洗脱得到化合物15(12 mg)。
Fr B(7 g)通过正相硅胶柱色谱分离,石油醚-醋酸乙酯(15∶1→1∶1)梯度洗脱,TLC检测流分,合并得到3个亚组分Fr B-1~B-3。其中Fr B-1(2.6 g)经中压液相色谱甲醇-水(40∶60→100∶0)梯度洗脱后得到化合物4(32 mg)和3(5 mg),再经半制备型高效液相色谱纯化得到化合物10(20 mg,R=15.5 min;乙腈-水55∶45,3.0 mL/min),和14(30 mg,R=25.5 min;乙腈-水55∶45,3.0 mL/min)。Fr B-2(580 mg)经制备型高效液相色谱洗脱得到化合物5(25 mg,R=15.5 min;乙腈-水70∶30,3.0 mL/min)和6(68 mg,R=18 min;乙腈-水70∶30,3.0 mL/min)。Fr B-3(560 mg)采用正相硅胶柱色谱分离,氯仿-甲醇(15∶1→10∶1)梯度洗脱得到化合物13(3.2 mg)和8(13 mg)。
Fr C(3 g)经反相材料YMC柱色谱加压分离,然后用甲醇-水(40∶60→100∶0)梯度洗脱,得到4个亚组分Fr C-1~C-4。亚组分Fr C-2(1.4 g)通过正相硅胶柱色谱分离,氯仿-甲醇(9∶1→3∶1)梯度洗脱获得化合物7(12 mg)和9(7 mg)。亚组分Fr C-3(600 mg)在硅胶柱分离,氯仿-甲醇(9∶1→3∶1)梯度洗脱后,再经半制备高效液相纯化得到化合物11(20 mg,R=15.5 min;乙腈-水65∶35,3.0 mL /min)、12(30 mg,R=25.5 min;乙腈- 水65∶35,3.0 mL/min)。
Fr D(2 g)经Sephadex LH-20柱氯仿-甲醇(1∶1)分离,TLC检测合并得到2个亚组分Fr D-1和Fr D-2,Fr D-1(1.3 g)采用正相硅胶柱色谱分离,氯仿-甲醇(8∶1→3∶1)梯度洗脱得到化合物1(6.6 mg)、2(19.3 mg)和混合溶液,后者溶剂挥发过程中产生晶体,经过多次溶剂洗涤,重结晶得到化合物18(105 mg)。Fr D-2(200 mg)半制备型高效液相色谱纯化得到化合物16(13 mg,R=16.5 min;乙腈-水43∶67,3.0 mL/min)、17(65 mg,R=20 min;乙腈-水43∶67,3.0 mL/min)。
2.2 体外抗炎活性评价
根据文献报道的方法[7],设置对照组、LPS组、阳性对照DEX组和实验组。将RAW 264.7巨噬细胞以1×105个细胞/mL的密度接种在96孔板中,并在37 ℃、5% CO2培养箱中孵育24 h。DEX和待测化合物1~18以20 μg/mL质量浓度加入到处理好的96孔板中。4 h后,空白对照组加入10 μL培养基,LPS组、DEX组、实验组加入LPS(1.0 μg/mL)孵育22 h,离心5 min,收集细胞上清液。用于测定炎症因子的相关指标:NO、IL-6、IL-1β、TNF-α。通过酶联免疫吸附测定法(ELISA)测定NO介质的释放量和炎症因子(TNF-α、IL-6和IL-1β)的表达量。应用四甲基偶氮唑盐微量酶反应比色法(MTT法)检测化合物在20 μg/mL对RAW 264.7巨噬细胞生长状况的影响。
实验数据采用GraphPad Prism 5.0软件进行统计分析,计量资料用表示,组间比较采用单因素方差分析法;显著性差异用检验来确定。
3 结构鉴定
化合物1:白色粉末,ESI-MS/: 139 [M+H]+,分子式为C7H6O3。1H-NMR (400 MHz, DMSO-d): 9.70 (1H, s, -CHO), 7.26 (1H, d,= 8.0 Hz, H-6), 6.90 (1H, d,= 8.0 Hz, H-5), 6.90 (1H, s, H-2);13C-NMR (125 MHz, DMSO-d): 191.1 (C-7), 152.2 (C-4), 145.9 (C-3), 128.8 (C-6), 124.5 (C-1), 115.5 (C-5), 114.3 (C-2), 以上数据经查阅文献报道[8],鉴定化合物1为原儿茶醛。
化合物2:白色粉末,ESI-MS/: 211 [M+H]+,分子式为C11H14O4。1H-NMR (400 MHz, DMSO-d): 9.21 (1H, s, 4-OH), 7.22 (2H, s, H-2, 6), 3.81 (6H, s, 3, 5-OCH3), 3.22 (2H, m, H-8), 1.07 (3H, t,= 2.3 Hz, H-9);13C-NMR (125 MHz, DMSO-d): 200.1 (C-7), 148.8 (C-3, 5), 141.9 (C-4), 128.3 (C-1), 107.1 (C-2, 6), 57.3 (3, 5-OCH3), 31.9 (C-8), 9.8 (C-9),以上数据经查阅文献报道[9],鉴定化合物2为3,5-二甲氧基-4-羟基苯丙酮。
化合物3:白色粉末,ESI-MS/: 137 [M-H]−,分子式为C8H10O2。1H-NMR (400 MHz, CDCl3): 7.10 (2H, d,= 8.0 Hz, H-2, 6), 6.73 (2H, d,= 8.0 Hz, H-3, 5), 4.25 (2H, s, H-7), 3.45 (3H, s, 8-OCH3);13C-NMR (125 MHz, CDCl3): 156.8 (C-4), 129.3 (C-3, 5), 128.4 (C-1), 115.9 (C-2, 6), 73.5 (C-7), 57.7 (8-OCH3)。以上数据经查阅文献报道[10],鉴定化合物3为4-(乙氧基甲基) 苯酚。
化合物4:白色粉末,ESI-MS/: 263 [M-H]−,分子式为C15H20O4。1H-NMR (400 MHz, CDCl3): 7.61 (1H, d,= 16.0 Hz, H-7), 7.25 (1H, s, H-2), 7.05 (1H, d,= 8.0 Hz, H-5), 6.91 (1H, d,= 8.0 Hz, H-6), 6.28 (1H, d,= 16.0 Hz, H-8), 4.23 (2H, t,= 7.2 Hz, H-10), 3.92 (3H, s, 3-OCH3), 1.70 (2H, m, H-11), 1.36 (4H, m, H-12, 13), 0.88 (3H, t,= 7.2 Hz, H-14);13C-NMR (125 MHz, CDCl3): 167.5 (C=O), 148.1 (C-3), 144.8 (C-4), 143.9 (C-7), 127.2 (C-1), 123.2 (C-6), 115.9 (C-5), 114.5 (C-8), 109.4 (C-2), 60.5 (C-10), 56.1 (3-OCH3), 29.9 (C-11, 12, 13), 14.5 (C-14)。以上数据经查阅文献报道[11],鉴定化合物4为(2)-3-(4-羟基-3-甲氧基苯基)-2-丙烯酸戊酯。
化合物5:白色粉末,ESI-MS/: 501 [M-H]−,分子式为C32H54O4。1H-NMR (400 MHz, CDCl3): 7.53 (1H, d,= 15.6 Hz, H-7), 6.98 (1H, d,= 2.0 Hz, H-2), 6.94 (1H, dd,= 8.0, 2.0 Hz, H-6), 6.83 (1H, d,= 8.0 Hz, H-5), 6.21 (1H, d,= 16.0 Hz, H-8), 5.88 (1H, s, 4-OH), 4.11 (2H, t,= 6.8 Hz, H-1′), 3.82 (3H, s, 3-OCH3), 1.62 (2H, d,= 6.7 Hz, H-2′), 1.17 (38H, m, H-3′~21′), 0.80 (3H, t,= 6.8 Hz, H-22′);13C-NMR (100 MHz, CDCl3): 167.4 (C=O), 147.9 (C-4), 146.8 (C-3), 144.7 (C-7), 127.5 (C-1), 123.8 (C-6), 115.6 (C-8), 114.7 (C-5), 109.3 (C-2), 64.6 (C-1′), 55.8 (3-OCH3), 31.9 (C-2′), 22.7~29.7 (C-3′~21′), 14.1 (C-22′),以上数据经查阅文献报道[12],鉴定化合物5为反式-阿魏酸二十二烷基酯。
化合物6:白色粉末,ESI-MS/: 473 [M-H]−,分子式为C30H50O4。1H-NMR (400 MHz, CDCl3): 7.70 (1H, d,= 14.0 Hz, H-7), 7.03 (1H, d,= 2.0 Hz, H-2), 7.04 (1H, dd,= 8.0, 2.0 Hz, H-6), 6.95 (1H, d,= 8.0 Hz, H-5), 6.72 (1H, d, J=14.0 Hz, H-8), 5.79 (1H, s, 4-OH), 4.06 (2H, t,= 8.0 Hz, H-1'), 3.56 (3H, s, 3-OCH3), 1.70 (2H, m, H-2′), 1.19 (34H, m, H-3′~19′), 0.88 (3H, m, H-20′);13C-NMR (100 MHz, CDCl3): 161.9 (C=O), 142.1 (C-4), 141.1 (C-3), 138.8 (C-7), 122.5 (C-1), 120.8 (C-6), 112.1 (C-5), 109.5 (C-8), 108.0 (C-2), 59.7 (C-1′), 58.3 (3-OCH3), 22.1~29.9 (C-3′~19′), 14.5 (C-20′),以上数据经查阅文献报道[13],鉴定化合物6为反式-阿魏酸二十烷基酯。
化合物7:白色粉末,ESI-MS/: 223 [M-H]−,分子式为C12H14O4。1H-NMR (400 MHz, CDCl3): 7.61 (1H, d,= 16.0 Hz, H-7), 7.25 (1H, s, H-2), 7.05 (1H, d,= 8.0 Hz, H-5), 6.91 (1H, d,= 8.0 Hz, H-6), 6.28 (1H, d,= 16.0 Hz, H-8), 4.23 (2H, q,= 7.2 Hz, H-10), 3.92 (3H, s, 3-OCH3), 1.34 (3H, t,= 7.2 Hz, H-11);13C-NMR (150 MHz, CDCl3): 167.5 (C=O), 148.1 (C-3), 146.8 (C-4), 144.9 (C-7), 127.2 (C-1), 123.2 (C-6), 115.8 (C-5), 114.8 (C-8), 109.8 (C-2), 60.5 (C-10), 56.1 (3-OCH3), 14.4 (C-11)。以上数据经查阅文献[14],鉴定化合物7为4-羟基-3-甲氧基肉桂酸乙酯。
化合物8:白色粉末,ESI-MS/: 151 [M-H]−,分子式为C9H12O2。1H-NMR (400 MHz, CDCl3): 7.78 (1H, t,= 8.0 Hz, H-5), 7.21 (1H, d,= 8.0 Hz, H-4), 6.81 (1H, d,= 8.0 Hz, H-6), 6.80 (1H, s, H-2), 4.37 (2H, m, H-8), 3.43 (2H, m, H-7), 3.36 (3H, s, 8-OCH3);13C-NMR (100 MHz, CDCl3): 155.4 (C-3), 139.0 (C-1), 130.1 (C-4), 129.6 (C-6), 115.2 (C-2, 5), 74.4 (C-8), 57.7 (8-OCH3), 50.8 (C-7)。以上经查阅文献报道[15],鉴定化合物8为对3-(2-甲氧基乙基)苯酚。
化合物9:白色粉末,ESI-MS/: 177 [M-H]−,分子式为C10H10O3。1H-NMR (400 MHz, DMSO-d): 9.66 (1H, d,= 8.0 Hz, H-9), 7.42 (1H, d,= 16.0 Hz, H-7), 7.26 (1H, d,= 1.6 Hz, H-2), 7.07 (1H, dd,= 8.4, 1.2 Hz, H-6), 6.96 (1H, d,= 8.4 Hz, H-5), 6.62 (1H, d,= 16.0 Hz, H-8), 3.95 (3H, s, 3-OCH3);13C-NMR (125 MHz, DMSO-d): 193.8 (C=O), 153.2 (C-7), 149.1 (C-3), 147.1 (C-4), 126.8 (C-1), 126.6 (C-8), 124.2 (C-6), 115.1 (C-5), 109.6 (C-2), 56.2 (3-OCH3),以上数据经查阅文献报道[16],鉴定化合物9为反式松柏醛。
化合物10:白色粉末,ESI-MS/: 123 [M-H]−,分子式为C7H8O2。1H-NMR (400 MHz, DMSO-6): 9.37 (1H, s, 1-OH), 7.08 (2H, d,= 8.4 Hz, H-2, 6), 6.70 (2H, d,= 8.4 Hz, H-3, 5), 3.36 (3H, s, 4-OCH3);13C-NMR (100 MHz, DMSO-d): 156.8 (C-4), 129.8 (C-2, 6), 128.4 (C-1), 115.9 (C-3, 5), 57.7 (1-OCH3),以上数据经查阅文献报道[17],鉴定化合物10为对甲氧基苯酚。
化合物11:淡黄色油状物,ESI-MS/: 209 [M+H]+,分子式为C12H16O3。1H-NMR (400 MHz, CDCl3): 6.83 (1H, s, H-6), 6.68 (1H, d,= 11.6 Hz, H-1′), 6.50 (1H, s, H-3), 5.80 (1H, dd,= 11.6, 6.8 Hz, H-2′), 3.88 (3H, s, 2-OCH3), 3.83 (3H, s, 4-OCH3), 3.80 (3H, s, 5-OCH3), 1.84 (3H, d,= 6.8 Hz, H-3′);13C-NMR (100 MHz, CDCl3): 150.7 (C-4), 148.5 (C-2), 142.4 (C-1), 125.8 (C-1′), 124.8 (C-2′), 118.1 (C-5), 114.1 (C-6), 97.5 (C-3), 56.6 (2-OCH3), 56.4 (4-OCH3), 56.1 (5-OCH3), 14.5 (C-3′)。以上数据经查阅文献报道[18],鉴定化合物11为β-细辛醚。
化合物12:淡黄色油状物,ESI-MS/: 209 [M+H]+,分子式为C12H16O3。1H-NMR (400 MHz, CDCl3): 6.93 (1H, s, H-6), 6.71 (1H, d,= 16.0 Hz, H-1′), 6.50 (1H, s, H-3), 6.10 (1H, dd,= 6.6, 16.0 Hz, H-2′), 3.88 (3H, s, 2-OCH3), 3.85 (3H, s, 4-OCH3), 3.81 (3H, s, 5-OCH3), 1.89 (3H, d,= 6.6 Hz, H-3′);13C-NMR (100 MHz, CDCl3): 150.6 (C-4), 148.7 (C-2), 143.4 (C-1), 125.0 (C-1′), 124.4 (C-2′), 118.9 (C-5), 109.7 (C-6), 97.9 (C-3), 56.7 (2-OCH3), 56.4 (4-OCH3), 56.1 (5-OCH3), 18.8 (C-3′)。以上数据经查阅文献报道[19],鉴定化合物12为α-细辛醚。
化合物13:淡黄色油状物,ESI-MS/: 279 [M+H]+,分子式为C17H26O3,1H NMR (400 MHz, CDCl3): 6.33 (1H, d,= 2.4 Hz, H-9), 5.14 (1H, dd,=2.4, 6.1 Hz, H-2), 2.90 (1H, dd,= 2.4, 18.6 Hz, H-10a), 2.86 (1H, dd,= 6.1, 18.6 Hz, H-10b), 2.55 (2H, s, H-6), 2.22 (1H, ddd,= 6.5, 8.9, 14.6 Hz, H-3), 2.02 (3H, s, COCH3), 1.76 (3H, s, H-14), 1.06 (3H, d,= 6.2 Hz, H-12), 1.00 (3H, d,= 6.2 Hz, H-13), 0.89 (3H, d,= 7.1 Hz, H-15);13C-NMR (100 MHz, CDCl3): 200.4 (C-7), 170.6 (C=O), 144.2 (C-9), 135.1 (C-8), 76.4 (C-2), 60.1 (C-1), 47.6 (C-5), 46.5 (C-6), 39.8 (C-3), 39.4 (C-10), 39.1 (C-4), 25.4 (C-11), 21.4 (C-12, 13), 18.1 (C-15), 15.7 (C-14)。以上数据经查阅文献报道[20],鉴定化合物13为2-乙酰基-菖蒲烯酮。
化合物14:白色粉末,ESI-MS/: 151 [M-H]−,分子式为C7H6O3。1H-NMR (400 MHz, CDCl3): 7.95 (2H, d,= 8.8 Hz, H-3, 5), 6.86 (2H, d,= 8.0 Hz, H-2, 6);13C-NMR (150 MHz, CDCl3): 167.1 (COOH), 159.9 (C-4), 132.1 (C-2, 6), 122.9 (C-1), 115.4 (C-3, 5),以上数据经查阅文献报道[21-22],鉴定化合物14为对羟基苯甲酸。
化合物15:无色透明油状物,ESI-MS/: 303 [M+H]+,分子式为C20H30O2,主要碎片峰分别为267 [M-O2H4+H]+, 233 [M-C5H10+H]+, 155 [M-C11H16+H]+, 151 [M-C9H12O2+H]+,数据与文献基本一致[23-24]。1H-NMR (400 MHz, CDCl3): 5.30~5.50 (10H, m, H-5, 6, 8, 9, 11, 12, 14, 15, 17, 18), 2.79 (8H, m, H-7, 10, 13, 16), 2.10 (2H, m, H-19), 1.90 (2H, t,= 2.4 Hz, H-2);13C-NMR (125 MHz, CDCl3): 168.1 (C-1), 127.1~131.9 (C-5, 6, 8, 9, 11, 12, 14, 15, 17, 18), 29.3~31.5 (C-7, 10, 13, 16), 25.6~27.1 (C-2, 3, 4, 19), 14.1 (C-20)。以上数据经查阅文献报道[25],鉴定化合物15为5,8,11,14,17-二十碳五烯酸。
化合物16:白色粉末,[α]20 D–13.33 (0.06, MeOH),ESI-MS/: 417 [M-H]−,分子式为C22H26O8。1H-NMR (400 MHz, DMSO-6): 6.60 (4H, s, H-2, 6, 2′, 6′), 4.62 (2H, d,= 2.0 Hz, H-7, 7′), 4.17 (4H, m, H-9, 9′), 3.76 (12H, s, 3, 5, 3′, 5′-OCH3), 3.06 (2H, m, H-8, 8′);13C-NMR (125 MHz, DMSO-6): 147.9 (C-3, 5, 3′, 5′), 134.8 (C-4, 4′), 131.5 (C-1, 1′), 103.6 (C-2, 6, 2′, 6′), 85.6 (C-7, 7′), 71.1 (C-9, 9′), 56.0 (3, 5, 3′, 5′-OCH3), 53.7 (C-8, 8′)。以上数据经查阅文献报道[26],鉴定化合物16为(−)-丁香树脂。
化合物17:白色粉末,[α]20 D–9.40 (0.10, MeOH),ESI-MS/: 357 [M-H]−,分子式为C20H22O6。1H-NMR (400 MHz, DMSO-6): 6.60~6.86 (6H, m, H-2, 5, 6, 2′, 5′, 6′), 4.74 (2H, d,= 3.6 Hz, H-7, 7′), 4.07 (4H, m, H-9, 9′), 3.73 (6H, s, 3, 3′-OCH3), 3.01 (2H, m, H-8, 8′);13C-NMR (150 MHz, DMSO-6): 147.5 (C-3, 3′), 145.9 (C-4, 4′), 131.5 (C-1, 1′), 118.6 (C-2, 2′), 115.1 (C-5, 5′), 110.4 (C-6, 6′), 85.2 (C-7, 7′), 71.0 (C-9, 9′), 55.6 (3, 3′-OCH3), 53.6 (C-8, 8′)。以上数据经查阅文献报道[27],鉴定化合物17为(−)-松脂醇。
化合物18:白色粉末, ESI-MS/: 577 [M+H]+,分子式为C35H60O6。1H-NMR (400 MHz, CDCl3): 5.34 (1H, d,= 4.8 Hz, H-6), 4.42 (1H, m, H-3), 4.22 (1H,= 10.5 Hz, Glu H-1′), 3.09~4.20 (5H, m, Glu H-2′~6′), 0.77~0.99 (12H, m, 4×CH3), 0.65 (3H, d,= 4.2 Hz, CH3);13C-NMR (100 MHz, CDCl3): 140.4 (C-5), 121.2 (C-6), 100.8 (C-1′), 78.7 (C-3), 76.9 (C-3′), 76.7 (C-5′), 73.5 (C-2′), 70.1 (C-4′), 61.1 (C-6′), 56.2 (C-14), 55.1 (C-17), 49.6 (C-9), 45.1 (C-24), 41.8 (C-13), 40.1 (C-12), 38.3 (C-4), 36.9 (C-1), 36.6 (C-10), 35.5 (C-20), 33.3 (C-22), 31.4 (C-7), 31.3 (C-8), 29.3 (C-2), 28.7 (C-25), 27.8 (C-16), 25.4 (C-23), 23.9 (C-15), 22.6 (C-28), 20.6 (C-11), 19.7 (C-27), 19.1 (C-19), 18.9 (C-26), 18.6 (C-21), 11.7 (C-29), 11.5 (C-18)。以上数据通过与文献报道[28]比对,鉴定化合物18为胡萝卜苷。
4 抗炎活性筛选
通过检测单体化合物1~18对LPS诱导的RAW 264.7巨噬细胞中炎症因子(IL-6、IL-1β、TNF-α)的分泌以及NO的释放来评价其抗炎活性,结果见图1。DEX为阳性对照组,对照组只有RAW 264.7巨噬细胞没有添加LPS,细胞存活率测试结果表明,化合物在20 μg/mL质量浓度及不添加LPS情况下,均对RAW264.7巨噬细胞的生长状况没有任何影响。但是在RAW264.7巨噬细胞中添加LPS后,与对照组相比,IL-6、IL-1β、TNF-α炎症因子的含量,NO的产生显著增加(<0.05)。与LPS组相比较,大多数化合物在20 μg/mL质量浓度时能明显地减少炎症因子IL-6、IL-1β、TNF-α的分泌,抑制NO的产生(<0.05)。与DEX组相比较,除化合物4~6外,其他化合物在20 μg/mL下能较好的抑制NO的释放;此外,与阳性对照组(DXM组)相比,化合物1~16、18对炎症因子IL-6呈现了更好的抑制效果。同样的,在20 μg/mL质量浓度下,化合物1~4、6~10、11~16、18对炎症因子IL-1β展现了更好的抑制率,在相同质量浓度下,化合物1、2、8、14、15也能较好地抑制TNF-α的分泌。
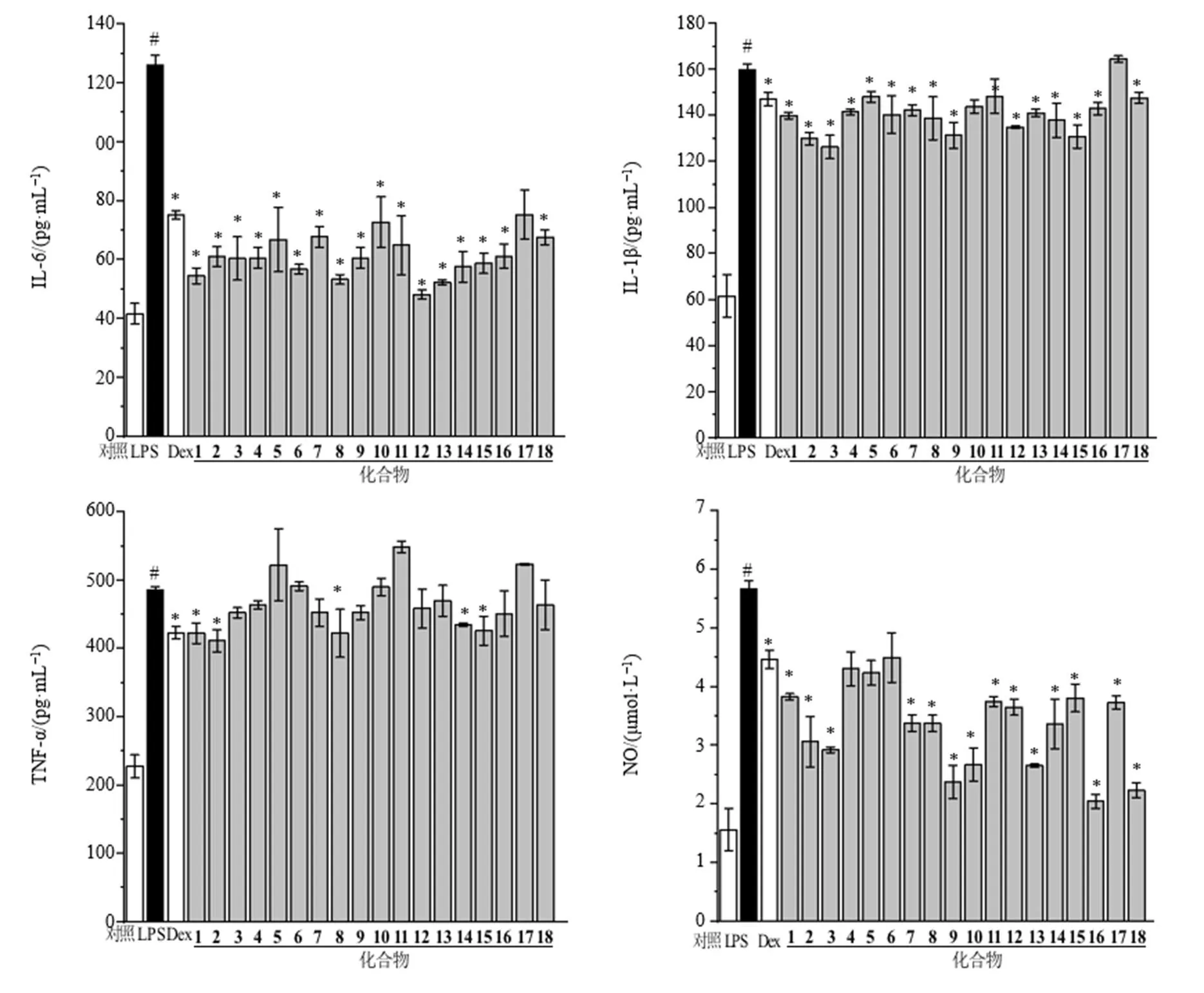
与对照组比较#P<0.05;与LPS组比较∗P<0.05
5 讨论
本实验对石菖蒲干燥根茎的醋酸乙酯部位进行化学成分研究,从中分离并鉴定了18个化合物,包括9个苯丙素类、4个酚类、2个木脂素类、1个倍半萜、1个甾体及1个其他类型化合物,其中化合物2~9为首次从该属中分离得到。体外抗炎活性表明,大多数化合物在20 μg/mL时明显地减少了LPS诱导的RAW264.7巨噬细胞中炎症因子(IL-6、IL-1β、TNF-α)的分泌和NO介质的含量(<0.05)。与阳性对照药相比较,部分化合物能显著降低LPS诱导的RAW 264.7细胞中炎症因子(IL-6、IL-1β、TNF-α)的表达,抑制NO的合成,具有较好体外抗炎作用。
综上所述,本实验丰富了石菖蒲根茎化合物化学和药理活性的研究,实验结果进一步验证了石菖蒲根茎的传统应用,阐释了其发挥抗炎活性的物质基础,为该著名中药材的未来开发应用提供一定的理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 94.
[2] 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1979: 9.
[3] 卢成淑, 冯宁, 南国, 等. 石菖蒲及其活性成分防治阿尔茨海默病的研究进展 [J]. 中草药, 2016, 47(7): 1236-1242.
[4] 石坚宏, 姬丽婷, 骆启晗, 等. 石菖蒲化学成分、药理作用及质量标志物预测分析研究进展 [J]. 中成药, 2021, 43(5): 1286-1290.
[5] 陈凤. 石菖蒲正丁醇部位化学成分研究 [D]. 武汉: 中南民族大学, 2016.
[6] 卢圆圆. 石菖蒲化学成分及药理活性研究 [D]. 武汉: 华中科技大学, 2016.
[7] Yang M L, Wang Y D, Patel G,.andanti-inflammatory effects of different extracts fromthrough down-regulation of NF-κB and MAPK signaling pathways [J]., 2020, 261: 113105.
[8] 粟杰, 冯艳, 林炳锋, 等. 刺五加化学成分的分离与鉴定 [J]. 中草药, 2021, 52(16): 4783-4788.
[9] 刘量, 王委, 殷启蒙, 等. 细叶石仙桃乙酸乙酯部位化学成分的分离与鉴定 [J]. 扬州大学学报: 自然科学版, 2015, 18(4): 53-56.
[10] Taguchi H, Yosioka I, Yamasaki K,. Studies on the constituents ofblume [J]., 1981, 29(1): 55-62.
[11] 李宝泉, 李念光, 冯锋, 等. 阿魏酸酯类衍生物的合成及抗血小板聚集活性 [J]. 中国药科大学学报, 2009, 40(6): 486-490.
[12] 林锦锋, 张朝凤, 张勉, 等. 大黄橐吾的化学成分研究 [J]. 中国中药杂志, 2005, 30(24): 1927-1929.
[13] 马晓莉, 林文彬, 张国林. 野桂花化学成分研究 [J]. 天然产物研究与开发, 2009, 21(4): 593-599.
[14] 周惠燕, 章辉, 李士敏. 竹叶化学成分研究Ⅰ [J]. 中国中药杂志, 2005, 30(24): 1933-1934.
[15] Kitamura T, Imagawa T, Kawanisi M. Photochemical reactions of allylphenoxide anions [J]., 1978, 34(23): 3451-3457.
[16] 李静娟, 任福才, 胡江苗, 等. 大苞鞘石斛化学成分及细胞毒活性研究 [J]. 中草药, 2020, 51(7): 1819-1824.
[17] 吕旭辉, 李振麟, 刘书霞, 等. 石崖茶的化学成分研究(Ⅱ) [J]. 中草药, 2018, 49(6): 1272-1276.
[18] Lee J Y, Lee J Y, Yun B S,. Antifungal activity of beta-asarone from rhizomes of[J]., 2004, 52(4): 776-780.
[19] Patra A, Mitra A K. Constituents of: Structure of acoramone. carbon-13 NMR spectra of- and-asarone [J]., 1981, 44(6): 668-669.
[20] Nawamaki K, Kuroyanagi M. Sesquiterpenoids fromas germination inhibitors [J]., 1996, 43(6): 1175-1182.
[21] Yang J, Gu D Y, Ji Z N,. Comprehensive separation of major compositions fromvar.by counter-current chromatography using a liquid-liquid extraction strategy [J]., 2018, 124: 363-368.
[22] 万仲贤, 吴建国, 吴飞, 等. 白花鬼针草化学成分研究[J]. 世界中医药, 2020, 15(10): 1391-1394.
[23] VanRollins M. Synthesis and characterization of cytochrome P-450 epoxygenase metabolites of eicosapentaenoic acid [J]., 1990, 25(8): 481-490.
[24] Cui P H, Duke R K, Tattam B N,. Monoepoxy octadecadienoates and monoepoxy octadecatrienoates 2: Mass spectral characterization [J]., 2008, 152(2): 65-70.
[25] Vatèle J M, Doan H D, Chardigny J M,. Synthesis of methyl (5, 8, 11, 14, 17)-eicosapentaenoate and methyl (4, 7, 10, 13, 16, 19)-docosahexaenoate [J]., 1994, 74(2): 185-193.
[26] 黄孝春, 郭跃伟, 王峥涛, 周文亮, 左建平. 苍白秤钩风中木脂素类化学成分的研究 [J]. 天然产物研究与开发, 2002, 14(4): 9-12.
[27] 王慧, 邹坤, 吴军. 十雄角果木树皮的化学成分研究 [J]. 华中师范大学学报: 自然科学版, 2013, 47(6): 794-796.
[28] 李小辉, 袁名睿, 陆雪萍, 等. 麦冬的化学成分研究[J]. 中草药, 2021, 52(13): 3804-3809.
Chemical constituents from rhizoma ofits anti-inflammatory activity
QIU Lu-ya1, 4, YANG Gang1, 4, JIN Qiong4, LUO Xiao-dong4, LIU Ya-ping3, 4, WANG Yi-fen1, 2
1. School of Traditional Chinese Medicine, Yunnan University of Chinese Medicine, Kunming 650500, China 2. Kunming Institute of Zoology, Chinese Academy of Sciences, Kunming 650201, China 3. Faculty of Food Science and Engineering, Kunming University of Science and Technology, Kunming 650500, China 4. State Key Laboratory of Phytochemistry and Plant Resources in West China, Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China
To study the chemical compositions and their anti-inflammatory activities from the dried rhizoma of.The ethyl acetate layer ofwas phytochemically investigated by multiple step chromatography techniques, such as silica gel, YMC, Sephadex LH-20 gel and other column chromatography techniques. The structures of these isolates were unambiguously elucidated by means of extensive spectroscopic and comparison with corresponding data of the reported literature. All the isolated compounds were evaluated for their anti-inflammatory effects via detecting inflammatory mediator releases (IL-6、IL-1β、TNF-α) and NO medium level in RAW 264.7 macrophage cells induced by lipopolysaccharide (LPS).A total of 18 compounds, isolated from ethyl acetate layer of, were identified as protocatechualdehyde (1), 3,5-dimethoxy-4-hydroxypropiophenone (2), 4-(ethoxymethyl) phenol (3), pentyl (2)-3-(4-hydroxy-3-methoxyphenyl)-2- propenoate (4),-ferulic acid docosyl ester (5),-ferulic acid eicosyl ester (6), 4-hydroxy-3-methoxy cinnamic acid ethyl ester (7), 3-(2-methoxyethyl)phenol (8),-coniferyl aldehyde (9), 4-methoxyphenol (10), β-asarone (11), α-asarone (12), 2-acetoxyacorenone (13),-hydroxybenzoic acid (14), 5,8,11,14,17-eicosapentaenoic acid (15), (-)-syringaresinol (16), (-)-pinoresinol (17) and daucosterol (18).Among all the isolates, compounds 2—9 are isolated fromspecies for the first time. Furthermore, compounds 1—4, 6—12, 14—16 could remarkably inhibited the secretion of inflammatory mediators (IL-6、IL-1β、TNF-α) and NO medium level in LPS-stimulated RAW 264.7 macrophages cells at the concentration of 20 μg/mL, comparable to DXM used as the positive control. All the results suggested thatpossessed the anti-inflammatory activity.+
Schott; anti-inflammatory activity; LPS induction; inflammatory factors; 3,5-dimethoxy-4-hydroxy- propiophenone; 4-(ethoxymethyl) phenol;-coniferyl aldehyde
R284.1
A
0253 - 2670(2022)15 - 4617 - 08
10.7501/j.issn.0253-2670.2022.15.004
2022-02-28
国家自然科学基金资助项目(31872676);云南省应用基础研究面上项目(202101AT070436)
邱路雅(1997—),女,在读硕士,专业方向为中药质量控制与评价。E-mail: 1229093782@qq.com
通信作者:王易芬,博士,副研究员,研究方向为植物化学与物质资源。E-mail: wangyifen@mail.kiz.ac.cn
刘亚平,博士,副教授,研究方向为植物化学与物质资源。E-mail: liuyaping@kust.edu.cn
[责任编辑 王文倩]