多酸基共价有机骨架材料的合成与氧化脱硫性能研究在实验教学中的设计与探究
刘世超,李雅宁,詹宇璇,王晓红,邹小勤
东北师范大学化学学院,长春 130024
1 引言
综合化学实验在整个化学基础实验中占有非常重要的地位。传统综合化学实验多为各个实验的简单拼接,知识体系连贯性差,多数反应耗时较长,在有限的教学时间内无法满足综合实验教学的要求,不适用于新时代化学人才的培养。本实验立足于无机化学实验,涵盖物理化学、材料化学、分析化学与有机化学的知识点,将最新的科研热点多酸基共价有机骨架材料引入实验教学中。
共价有机骨架(COF)是一类新型的基于共价键连接的晶态有机多孔聚合物,兼具分子筛的稳定性和金属有机框架的可设计性[1]。多酸(Polyoxometalates,POM),是一类金属氧簇化合物,广泛应用于氧化催化中[2]。本实验通过界面法合成了EB-COF材料,通过离子交换将POMs引入到EB-COF中,得到多酸基COF复合材料,并对其进行结构表征与催化脱硫实验,实现了燃油深度脱硫。
本实验涉及界面合成、溶液合成、离子交换、重结晶、氧化催化操作以及红外光谱、X射线衍射、气相色谱等仪器分析操作,通过氧气氧化脱硫实验来验证POM@EB-COF的氧化催化性能。实验操作简单、易控制、反应条件温和绿色、每步实验现象明显,可通过现象变化来直观验证实验的成败,可明显激发学生的实验热情。本实验融合了无机化学、物理化学、材料化学和分析化学等多门基础化学课程内容,适合不同阶段的学生学习;实验中各模块一体化强,又具有可拆分性,为实验教学课的灵活安排提供了保障。
2 实验部分
2.1 实验原理
2.1.1 多酸PMo4V8的合成
如图1所示,多酸PMo4V8是由不同种类的无机含氧酸根,包括钼酸根、磷酸根、偏钒酸根,在一定pH下酸化缩合而成的。

图1 多酸PMo4V8的合成示意图
2.1.2 界面法合成EB-COF
本实验采用界面法合成EB-COF,反应过程中溴化乙锭(EB)与三醛基间苯三酚(TP)在85 °C下通过席夫碱反应缩合形成EB-COF。如图2所示,水中的EB单体与邻二氯苯中的TP单体在各自溶液中扩散至界面,然后在界面处发生反应,形成EB-COF,为薄膜状材料。

图2 界面法合成EB-COF示意图
2.1.3 PMo4V8@EB-COF催化剂的制备
EB-COF的理论孔径为1.66 nm[3],而POM阴离子的直径约为1 nm[4],保证POM可以进入到EBCOF孔道中(图3)。EB-COF的阳离子骨架也为实现离子交换提供了良好的平台,因此通过简单的离子交换可以将多酸阴离子引入阳离子共价有机骨架中,得到的多酸基共价有机骨架材料兼具二者特点,具有优异的氧化还原性能、可调的亲疏水性、可循环利用性等。
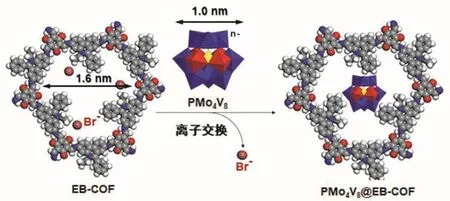
图3 离子交换法制备PMo4V8@EB-COF催化剂的示意图
2.1.4 氧化法脱除模拟燃油中的二苯并噻吩(DBT)
在PMo4V8@EB-COF氧化DBT时,首先利用EB-COF的疏水性吸附非极性DBT,利用PMo4V8的氧化活性中心,通过电子转移-氧转移机理,PMo4V8中的VV首先被还原成VIV,同时DBT被氧化成相应的砜。被还原的PMo4V7VIV在氧气中被氧化成PMo4V8V,形成一个氧化还原循环(图4)。同时产生的极性产物砜被复合催化剂排斥脱附。
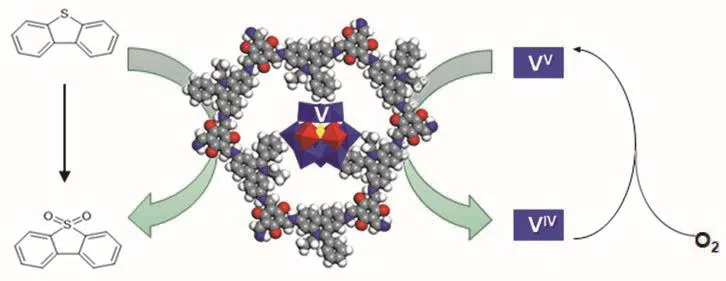
图4 DBT氧化机理的示意图
2.2 试剂或材料
实验中所用的试剂及材料列于表1中。
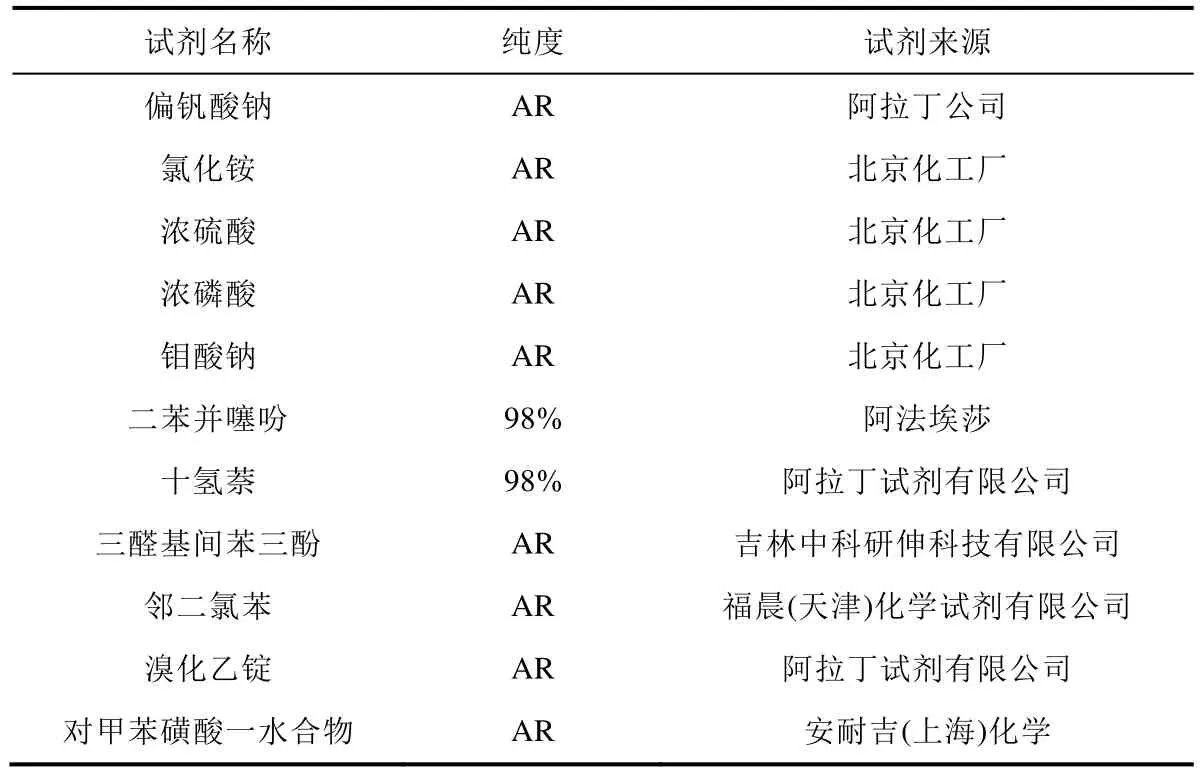
表1 实验所用主要化学试剂
2.3 仪器和表征方法
本实验使用的仪器列于表2中。

表2 实验中所用主要仪器设备
2.4 实验步骤/方法
2.4.1 沉淀法合成(NH4)5H6PMo4V8O40
将0.030 mol (3.66 g)偏钒酸钠溶解于19 mL沸水中,另将0.017 mol (4.11 g)钼酸钠溶解于6 mL水中;待两种固体均完全溶解后,将偏钒酸钠溶液加入到钼酸钠溶液中形成混合液。将2 mL 85% H3PO4溶于5 mL水中,逐滴加入到上述混合液中,立刻形成红棕色溶液,升温至95 °C,并在该温度下搅拌1 h。最后,将得到的液体冷却至室温,转移到饱和氯化铵溶液(75 mL),搅拌2 h沉淀完全,减压过滤得到棕色固体,所得沉淀物在0.25 mol·L-130 mL H2SO4中进行重结晶两次,得到约4 g(NH4)5H6PMo4V8O40,产率80% (和钼酸钠相比),共3.5 h。
2.4.2 界面法合成EB-COF
将0.10 mmol (20 mg)的三醛基间苯三酚(TP)溶于20 mL邻二氯苯中,形成TP溶液。将0.15 mol(59 mg)溴化乙锭(EB)和0.30 mmol (57 mg)对甲苯磺酸(PTSA)溶于20 mL水,形成EB+PTSA溶液。取20 mL TP溶液置于耐压瓶中作为底层,在TP溶液表面缓慢铺上一层20 mL去离子水。最后,在水溶液中缓慢加入20 mL EB + PTSA混合液,在无扰动下,将耐压瓶置于烘箱中,85 °C静置反应6 h。反应结束后在界面层形成了EB-COF,将溶液过滤,收集EB-COF,并用去离子水洗涤,得到约60 mg EB-COF,产率75% (和TP相比),共6.5 h。
2.4.3 复合催化剂PMo4V8@EB-COF的制备
将50 mg EB-COF和126 mg (NH4)5H6PMo4V8O40分散于5 mL去离子水中,在100 °C回流条件下搅拌3 h,减压过滤产物。并用去离子水2次清洗未反应的多酸,干燥后得到约50 mg红色固体,即PMo4V8@EB-COF,共4 h。
2.4.4 模拟燃油催化氧化
在室温下,将二苯并噻吩(DBT)溶于十氢萘中制成硫含量为500 mg·L-1的溶液,以此作为模拟燃油。模拟燃油催化氧化实验是在三颈瓶中进行的。首先,在三颈瓶中加入100 mL含有DBT的模拟燃油和100 mg PMo4V8@EB-COF催化剂,水浴加热至100 °C,500 rpm下搅拌,然后将氧气通入到反应液中。反应2.5 h,每隔30 min取一次样品,过滤头过滤反应液,分离液通过气相色谱检测反应后溶液中的DBT浓度,计算DBT氧化转化率,共3 h。
3 结果与讨论
3.1 催化剂的结构表征
3.1.1 元素分析
利用扫描电子显微镜中的扫描电镜能谱(EDX)、电感耦合等离子体原子发射光谱(ICP-AES)、元素分析仪(CHN)等方法对PMo4V8@EB-COF所含元素进行分析。图5是EDX元素分析结果,通过对比图5a和图5b可知,P、Mo、V存在于PMo4V8@EB-COF材料中,且该材料中Br元素的含量很低,说明多酸离子已经成功与卤素离子进行了离子交换。为进一步证明多酸成功负载在阳离子共价有机骨架上,对PMo4V8@EB-COF材料进行ICP-AES测试,ICP-AES分析结果列于表3。从表3中可知,该材料中存在V与Mo元素,含量分别为3.760% (w)和1.770% (w)。根据两种元素含量,计算出多酸的掺杂量约为15.190% (w)。CHN元素分析结果列于表4,相比于EB-COF,PMo4V8@EB-COF的C与N元素含量降低,证明PMo4V8@EB-COF材料中含有重元素,进一步表明多酸分子被成功引入阳离子共价有机骨架中。
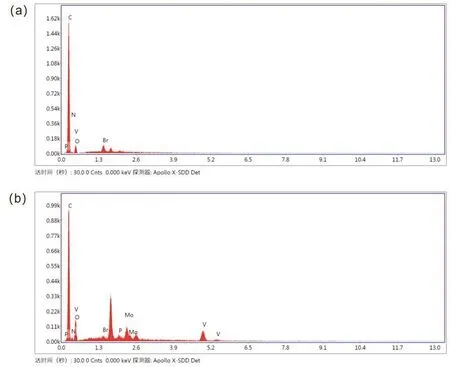
图5 EB-COF (a)与PMo4V8@EB-COF (b)的EDX能谱图

表3 PMo4V8@EB-COF材料的ICP测试结果
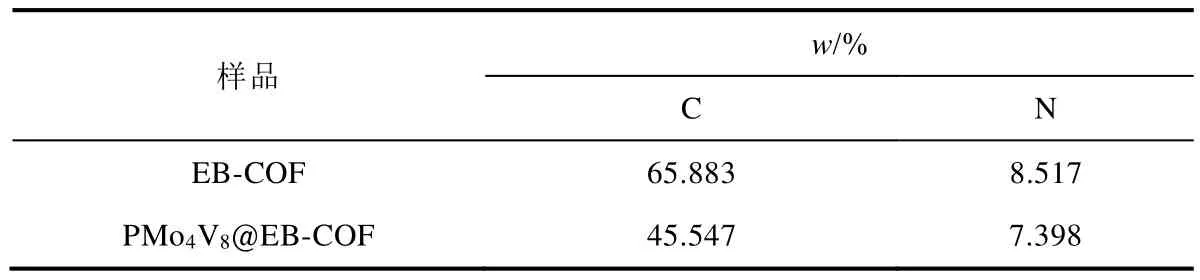
表4 EB-COF与PMo4V8@EB-COF材料中C、N元素含量
3.1.2 红外光谱
图6是TP、EB、PMo4V8、EB-COF、PMo4V8@EB-COF的红外光谱图。从图6a中可知,在EB-COF中,C=O (1650 cm-1)、H―C=O (2890 cm-1)和N―H (3310 cm-1、3190 cm-1)的振动吸收峰消失,说明TP与EB反应生成了EB-COF。在PMo4V8中,700–1100 cm-1范围内出现了Keggin阴离子特征峰。
从图6a中可以看出,由于POM的负载量较低,PMo4V8@EB-COF的红外光谱图与EB-COF相似,但在400–1500 cm-1,仍然可以观察到PMo4V8的4个特征吸收峰(图6b),表明PMo4V8成功引入到EBCOF孔道中。与单一PMo4V8相比,PMo4V8@EB-COF的4个特征吸收峰向低波数移动,可能是由于多酸阴离子与阳离子共价有机骨架之间的相互作用,EB-COF的多苯环结构增加了电子离域,改变了PMo4V8的电子云密度,从而影响了P―O、Mo―O、V―O的振动频率。
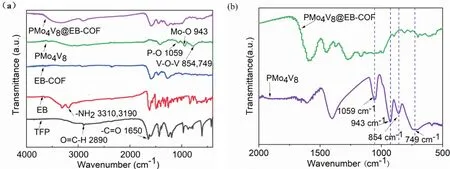
图6 TP、EB、EB-COF、PMo4V8、PMo4V8@EB-COF的红外光谱图
3.1.3 X射线粉末衍射
利用X射线粉末衍射(PXRD)对PMo4V8、EB-COF、PMo4V8@EB-COF进行表征,所得测试谱图如图7所示。从图中可以看出,合成的PMo4V8在7°–10°、17°–20°、26°–30°、31°–35°出现较强的衍射峰,与Keggin型多酸的特征峰相符,说明具有Keggin型结构的多酸PMo4V8被成功合成。合成的EB-COF在3.3°处有一个特征衍射峰,在27°存在较宽的衍射峰,说明合成的EB-COF具有二维晶态结构。

图7 PMo4V8、EB-COF、PMo4V8@EB-COF的PXRD谱图
结合元素分析、红外谱图和X射线衍射谱图,证明了通过离子交换将Keggin结构的多酸PMo4V8成功负载在EB-COF上,合成了PMo4V8@EB-COF复合材料。
3.2 模拟燃油催化氧化实验
在三颈瓶反应器中加入100 mL含有500 mg·L-1DBT的模拟燃油和100 mg PMo4V8@EB-COF催化剂,形成混合液在转速为500 rpm的搅拌条件下水浴加热至100 °C,然后将氧气通入到反应液中。在不同反应时间(0、0.5、1.5、2.0、2.5 h)取1 mL反应液并用过滤头过滤,反应液通过气相色谱检测模拟燃油中DBT浓度。从图8可以看出,随着反应时间的延长,DBT氧化程度不断提高,2.5 h达到96.6%,DBT含量为17 mg·L-1。氧化后的十氢萘热过滤回收催化剂。催化剂采用紫外光谱与红外光谱检测其稳定性(图9),反应前后PMo4V8@EB-COF的振动吸收峰位置不变,表明PMo4V8@EB-COF具有良好的稳定性。反应后PMo4V8@EB-COF十氢萘溶液中并未检测到溶出的PMo4V8紫外吸收峰,表明在反应中活性组分PMo4V8未从EB-COF孔中脱出。同时,十氢萘溶液静置1 h后可以观察到有砜的白色晶体析出,说明极性的砜被疏水性的PMo4V8@EB-COF排斥而脱离催化剂表面、析出晶体,易于分离而制备超低硫含量的清洁油。
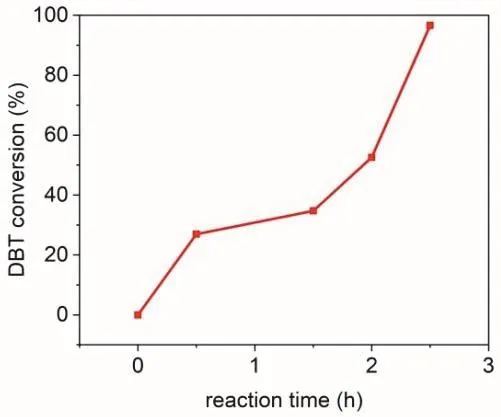
图8 PMo4V8@EB-COF催化剂在不同反应时间内对DBT的转化率

图9 (a) PMo4V8@EB-COF反应前(黑色)和反应后(红色)的红外光谱图;(b) 同量的PMo4V8溶液(红色)与反应后分离出PMo4V8@EB-COF后的溶液(黑色)的紫外光谱图
4 课时安排
课时安排列于表5中。

表5 本实验的建议课时安排方案
本实验各个模块既可单独成课,亦可整体教学,可以适应不同学生的实验学习需求,具有良好的普适性。教师可根据学生的实际需要、学校的基础设施等实际情况,自行选择授课内容并加以调整和安排。
5 结语
本实验使用简捷方法实现了EB-COF的合成,利用离子交换法将EB-COF材料与PMo4V8进行复合,制备了一种新型催化材料PMo4V8@EB-COF。将PMo4V8@EB-COF作为催化剂进行燃油脱硫催化氧化实验,以氧气为氧化剂、催化剂用量为100 mg、十氢萘为模拟燃油(含有500 mg·L-1DBT的十氢萘溶液100 mL)、反应温度为100 °C、反应时间为2.5 h,DBT的转化率达96.6%。实验中各模块一体化强,又具有可拆分性,为实验教学的灵活安排提供了保障。

