蛋白质中总巯基的测定及标记
张保新,范卓,于晨昕,刘喆,沈永雯,惠新平,房建国
兰州大学化学化工学院,化学国家级实验教学示范中心,兰州 730000
1 引言
蛋白质巯基(半胱氨酸残基)在维持蛋白质的结构和功能方面发挥着重要作用。半胱氨酸残基在蛋白质结构中具有独特的反应活性和空间排布,其不同的还原态和氧化态形式(如蛋白巯基、蛋白邻二巯基和蛋白二硫键等)直接影响着生物体的氧化还原稳态。生物氧化还原平衡对抵御癌症、神经退行性疾病、心脑血管疾病具有重要意义[1],所以蛋白巯基含量的测定一直是科研工作者研究关注的重点。目前,已有成熟的方法用于蛋白质中的巯基检测,比如Ellman方法。与此同时,荧光成像技术因具有灵敏度高、操作简单和生物兼容性好等优点,使得荧光探针在生物医学等领域的应用得到不断的发展。利用小分子荧光探针特异性检测蛋白巯基,不仅能够丰富蛋白巯基检测的工具和方法,而且能够推动生命科学的发展,具有重要的理论和实用意义,也是当前科研领域的研究热点之一[2–5]。
2 实验目的
(1) 测定牛血清白蛋白中巯基含量,掌握生物硫醇测定原理及实验操作;
(2) 以蛋白质巯基检测为例,了解生物大分子化学修饰的原理及应用;
(3) 复习巩固化学生物学理论知识,掌握常见化学生物学实验操作。
3 实验部分
3.1 实验原理
3.1.1 Ellman法检测巯基的基本原理
5,5’-二硫代双(2-硝基苯甲酸) [5,5’-Dithiobis-(2-Nitrobenzoic Acid),DTNB],又被称为Ellman试剂(图1),当与巯基发生巯基-二硫键的交换反应后被还原为2-硝基-5-巯基苯甲酸(2-Nitro-5-Mercaptobenzoic Acid,TNB)。TNB在偏碱性的条件下(pH ≈ 8)显黄色且在412 nm下有很强吸收。实验通过测定TNB的吸光度即可测定巯基含量[6]。

图1 DTNB与巯基反应原理
3.1.2 Naph-EA-Mal荧光探针标记巯基蛋白的基本原理
蛋白标记是在生理条件下(常温常压,水相,中性)利用高效的生物兼容性化学反应实现对蛋白质的化学修饰。蛋白标记通过引入额外的“标签”可以实现蛋白的可视化,进而方便对其后续功能的研究。此外,蛋白标记也可以在体外模拟蛋白质的翻译后修饰(Post-Translational Modification,PTM)等生物过程。
本实验利用Naph-EA-Mal探针分子(图2,其制备可参见文献[7],也可用其他具有相同作用机制的硫醇探针替代)实现对牛血清白蛋白(BSA)的标记。Naph-EA-Mal分子利用马来酰亚胺基团作为荧光淬灭基团,在蛋白标记前,分子本身的背景荧光很弱。当Naph-EA-Mal与BSA的巯基发生Michael加成反应后,马来酰亚胺的双键被破坏,荧光淬灭效果消失,探针释放出荧光(图2)。Naph-EA-Mal与巯基发生的Michael加成反应转化率高、反应速率快,因而很容易在生理条件下实现对蛋白中巯基的快速选择性标记[7]。

图2 Naph-EA-Mal探针分子与蛋白巯基的反应示意图
3.1.3 Naph-EA-Mal荧光探针对活细胞内巯基的荧光成像
探针技术是化学生物学研究中的一种不可缺少的关键手段,探针常被用于对生物体系内物质的检测、示踪及生物大分子的标记研究中。本实验以Naph-EA-Mal分子与巯基快速高效反应后可释放出绿色荧光为例(如3.1.2中所述)解释了活细胞成像的相关原理。此外,该探针分子相对分子质量较小,具有较高的亲脂性,推测其具有很好的细胞膜通透性,故Naph-EA-Mal探针分子非常适合细胞内硫醇的可视化检测(图3)。

图3 Naph-EA-Mal细胞成像作用示意图
3.2 实验试剂与仪器
3.2.1 实验试剂
本实验所用主要试剂见表1。

表1 实验所用试剂
3.2.2 实验仪器
本实验所用主要仪器见表2。

表2 实验所用主要仪器
3.2.3 实验溶液配制
(1) 三羟甲基氨基甲烷盐酸盐缓冲溶液(Tris-HCl)配制(50 mmol·L-1,pH = 7.4):将605.7 mg的Tris溶解于50 mL三蒸水中,用浓盐酸调节pH至7.4,之后稀释至100 mL,混合均匀4 °C保存备用。
(2) 三羟甲基氨基甲烷与乙二胺四乙酸配制的缓冲溶液(TE)配制(pH = 7.4,50 mmol·L-1Tris-HCl,1 mmol·L-1EDTA):将605.7 mg的Tris溶解于50 mL三蒸水中,用浓盐酸调节pH至7.4,稀释至100 mL,加入29.2 mg的EDTA,溶解后混合均匀4 °C保存。
(3) 等渗磷酸缓冲盐溶液(PBS)溶液配制(pH = 7.4):称取8.0 g NaCl,0.2 g KCl,2.7 g NaHPO4·7H2O,0.24 g KH2PO4加入到1 L的储液瓶中,用三蒸水定容至1 L,混合均匀灭菌备用。
(4) BSA蛋白配制(50 mg·mL-1):取500 mg BSA蛋白溶于10 mL的TE缓冲液中,得到50 mg·mL-1的BSA的TE溶液,混合均匀后4 °C保存备用。
(5) DTT溶液配制(100 mmol·L-1):将154 mg DTT溶于10 mL三蒸水中,混合均匀后4 °C保存备用。
(6) 盐酸胍溶液(6 mol·L-1):将28.6 g盐酸胍溶于50 mL Tris-HCl (50 mmol·L-1,pH = 8.0)中,室温保存备用。
(7) DTNB溶液配制(5 mmol·L-1):将98.8 mg的DTNB溶于5 mL无水乙醇中得到50 mmol·L-1DTNB的乙醇溶液,之后取1 mL 50 mmol·L-1DTNB加入到10 mL的6 mol·L-1盐酸胍溶液中,混合均匀后4 °C保存备用。
(8) 考马斯亮蓝溶液配制:取20 mg G-250加入10 mL 95% EtOH和20 mL 85%磷酸溶解,之后用三蒸水稀释至200 mL,搅拌30 min,用滤纸过滤后常温避光保存备用。
(9) SDS溶液配制(10%):将10 g SDS溶于三蒸水中,定容至100 mL备用。
(10) Naph-EA-Mal配制(100 mmol·L-1):将39.1 mg Naph-EA-Mal溶于1 mL的DMSO中,混合均匀备用。
(11) 上样缓冲溶液(loading buffer)配制:将1.25 mL Tris-HCl (1 mol·L-1,pH = 6.8),5 mL甘油,2 mL 20% SDS,1.2 mL DTT (1 mol·L-1),15 mg 溴酚蓝混合在一起并搅拌均匀,低温保存备用。
3.3 实验步骤
3.3.1 标准工作曲线的绘制
(1) Cys标准曲线的绘制:配制1 mmol·L-1Cys的TE (50 mmol·L-1Tris,1 mmol·L-1EDTA,pH 7.4)缓冲溶液作为储备液,用TE稀释配制0 、20、40、80、120、160 、200 μmol·L-1溶液各1 mL;在96孔板中依次加入180 μL的DTNB (5 mmol·L-1,乙醇作为溶剂)、10 μL不同浓度的Cys溶液,37 °C避光孵育5 min,测量412 nm处的吸光度A412,每个标准样品平行测试两次,绘制标准工作曲线。
(2) BSA标准曲线的绘制:配制10 mg·mL-1BSA的TE缓冲溶液作为储备液,用TE稀释配制0、0.01、0.02、0.04、0.06、0.08、0.10 mg·mL-1溶液各1 mL;在96孔板中依次加入200 μL考马斯亮蓝溶液、10 μL不同浓度的BSA溶液、37 °C避光孵育5 min、测量595 nm处的吸光度A595。每个标准样品平行测试两次,绘制标准工作曲线。
3.3.2 Ellman法测量BSA巯基含量
(1) SephadexG-25凝胶层析柱的准备:首先,取适量Sephadex G-25 (~10 mL,提前准备)加入有垫片的分离柱中,装柱高度约5–6 cm,小心敲打层析柱壁除去气泡,之后用15倍柱体积的TE缓冲溶液平衡凝胶柱,平衡结束后备用。
(2) 蛋白试验:首先,将8个1.5 mL Eppendorf (EP)管分成4组并标号待用(每组两个),在第1、3组EP管中加入150 μL TE溶液,第2、4组EP管中加入150 μL盐酸胍(6 mol·L-1,50 mmol·L-1pH = 8.0 Tris-HCl作为溶剂)溶液;其次,在4组EP管中分别加入50 μL BSA蛋白(50 mg·mL-1,TE缓冲液作为溶剂)并吹打均匀,在37 °C下孵育30 min,期间不断。之后在第1、4组EP管中加入20 μL三蒸水,第2、3组EP管加入20 μL DTT溶液(100 mmol·L-1,三蒸水作为溶剂),用移液器吹打均匀后在37 °C条件下孵育30 min,期间不断。孵育结束后,取出准备好的G25凝胶柱,将孵育好的第2、3、4组蛋白上样,使其自然流下,用1.5 mL的EP管收集流出液。待上样液体几乎流干后,加入TE缓冲液进行洗脱(每次洗脱体积为200 μL),用1.5 mL的EP管收集流出液,每管收集约200 μL流出液。期间从每个EP管吸取10 μL流出液加入96孔板中,加入90 μL考马斯亮蓝进行检测,若颜色变蓝则有蛋白流出;同时,利用DTNB检测BSA蛋白与DTT是否完全分离。全部检测完毕后,将收集的蛋白合并,记录总体积V。最后,计算最大合并蛋白体积,将第1、2、3、4组蛋白样品均用TE稀释至该最大体积并从中各取20 μL加入96孔板,在每孔样品中加入180 μL的DTNB溶液,同时,取20 μL TE溶液,加入180 μL DTNB溶液作为空白对照,37 °C避光孵育5 min,测量412 nm处的吸光度A412,对比1、2、3、4组样品所测的A412,定量分析巯基含量。
3.3.3 Naph-EA-Mal荧光探针蛋白巯基标记实验
(1) SDS-聚丙烯酰胺凝胶电泳(SDS-Polyacrylamide Gel Electrophoresis,SDS-PAGE)实验仪器组装(根据实验时间,SDS-PAGE凝胶的制备可由预备实验室老师提前准备):每组取一套电泳装置,正确装配后放置于带胶垫的底座上待用。取15 mL分离胶储液,向其中加入30 μL TEMED,30 μL 10%的AP溶液,加毕后立刻搅拌均匀,之后用移液器小心将胶液加入玻璃夹板之间,两侧加至相同高度。加毕后,更换枪头,小心慢速均匀地加入无水乙醇,盖在胶液上方。乙醇加毕后,将装置端平,小心移动至37 °C恒温箱中,恒温避光孵育,待胶凝固后小心倾倒出乙醇,用滤纸条小心吸干残留乙醇。之后准备好定型上样槽的梳子两片,取10 mL浓缩胶储液,向其中加入40 μL TEMED,60 μL 10%的AP溶液,加毕后立刻搅拌均匀,之后用移液器小心地将胶液加入玻璃夹板之间,两侧均加至与凹型玻璃板相同高度,将梳子光面朝向方形板插入溶胶中,梳子凸出的部分正好卡在凹型板处。最后将装置端平,小心移动至37 °C恒温箱中,恒温避光孵育,待胶凝固后备用。
(2) 蛋白标记实验:首先,将8个EP管分成4组标号待用(每组2个),在每个EP管中加入200 μL BSA的Tris-HCl溶液(4 mg·mL-1)。将第1、2组蛋白在4 °C保存,第3组的每份蛋白中加入20 μL 10%的SDS溶液,第4组的每份蛋白加入20 μL Tris-HCl缓冲溶液,用移液器吸打均匀后,向第1、2组蛋白中各加入100 μL DTT (100 mmol·L-1)溶液,吹打均匀后,37 °C孵育30 min,期间不断震荡。孵育完成后,将第3、4组蛋白取出,加入1 mL预冷的丙酮(-20 °C),正反倒置3–5次使其混合均匀,于-20 °C中静置30 min。取出后用离心机离心并用移液器小心吸出丙酮,之后向蛋白固体中加入200 μL的Tris-HCl缓冲溶液复溶蛋白。蛋白复溶后取出1、2组蛋白,向1、2、3、4组蛋白中均加入20 μL 10%的SDS溶液,用移液器吸打均匀。将4组蛋白样品各取50 μL至8个新的EP管并编号(与前面保持一致),在2、3、4组中各加入5 μL 10 mmol·L-1Naph-EA-Mal的DMSO溶液,向1组中加入5 μL DMSO,吸打均匀后37 °C孵育10 min,期间不断震荡。孵育完毕后,向每份蛋白中加入20 μL上样缓冲,吸打均匀后,干式恒温器上100 °C恒温10 min,加热完毕后待其降至室温,组装电泳槽,加入电泳缓冲液并上样,最后进行电泳实验。当溴酚蓝跑至胶长度80%左右时停止电泳,拆下玻璃板,取出凝胶,利用凝胶成像仪进行凝胶成像并进行荧光强度分析;成像完毕后,用考马斯亮蓝对凝胶进行染色、脱色后将考马斯亮蓝染色结果扫描成像。
3.3.4 Naph-EA-Mal荧光探针对活细胞的荧光成像实验
首先,将装有HeLa细胞的六孔板从CO2培养箱中取出(本部分实验培养好的细胞由预备实验室提前准备,有条件的学校也可以让学生自己培养细胞),在光学显微镜下观察细胞的形态,确定每孔细胞状态良好,数量适中。其次,选取第1、2号孔为第1组(Control组),第3、4号孔为第2组(实验组),第5、6号孔为第3组(实验组) (图4);向第1、2、3、4号孔中加入20 μL等渗磷酸缓冲(PBS),向5、6号孔中加入20 μLN-乙基马来酰亚胺(NEM,10 mmol·L-1,三蒸水作为溶剂)进行巯基封闭。加完后盖上盖子,摇晃均匀后,放回CO2培养箱中继续孵育30 min,孵育结束后向1、2号孔中加入2 μL DMSO,向3、4、5、6号孔中加入2 μL Naph-EA-Mal (1 mmol·L-1)的DMSO溶液,盖上盖子,摇晃均匀后,再次放回CO2培养箱孵育5 min。孵育结束后用移液器将孔中培养基吸出,每孔沿壁加入1 mL PBS溶液进行洗涤(洗涤3次),洗涤结束后每孔加入1 mL PBS,将六孔板放置在倒置荧光显微镜上,调好焦距和亮度后,进行成像拍照。
图4 六孔板示意图
4 结果与讨论
4.1 Ellman法定量测定蛋白中巯基的含量
Ellman法的产物TNB需在弱碱性缓冲体系中才具有较强吸收,同时DTNB在高pH条件下不稳定,所以反应体系的pH控制在7.4–8.0之间较为合适。Ellman法定量测定蛋白巯基个数可以通过建立标准曲线的方法来进行(本实验),也可以采用已知的TNB摩尔消光系数(ε(412 nm) = 14150 mol·L-1·cm-1)数据有误,已核实[8]进行浓度换算。本实验测量如表3所示,表明理论值与实验值相符。该实验结果表明:1) Ellman法可以实现对蛋白质巯基的定量测定;2) 蛋白质三维结构对其所含基团反应活性影响很大。
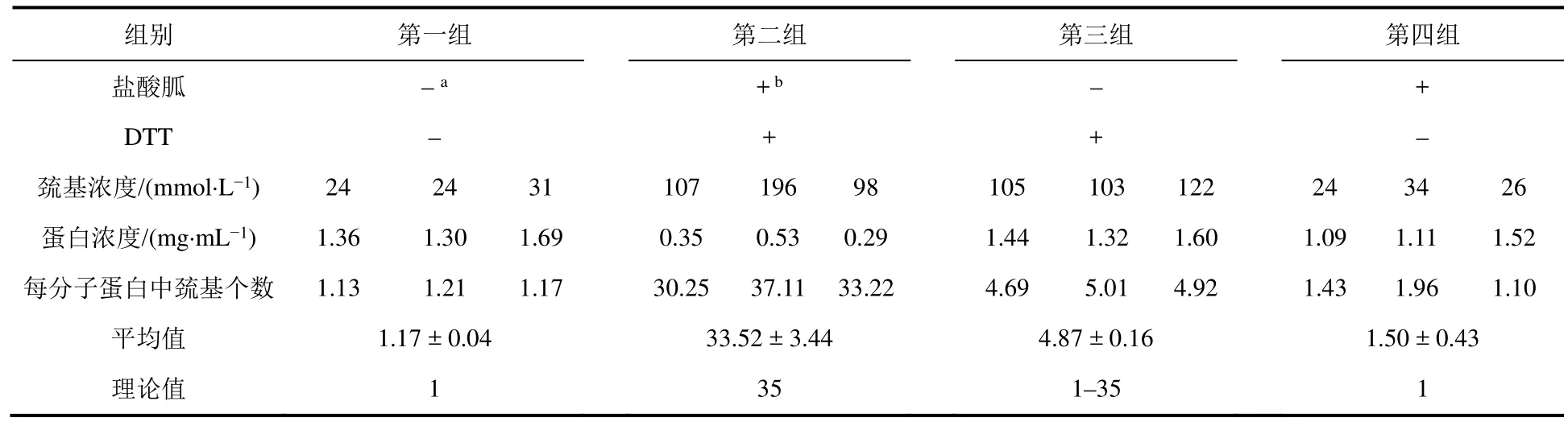
表3 Ellman法定量测定蛋白中巯基的含量结果
本部分实验操作需要注意以下几点:1) 准备Sephadex G-25凝胶柱时需要尽可能除去柱内气泡,否则会影响分离效果;2) 蛋白样品需一次全部上样,样品上样体积要求不超过凝胶体积的10%;3) 本实验使用EP管收集蛋白流出液,对EP管要清晰编号,不可混淆。
4.2 Naph-EA-Mal荧光探针蛋白巯基标记实验
本实验中,1号样品是纯BSA,作为空白对照无荧光;2号样品未经变性还原,理论上只有一个裸露的巯基,荧光强度较弱;3号样品经过变性还原,条带的荧光强度最强;4号样品未变性只进行还原,荧光强度介于2号与3号样品之间,具体实验结果如图5所示。该实验结果表明:1) Naph-EAMal荧光探针可以实现BSA蛋白巯基的标记;2) 蛋白质三维结构对其所含基团反应活性影响很大。

图5 Naph-EA-Mal法标记BSA蛋白巯基实验结果
本部分实验操作需要注意以下几点:1) 利用10% SDS变性蛋白时切勿使用移液器剧烈吹打溶液,吸打溶液时勿将枪中的液体打尽,应缓慢吸打,最后一次打出溶液时将枪头提到液面以上,沿壁打尽,防止起泡;2) 加入预冷的丙酮沉淀蛋白时,切勿剧烈混合,正反倒置几次混匀即可,丙酮沉淀之后离心时间不宜过长,否则会增加蛋白复溶难度。离心结束后尽可能小心吸尽丙酮,不可将蛋白吸走;3) 加完上样缓冲后在干式恒温器上100 °C加热时,需在EP管上压一个冰盒,防止喷溅。
4.3 Naph-EA-Mal荧光探针对活细胞的荧光成像实验
利用荧光探针进行细胞成像实验时要尽可能把加入的探针分子和NEM分散均匀,所以在细胞培养板中加入不同试剂后,应立即轻摇培养板。根据实验设计,本实验预期实验结果是Control组和加入NEM预孵育的实验组在绿光通道中均无荧光,仅有实验组的细胞呈现荧光。具体实验结果如图6所示,结果显示除实验组细胞呈现绿色荧光外,在加入NEM预孵育的实验组细胞也有微弱的荧光,这可能是NEM没有彻底封闭细胞内的巯基物种所致。这样,当探针Naph-EA-Mal进入细胞时,仍然会有少量的反应,产生微弱的荧光。该实验结果表明:1) Naph-EA-Mal荧光探针可实现细胞内巯基的原位检测;2) Naph-EA-Mal荧光探针可实现细胞内巯基的荧光标记。

图6 活细胞荧光成像实验结果
本部分实验操作需要注意以下几点:1) Naph-EA-Mal探针分子尽量避免反复冻融,长时间放置会导致部分探针分解;2) 细胞荧光拍照之前利用PBS多次洗涤,要确保无干扰背景。
5 教学建议
实验时间建议为12 h,学生3–4人一组,合理分工协作,实验内容可交叉进行(表4)。基于该实验,我们还开发了虚拟仿真实验平台(链接网址:http://www.ilab-x.com/details/v5?id=3828&isView=true),可供参考。

表4 实验学时安排表
6 结语
本实验是一个内容前沿、角度新颖、模块多样的化学生物学实验。我们将三个连续的模块实验:1) 蛋白质巯基检测、2) 蛋白巯基标记及凝胶电泳、3) 活细胞内硫醇荧光成像,合理规划在12个学时的实验教程中,不同学校可以根据本校实验条件、教学要求、课时数等合理安排实验相关内容。该实验以BSA中巯基的检测为具体操作对象,将生物大分子与小分子的分离(有机溶剂沉淀、凝胶排阻色谱以及SDS-PAGE)、变性及非变性条件下生物大分子的化学修饰、细胞培养以及活细胞成像等化学生物学基本操作融入到教学当中,可以让学生在实验中巩固复习化学生物学基本知识,了解前沿科学的热点,感受科学研究的过程,进而激发学生对科研的兴趣。
7 创新性
(1) 本实验内容前沿,实验内容是基于实验指导教师课题组的科研成果,是科教融合和学科融合的结果。
(2) 本实验模块多样化,在实验的设计安排中有多种选择和多种延伸,不同高校基于自身实验条件可以选择不同的模块开设。
(3) 培养学生多角度考虑问题的能力,通过本实验的开展,学生可以更好地从化学的角度理解生命过程中的问题。

