Ce0.75Zr0.25O2的制备及其催化净化汽车尾气
青雯玥,陈起游,贾阿龙,李珊珊,赵明,郭彩红
四川大学化学学院,成都 610065
1 引言
1.1 环境保护前沿技术引入实验教学实现科教融合
环境保护是我国的基本国策,习近平总书记在2018年全国生态环境保护大会上强调,“生态文明建设是关系中华民族永续发展的根本大计”。然而我国环境保护面临的形势依然严峻。科学技术的发展有力推动了环保进程,其中燃烧、催化转化等化学方法可实现对大气污染的有效治理[1]。在本科实验中引入环保类的实验项目,有益于学生学习环保知识,提升环保意识,增强社会责任感,对作为未来国家建设者的大学生是十分必要的。
我国是稀土资源大国,储量4400万吨,居世界第一。稀土广泛应用于国防军工、航空航天、石油化工、环境保护等领域,素有“现代工业维生素”的美誉[2]。提升稀土资源的利用率和降低环境污染是我国稀土可持续发展的战略方向。CeO2基稀土氧化物是汽车尾气净化催化剂的关键材料。在本科实验中引入稀土类氧化物的制备及其在环境保护方面的应用,有利于学生掌握稀土的化学性质,了解稀土资源在我国的战略地位,增强民族自豪感。
传统化学实验常“照单抓药”,仅注重“三基培养”,创新性不足,依据《化学类专业本科教学质量国家标准》[3]的人才培养目标,大学化学实验课程按照“重视基础、趋向前沿、反映现代、综合交叉”的新理念建设,科教融合、创新发展是新趋势,引入前沿科技成果及其新兴热门技术的相关理论和技能,拓宽实验内容,有益于激发学生的学习兴趣,强化学生发现问题、分析问题和解决问题的能力。本实验紧紧围绕培养目标的适应度,通过整体设计,以期满足专业特色发展和多样化人才培养的需求。
1.2 拟选用的实验项目及背景情况
我国大气污染治理形势严峻,尤其是近年来,随着经济飞速发展,机动车尾气成为城市大气污染主要来源之一,据生态环境部发布的《中国移动源环境管理年报2020》[4]统计,2019年全国机动车排放的一氧化碳(CO)、碳氢化合物(HC)、氮氧化物(NOx)、颗粒物(PM)污染物排放总量为1603.8万吨[5],严重危害生态环境和身体健康。
三效催化剂(TWCs)是催化转化汽车尾气污染物最有效的手段,可同时将三种主要污染物(HC、CO、NOx)转化为无毒无害的H2O、CO2和N2。稀土Ce元素具有独特的电子结构(4f15d16s2),其氧化物可以在两种价态Ce3+(Ce2O3)和Ce4+(CeO2)之间可逆转变,实现储放氧,缓冲氧气浓度的波动,适应汽车复杂的行驶工况,广泛地应用于TWCs[6]。由于ZrO2掺杂的CexZr(1-x)O2材料相比纯CeO2具有更优异的性能,从1995年开始CexZr(1-x)O2材料逐渐取代CeO2[5]。当前发展趋势表明[7–10],精细控制制备条件可显著改善材料的性能。共沉淀法具有操作简单、工艺过程易于控制、经济可行便于商业化的优点,是目前制备CexZr(1-x)O2材料普遍采用的方法。
我校自主研发了系列CeO2基氧化物材料,成功用于汽车尾气催化净化且产业化,打破了国际垄断,获得了省科技进步一等奖两项。本实验依托上述科研成果将国内最先进的前沿科技引入本科实验中,紧密联系社会热点环保问题,对传统化学实验内容进行补充和发展,并培养学生综合分析问题、解决问题、实验研究的能力和关注前沿科学进展的意识。
1.3 解决问题的方法与思路
虽然这一科研成果已成功产业化,技术较为成熟,但是将其引入本科实验仍存在以下问题:
(1) 反应网络复杂:需同时转化三种污染物,涉及氧化、还原、水汽变换、蒸汽重整等7个反应;同时,催化剂使用贵金属成本较高。
(2) 沉淀剂非环境友好:沉淀剂原来使用的氨水-碳铵缓冲溶液具有强烈刺激性气味。
(3) 制备条件过于严格:为得到良好的性能,科研实验中制备条件非常精细,如pH为8.5–8.8;操作繁琐,如需水浴陈化6 h和添加表面活性剂。
为了解决上述问题,将已有技术成果转化为本科实验项目,拟采取如下思路与方法:
(1) 选取典型反应:从原有7个复杂的反应中,选择最具典型性的碳氢化合物(HC)、一氧化碳(CO)氧化反应进行性能评价,有利于本科学生的理解和掌握。
(2) 筛选沉淀剂:引入无毒无味环境友好型的碳酸钠沉淀剂,替代传统具有强烈刺激性气味的氨水-碳铵缓冲溶液。
(3) 优化制备条件:在保证优异催化性能的同时,拓宽pH范围,缩短水浴陈化时间和去除加入表面活性剂操作,使其更适合本科教学。
2 实验部分
2.1 实验原理
2.1.1 铈锆氧化物的制备
采用硝酸亚铈(Ce(NO3)3·6H2O)为原料,以双氧水(H2O2)为氧化剂,将无色Ce3+氧化为橙红色的Ce4+。采用硝酸(HNO3)将不溶于水的碳酸氧锆(ZrOCO3)溶解为Zr(NO3)4水溶液。

本实验使用恒流泵,将硝酸锆和硝酸铈的混合溶液与碱溶液以并流方式加入三颈烧瓶中进行沉淀。为得到均匀稳定的铈锆沉淀物,需将体系pH控制在8–10,以确保两种离子同时沉淀。
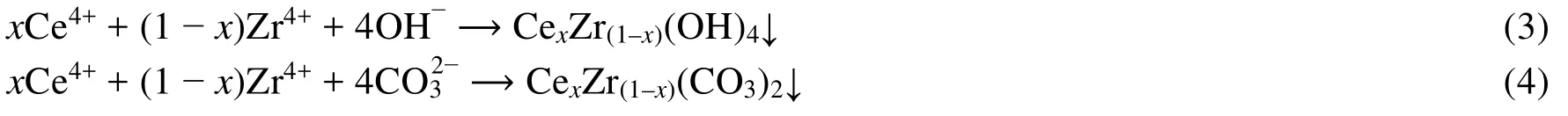
铈锆沉淀物经400 °C焙烧分解,锆离子进入氧化铈的晶格而形成固溶体,转化为具有汽车尾气净化性能的铈锆氧化物。

2.1.2 铈锆氧化物催化性能
CexZr(1–x)O2能同时将HC、CO、NO等转化为H2O、CO2和N2,同时发生以下7个反应,涉及氧化、还原、氧化还原等多个反应类型。
氧化:

还原:

氧化还原:

为了让学生理解方便,本实验中重点关注在催化剂上发生的HC和CO氧化反应。模拟汽车尾气浓度(HC:0.033% (体积分数);CO:0.5%),在实验室自主研发的固定床反应器上进行催化性能评价,得到不同温度污染物转化率。在具有相同流速及催化剂的情况下,为了排除内扩散、传热影响,选取转化率低于20%进行活化能计算。低转化率随温度变化近乎线性,可得出直线的斜率即为反应速度常数。利用Arrhenius方程计算反应活化能。

反应转化率计算如下:
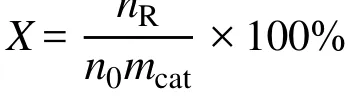
X:反应转化率;n0:初始气体量;nR:反应后剩余气体量;mcat:催化剂质量。
活化能计算如下:
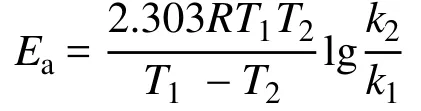
Ea:活化能;T1:起始温度;T2:终止温度;k:温度T时的反应速率常数;R:摩尔气体常数,R= 8.314 J·mol-1·K-1。
2.2 试剂和仪器
硝酸亚铈(工业纯),碳酸氧锆(工业纯),硝酸(68%,分析纯),过氧化氢(30%,分析纯),碳酸铵(分析纯),碳酸钠(分析纯),氨水(17%),一氧化碳(0.5%),丙烯(体积分数0.033%)。
分析天平(上海精密科学仪器有限公司),集热式恒温加热搅拌器(巩义予华仪器责任有限公司),循环水真空泵(巩义予华仪器责任有限公司),电热鼓风干燥箱(中仪国科(北京)科技有限公司),固定床催化反应评价装置(实验室自制),马弗炉(成都兴天宇实验仪器设备有限公司),粉末X射线衍射(日本理学株式会社),Autosorb SI型全自动比表面-孔径分析仪(美国康塔仪器公司),热分析仪(STA 449F3,德国耐驰仪器制造有限公司),气相色谱(福立分析仪器有限公司)。
2.3 实验步骤/方法
2.3.1 铈锆氧化物的制备
铈锆氧化物的制备流程如图1所示。

图1 CexZr(1-x)O2制备流程
(1) 硝酸铈、碳酸氧锆的溶解。
称取18.04 g硝酸亚铈于250 mL烧杯中,加入100 mL蒸馏水,用玻璃棒不断搅拌5 min,使全部溶解。量取4.15 mL H2O2(体积分数30%),缓慢加入烧杯中。
称取5.75 g碳酸氧锆于150 mL烧杯中,量取1.73 mL浓硝酸(质量分数68%)加入其中,在恒温水浴里(温度控制在60–80 °C)用玻璃棒不断搅拌,不再有气泡产生时,加入50 mL蒸馏水,搅拌均匀。
将上述烧杯中的两种溶液混合均匀,得Ce-Zr盐溶液,备用。
(2) 共沉淀法制备CexZr(1–x)O2固溶体。
将500 mL三颈烧瓶置于60 °C恒温水浴里,开启磁力搅拌,将150 mL Ce-Zr盐溶液以14 mL·min-1与0.1 mol·L-1碳酸钠溶液以6 mL·min-1的流速加入三颈烧瓶中进行共沉淀,通过加入沉淀剂的量控制其pH。反应完成后,继续搅拌10 min以保证沉淀完全。
(3) 沉淀物的干燥和焙烧。
沉淀物冷至室温后减压过滤,用100 mL蒸馏水洗涤沉淀2–3次,抽滤至干。将滤饼放入烘箱(温度控制在120 °C),干燥30 min后取出,再置于马弗炉(升温至400 °C)中焙烧1 h,得到粉末状CexZr(1-x)O2氧化物。
2.3.2 催化性能测试
催化性能评价采用实验室自主研发的固定床反应器评价,如图2所示。

图2 催化剂活性测定装置
称取CexZr(1-x)O2材料1.0 g均匀装入反应管中部(催化剂层两端用玻璃丝装填),将反应管装入管式炉,催化剂置于反应管中部(恒温区)。
调节载气N2流速至稳定于146 mL·min-1,测量过程中应控制载气流量稳定。各气体组分流速:HC 2 mL·min-1;CO 5 mL·min-1。
程序升温,以10 °C·min-1的速度升温至400 °C。每10 °C读取并记录一次数据,实验结束后选取250、280、300、350、400 °C的实验数据,并计算转化率和活化能。
气体产物采用气相色谱(福立GC9720)进行分析,氮气作载气,固定相TDX-01,TCD检测器,柱箱温度80 °C。
3 结果与讨论
3.1 沉淀剂的类型
文献[11]是以有刺激性气味的NH3·H2O-(NH4)2CO3缓冲溶液作沉淀剂,为了开发环境友好的沉淀剂,本实验采用了碳酸钠、氢氧化钠作为沉淀剂进行对照实验。结果表明(图3a),Na2CO3作为沉淀剂时,不仅满足无毒无味的环境友好性质,且对CO、HC的转化率可达72%和95%,性能最佳。
样品的X射线衍射(XRD)结果如图3b所示,根据三个样品特征衍射峰的位置,可知不同沉淀剂均制得了相同晶型的铈锆固溶体,故Na2CO3可以取代NH3·H2O-(NH4)2CO3缓冲溶液作为沉淀剂。选择的Na2CO3沉淀剂,廉价易得无污染。改进后的方法安全无刺激性气味,更适合本科教学。
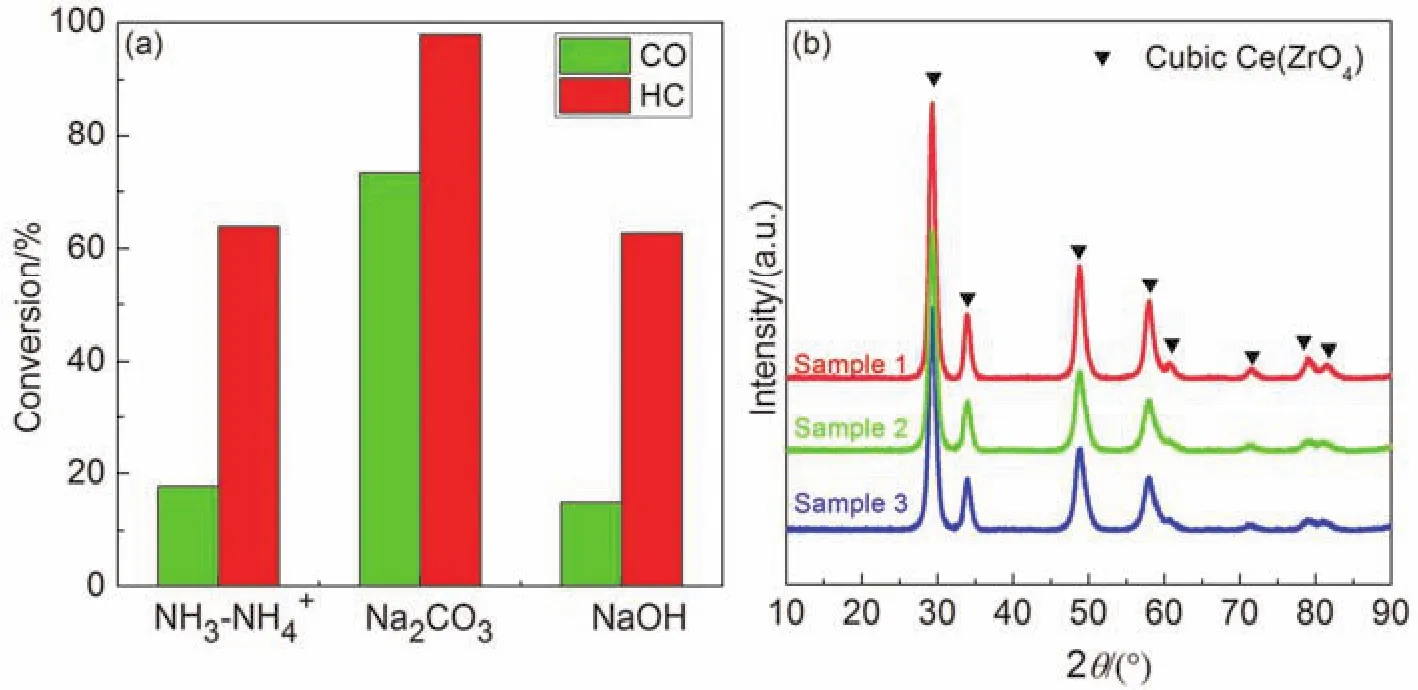
图3 (a) 不同催化剂对CO、HC的转化率(400 °C);(b) 不同沉淀剂所得催化剂的XRD曲线
3.2 铈锆比的选择
采用上述筛选出的Na2CO3为沉淀剂,制备不同铈锆比的氧化物,并评价其催化性能,以选择合适的铈锆比。活性评价结果(图4a)表明,铈锆比为3 : 1时,Ce0.75Zr0.25O2对污染物转化效率最高,400 °C时HC转化率可达95%。即催化活性最佳的铈锆比为3 : 1。
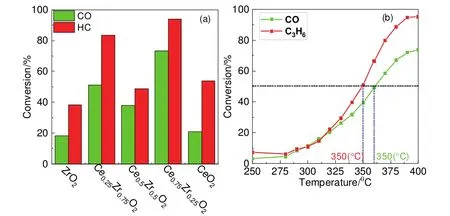
图4 (a) 催化剂在不同铈锆比下对CO、HC的转化率(400 °C);(b) 催化剂对CO、HC转化率随温度变化曲线
为了计算反应活化能,评价了催化剂在不同温度下对污染物的转化效率,实验结果如图4b所示。选取280 °C和290 °C HC (C3H6)转化率(9.3%和10.8%),CO转化率(8.2%和11.4%),计算其活化能为:Ea(HC) = 38.7 kJ·mol-1,Ea(CO) = 85.3 kJ·mol-1。
3.3 不同pH对比表面积的影响
固定铈锆比为3 : 1,沉淀剂为碳酸钠,调节沉淀后pH = 8、9、10制备材料。样品的比表面积测试结果如表1所示,分别为37、36、46 m2·g-1,相差不大。样品的XRD结果如图5所示,三个样品特征衍射峰的位置相同,表明不同pH均制得了相同晶型的铈锆固溶体,因此,当pH = 8–10时,pH变化所引起的结构性能差异可以忽略不计。宽范围的pH制备条件,可操作性强,利于本科实验开展。
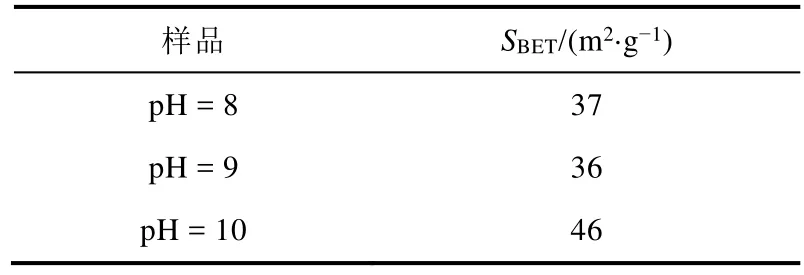
表1 不同pH制备样品的比表面积
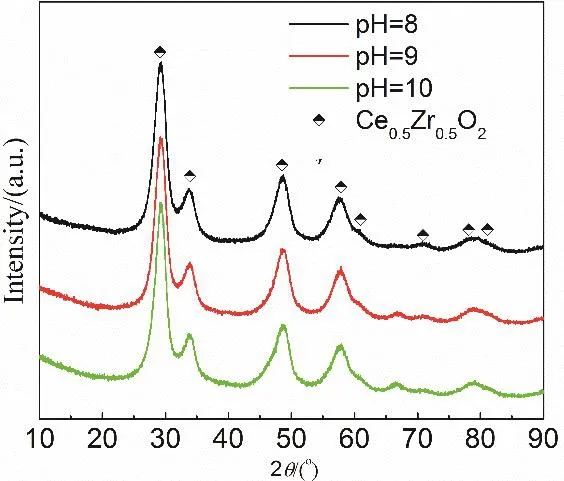
图5 不同pH所得催化剂的XRD曲线
3.4 分离方法
沉淀产物需要分离以及洗涤,对本科实验中常用的离心和抽滤两种分离方法进行了对比(图6)。由于产品量大,使用离心法时,离心管重量需要进行配平,操作耗时、繁琐,且即使离心转速达4000 r·min-1,离心时间达10 min,上清液仍含有部分产物而显浑浊;抽滤法产物损耗较少、操作更简单、耗时更短。为使后续实验顺利进行,最终选取抽滤法进行沉淀物分离,更符合本科实验便于操作的要求。

图6 离心与抽滤两种方法效果对比
3.5 焙烧温度的确定
为了确定适合本科实验的焙烧温度,对样品进行了热重测试,结果如图7所示。

图7 TG-DTG分析曲线
从图7可知,50–90 °C主要为失去吸附水的过程,后随温度升高,沉淀物分解转化为氧化物,当温度达400 °C时完全分解。实验中选择400 °C作为焙烧温度,保证了沉淀物完全分解,且使用的马弗炉操作温度400 °C是基础实验室中的常用焙烧温度,无安全隐患。
3.6 重复性
实验设计成熟之后,研究小组在相同的制备条件下分别共独立进行5次实验操作。结果表明,在确定的实验条件下均制得了相同晶型的铈锆固溶体(图8a),产率稳定在85%左右,对污染物的转化率都达到了最佳,且相对误差均不超过5% (图8b),说明所筛选的实验条件合理,可操作性强,新创实验具有较好的可重复性和再现性。

图8 (a) 5次制备的铈锆催化材料的XRD曲线;(b) 5次制备的铈锆催化材料对于CO、HC的转化效果
3.7 适应性
为了解本实验在本科教学中的适应性,在实验重复性得到验证之后,在本学院进行了小范围推广,邀请学院10位来自不同分数段的学生参与实验学习以及操作,在此过程中,对本实验在本科实验教学中的学时数进行了进一步评估,最终表明,在本实验学时数范围内均能完成,实验的可操作性强。10位学生的实验结果显示,稀土氧化物产率均值可达84.8% (图9a),在400 °C时进行性能测试,HC转化率均值可达94.7% (图9b)。实验重现性好,稀土氧化物性能优异且稳定。综上所述,本实验原料便宜易得,样品易制备、收率高、性能稳定、重现性好,且每部分都可作为独立的基础化学实验,在本科实验教学中有良好的适应性。

图9 10位学生制备的稀土氧化物的产率(a)及对HC转化率(b)
4 结语
科学家们利用我国的稀土资源优势将稀土应用于汽车尾气净化催化剂,解决大气污染问题,取得了非常卓越的成效。本实验将科学研究的前沿和热点引入本科实验,采用环境友好的碳酸钠沉淀剂,通过简单易行的共沉淀法,在pH 8–10的范围内,均可制备性能优异的Ce0.75Zr0.25O2材料,污染物转化效率可达95%,实验内容与传统的无机化学、物理化学、分析化学等学科知识交叉融合,突出了基本原理在前沿科技中的应用。
新开发的实验用于实验教学时,可分为稀土氧化物制备(6学时)及催化性能评价(4学时),板块明确,学时数适当,可作为综合创新实验。实验过程中,学生掌握必要的现代分析手段以及计算机与信息技术,处理和运用稀土相关知识,引导学生透过现象认识问题的科学本质,培养学生的科学思维、创新能力、环保意识和可持续发展理念。
5 创新性/特点/特色声明
(1) 用化学方法解决环境污染问题,体现了化学之能;
(2) 将“稀土材料的制备及应用”引入本科实验,提高学生对稀土战略资源的关注;
(3) 将获奖技术成果转化为本科教学实验,实现了科教融合。

