高分子止血材料研究进展
周舒毅,朱 敏,刘忆颖,曹舒惠,蔡启轩,聂 慧,张玉霞*,周洪福
(北京工商大学化学与材料工程学院,北京 100048)
0 前言
大量失血会导致伤员、手术患者较高的死亡率或者诱发并发症,因此快速止血和创面愈合是外伤和手术中保证大出血患者生存的关键。控制出血与止血以及创面愈合密切相关。止血材料可以起到保护创面、止血、防止感染等作用,创面愈合速度受创面类型、病理学条件和止血材料种类等的影响[1],对止血材料最重要的要求是可直接用于出血创面并能在2 min 内控制大动脉和静脉出血[2]。
开发止血材料时需要考虑材料种类和成分[3],目前的止血材料主要有无机类和高分子材料类。高分子材料中主要有壳聚糖、甲壳素、胶原蛋白等天然高分子和PVA、PLA、聚氨酯(PU)等合成高分子材料,主要产品形式有海绵、水凝胶、颗粒、纳米纤维膜和薄膜等[2]。
传统止血材料在使用过程中易出现伤口感染,无法维持湿性愈合环境,在更换时易发生二次损伤[4]。因此,理想的止血材料需要具备多种功能[5],如可与伤口直接接触释放生物活性物质,在保持良好的伤口愈合环境的同时促进伤口愈合,并且能够有效抑制细菌滋生,降低伤口感染率,同时能快速止血。
1 天然高分子止血材料
天然高分子止血材料通过提供湿润、低氧/无氧、微酸、酶学清创的愈合环境促进止血,与局部应用的药物和机体内源性分子相作用,促进伤口愈合[6],主要有壳聚糖、甲壳素、海藻酸、胶原蛋白等。
1.1 海绵止血材料
海绵止血材料在与伤口接触时会迅速聚集血小板,释放相关的凝血因子Ca2+等,达到凝血止血的目的;且其极高的孔隙率也可以有效促进伤口恢复。天然高分子化合物通常具有生物相容性良好、无毒、可降解、来源丰富、种类多、易改性的特点[7]。以壳聚糖、胶原蛋白、甲壳素等天然高分子为基体的止血海绵在医学领域上发挥着重要作用。
1.1.1 壳聚糖止血海绵
在天然多糖类止血材料中,壳聚糖是经脱乙酰化形成的、自然界中唯一带正电荷的碱性多糖,具有无毒、生物相容性好和可降解等特点,与人体具有良好的亲和性[8-9]。其在血液中形成的—NH3+通过静电相互作用增加血小板黏附,也促进了红细胞在受损部位的快速黏附和聚集,促进血小板活化有助于血栓形成,因此壳聚糖成为止血材料中最常用的天然聚合物[3]。壳聚糖不依赖于机体凝血因子促进止血,所以更适合用于有凝血功能障碍的患者[7]。但用于严重创伤时,会因其与伤口的黏附力不够强、凝血能力不足等导致止血过慢[10-11]。而通过改变其分子结构,引入特定基团或添加其他成分等方法可提高壳聚糖海绵的凝血能力和止血速率,扩大其应用范围。
黄玉芬等[10]在壳聚糖上引入烷基来增加其与细胞的黏附力,他们制备了不同取代度的烷基化壳聚糖,如图1 所示,在所有样品中40%烷基化壳聚糖具有良好的泡孔结构,且止血效果最好。

图1 不同取代度的烷基化壳聚糖海绵Fig.1 Alkylated chitosan sponges with different degrees of substitution
黄治曙等[11]将壳聚糖负载到氧化再生纤维素上,制得的氧化再生纤维素-壳聚糖复合物可明显减少出血量,止血时间比普通壳聚糖缩短了将近1/2,这是因为氧化再生纤维素与血液接触时形成了凝胶状物质,而且其对血小板的进一步吸附聚集增强了止血效果。
1.1.2 胶原蛋白止血海绵
胶原蛋白是动物体内丰富的蛋白质之一,主要存在于动物的皮、骨、软骨及肌腱等结缔组织中[12],具有抗原性低、组织亲合力大等特点。与其他止血材料相比,其拥有更好的生物相容性和吸湿性。多孔状的胶原蛋白海绵具有良好的吸水性能,且可促进血小板的黏附聚集[13-14],从而提高伤口止血效率,但单一胶原海绵存在力学性能差等缺点[14]。
梁佩红等[14]发现胶原蛋白与壳聚糖形成的稳定离子键可提高力学性能。他们用从猪脚肌腱提取的I型胶原与壳聚糖混合,以戊二醛交联,冻干后制得复合I型胶原海绵,其平均止血时间为2 min,仅为纱布的1/5。Sun等[15]将从尼罗罗非鱼中提取的胶原蛋白在1-(3-二甲氨基丙基)-3-乙基碳二亚胺/N-羟基丁二酰亚胺存在的条件下进行酰胺反应,与未交联和商用止血材料相比,制得的交联胶原海绵出血量最少,凝血指标最优,且具有高孔隙率和吸湿率,而且还能促进纤维母细胞的生长。
杨德林等[16]将胶原蛋白和壳聚糖等溶于乙酸溶液,经冷冻干燥后得到舒宁海绵止血材料,其吸水率和止血效果都明显优于明胶海绵。
1.1.3 甲壳素止血海绵
甲壳素是由N-乙酰基-D-葡萄糖单体通过β-1,4糖苷键相连的直链高分子化合物,主要分布在节肢动物虾、蟹等中[17],具有良好的生物可降解性和生物相容性,且毒性较低,在止血海绵中广泛使用。但其凝血因子不足以凝血,且结晶度较高,柔软度差。
Cheng 等[18]发现玉米秸秆髓(CSP)可降低甲壳素(CT)的结晶度,从而提高海绵的柔软度。CSP 还可增强凝血因子Ca2+的积累而促进凝血。他们采用球磨法将CSP 加入CT 中,制备了不同体积比(100 %CT、80 %CT/20 %CSP、50 %CT/50 %CSP)的CT/CSP复合海绵,如图2所示,发现CT50%/CSP50%的孔隙率最高,凝血指数和失血量均最低,且表现出优异的生物降解性和生物相容性。

图2 不同体积比的复合海绵的微观结构Fig.2 Microstructure of composite sponges with different volume ratios
Jiang等[19]利用疏松玉米秸秆和银纳米粒子制备了以甲壳素为基体的交联海绵,吸血率分别是单一甲壳素和商用聚乙烯醇缩甲醛海绵的2.4 倍和2.7 倍,在三者中其孔隙率最大,达到了90.5 %;还具有生物相容性且无毒;此外银纳米粒子的杀菌作用提高了甲壳素的抑菌活性。
1.2 水凝胶止血材料
水凝胶是由无限大三维网络与水共同构成的物质,可与体液进行交换,为细胞和组织的生长提供营养物质,因此具有良好的生物安全性和组织相容性[20],是优异的止血材料。天然高分子水凝胶止血材料主要有多糖类(壳聚糖、海藻酸、淀粉、纤维素、透明质酸等)和多肽类(胶原、聚L-赖氨酸、聚L-谷氨酸等)[21]。其中多糖类中壳聚糖基水凝胶止血材料具有较高的生物相容性而展示出广阔的应用前景。
1.2.1 多糖类
透明质酸是一种具有重要生理功能的酸性黏多糖,是由D-葡萄糖醛酸及N-乙酰葡糖胺组成的糖胺聚糖类物质[22],张涛等[20]将其与壳聚糖复合,采用喷雾干燥的方法制备了壳聚糖-透明质酸水凝胶微球,具有良好的凝血作用,在15 min 左右即可达到最佳凝血效果。Xia 等[23]用羧甲基壳聚糖氧化透明质酸交联制备了一种可降解的壳聚糖水凝胶,其作用下的小鼠相比于对照组出血量更少、止血时间更短,止血性能优异。此外,其还能被机体快速吸收,在体内无明显积累,具有良好的生物降解性和生物相容性。Li等[24]利用N,O—羧甲基壳聚糖(N,O—CMC)和氧化硫酸软骨素[一种硫酸化糖胺聚糖,由交替糖链(N-乙酰半乳糖胺和葡萄糖醛酸)组成]混合物制备了一种具有自愈、抗菌、止血和生物相容性等功能的水凝胶,用其培养的细胞活力在85%以上,且细胞毒性低。此外,由于N,O—CMC固有的抗菌能力,其还显示出优异的抗菌性能;小鼠肝脏模型止血实验结果显示用该水凝胶30 s 时近乎停止出血,且出血量最少,止血性能优异,这得益于其优异的泡孔结构。
1.2.2 多肽类
多肽是蛋白质水解成氨基酸的中间产物,与蛋白质的功能十分接近。其特点在于结构相对简单,分子量较低,而且生物活性多样[25]。
同济大学王启刚等用含胍寡肽制成止血水凝胶,其在小鼠肝脏出血模型中的止血时间为110 s,比空白组的195 s缩短了85 s。近来也有由氨基酸合成多肽而制作止血材料的研究报道,如西北师范大学路德待等以L-精氨酸、L-半胱氨酸和L-赖氨酸为单体,以普兰尼克L-31[分子质量为900 g/mol的聚氧丙烯(含10%的聚氧乙烯)]为引发剂合成了一系列三嵌段共聚物。这些多肽在大鼠肝脏血模型中的失血量不到对照组的21%;且在猪皮和猪骨上的黏合强度高达106 kPa,显示出良好的组织黏附性[26]。
自组装短肽水凝胶是指在特定环境下通过非共价键作用形成特定二级结构,最终自组装成含水量≥99%的超分子纳米纤维短肽水凝胶。RADA16 水凝胶是由16个天然L-氨基酸残基规则重复排列而成的离子互补型自组装短肽,含水量超过99 %、孔径为5~200 nm、纤维直径为8~10 nm,这使得用其制备的纤维网状止血材料能够相对真实地模拟细胞外基质成分,为细胞生长提供必要的三维环境[27]。
1.3 气凝胶止血材料
气凝胶是指借助溶胶凝胶法,用特定的干燥方式使气体取代凝胶中的液相而形成的一种纳米级多孔固态材料[28]。在止血材料中,气凝胶因具有大的表面积、高的孔隙率、可控的孔尺寸、极低的密度、优异的吸附能力和良好的生物相容性而倍受关注[29]。其密度、孔隙率与结构都会对其性能产生重要的影响。
中国海洋大学陈西广教授[30]课题组和Li等[31]以多巴胺为交联剂,通过“碱性沉淀-叔丁醇置换-冻干方法”并用,将壳聚糖和硅藻土共混,成功制备出孔径可控的壳聚糖/硅藻土复合气凝胶止血材料,其具有极大的比表面积(74.441 m2/g)和极高的吸水率(>316.83%),且溶血率极低(<5%),对L929 细胞无细胞毒性。将壳聚糖和多巴胺封装部分活性硅醇基团,削弱细胞表面硅藻土极性基团的作用,使其具有良好的血液相容性和细胞相容性及快速的止血性能。
Daria Lovskaya等[32]采用超临界二氧化碳干燥法制备了具有局部止血潜力的壳聚糖基气凝胶止血颗粒,其比表面积可达301~243 m2/g、孔隙率可达98 %~95%、蒸馏水吸附量可达9.63~4.83 g/g。Wang 等[33]以γ-氯丙基三乙氧基硅烷为交联剂制备了壳聚糖和介孔二氧化硅负载n-卤胺前驱体,然后通过冻干法制备了多孔的三维微结构硅氧烷气凝胶,其密度低(约0.12 g/cm3)、孔隙率高(≥99.53%);对金黄色葡萄球菌和大肠杆菌的消灭率极高,可在短时间内灭活,因此作为一种新型的止血杀菌杂化材料在医药生物领域具有广阔的应用前景。
随着对石墨烯性能研究的不断深入,人们也开展了石墨烯杂化气凝胶用作止血材料的研究。Toribio Figueroa 等[34]制备了含有葡萄籽和皮肤提取物的石墨烯/壳聚糖气凝胶(图3)。其表面存在负电荷,且具有较高的交联密度,能够迅速吸收血液。在加入含有高含量黄烷醇的葡萄籽和皮肤提取物后,气凝胶的粗糙度和硬度得到提高,使其更加适用于血液吸收。具有成为有效止血剂的潜力,且可作为给药平台为创口提供相应药物。

图3 在基本条件下合成的负载6%SD提取物的吸附血气凝胶的SEM照片Fig.3 SEM of adsorbed blood aerogel loaded with 6%SD extract synthesized under basic conditions
Jessica Borges-Vilches等[35]通过微波辅助反应制备了基于明胶和石墨烯的气凝胶,并在其中加入了富含原花青素的葡萄皮提取物,制得一种新型止血气凝胶。其本身具有多孔结构(图4),与磷酸盐盐水溶液和新鲜人体血液接触时能够吸收超出自身质量50倍的物质。此外,将多酚化合物掺入明胶/石墨烯气凝胶中能够降低伤口处的pH值,有助于伤口愈合,有效提高其止血能力。

图4 气凝胶表面血细胞黏附的SEM照片Fig.4 SEM of blood cell adhesion on aerogel surface
Guajardo 等[36]通过石墨烯基团和明胶胺基基团之间的物理作用制备了具有各种形态的微孔、表面分别携带正电荷和负电荷的明胶/石墨烯气凝胶(图5),孔隙率大于90 %,表现出较高的磷酸盐盐水溶液吸收率,在水中十分稳定。带正电的明胶/石墨烯气凝胶力学性能更好,且具有更稳定的结构;带负电的气凝胶具有更出色的凝血性能,凝血率高达95.6 %,且无细胞毒性,能够促进纤维细胞增殖。

图5 GO-G气凝胶带正负电的表面SEM照片Fig.5 SEM of the surface of GO-G aerogel with positive and negative charges
1.4 颗粒止血材料
颗粒止血材料是止血材料中的重要组成部分,可用于不规则形状伤口或较深伤口等多种创面止血,且具有良好的止血效果[3]。目前颗粒止血材料主要有壳聚糖颗粒和淀粉颗粒。
1.4.1 壳聚糖颗粒
将壳聚糖与其他材料混合制备复合微球可达到更好的止血效果,Sun等[37]将介孔二氧化硅纳米颗粒掺入壳聚糖制备快速止血剂。他们采用微乳液、热诱导相分离法和表面活性剂模板法制备了壳聚糖-硅酸多孔复合微球,微球的表面和内部形成了大量介孔二氧化硅纳米粒子,表面积大且内部有大孔。在大鼠肝裂伤模型中,其止血时间由单组分多孔壳聚糖微球的114 s缩短至97 s,止血能力更强,是一种安全有效的快速止血剂。
潘萌[38]通过微乳液法与热致相分离法制备了壳聚糖/海藻酸锌(CS/ZnAlg)复合微球,微球能将血小板、红细胞等阻挡在其表面,同时可以吸走血液中的水分,使红细胞凝聚并吸附在其表面,提高凝血速率。大鼠肝裂伤试验表明CS/ZnAlg的凝血效果显著,凝血时间缩短到55 s,如图6所示。
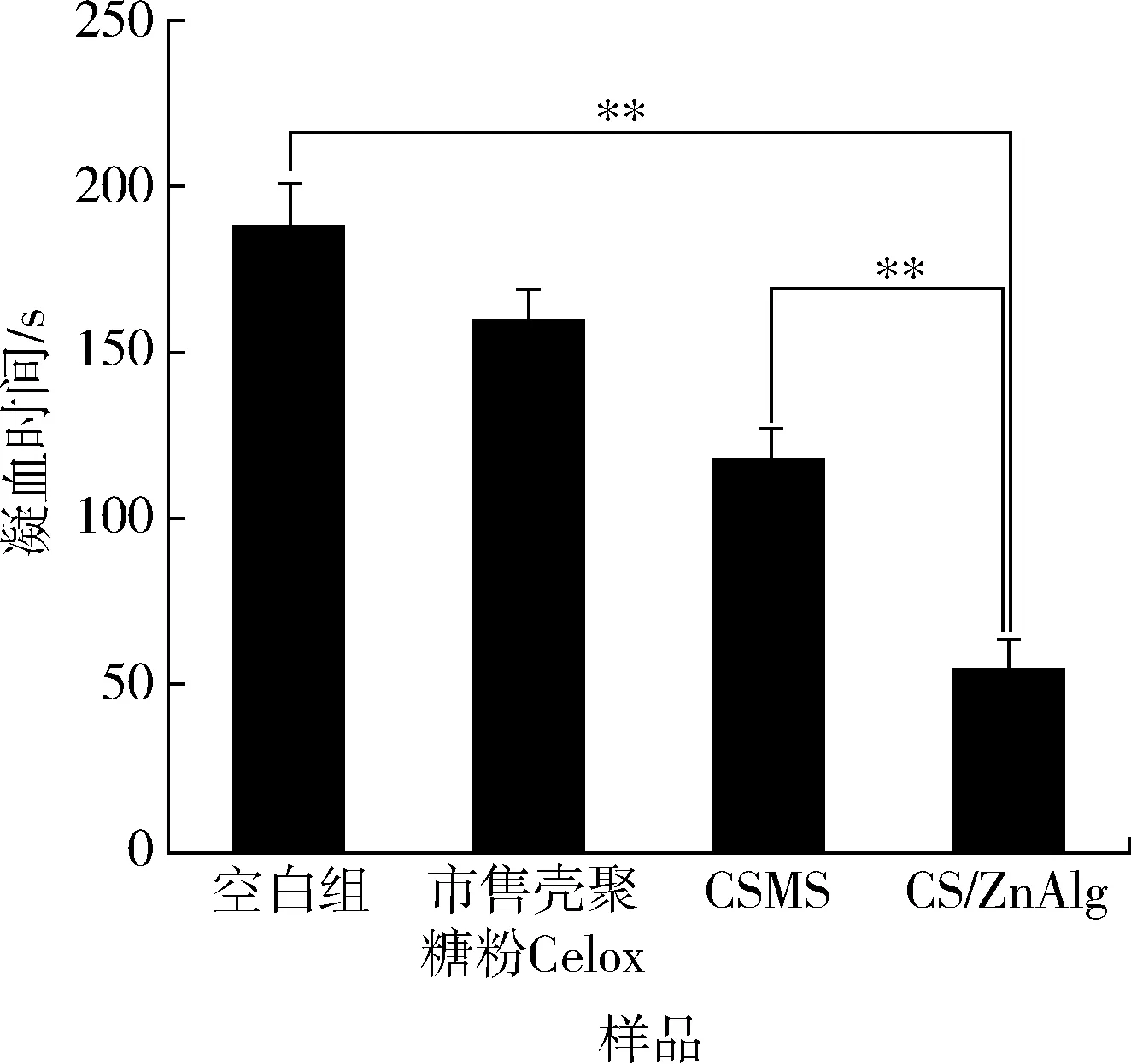
图6 不同止血材料的体外凝血时间(**表示CS/ZnAlg与空白组和CSMS样品相比存在极显著差异P<0.01)Fig.6 In vitro coagulation time of different hemostatic materials
1.4.2 淀粉颗粒
近些年来,淀粉止血微粒被广泛应用于临床[39]。为改善单一淀粉颗粒的止血效果及生物相容性,苏洋[40]通过高碘酸钠将淀粉醛化改性,再将改性后的聚醚酰亚胺接枝在醛化后的多孔淀粉上,使多孔淀粉具有一定的正电性。改性后的淀粉吸水性明显上升;血液相容性更好,能够有效吸附血细胞;此外还具有很好的抗菌效果。
易月[41]以马铃薯为原料制备了马铃薯多孔淀粉,对其改性制得了交联多孔淀粉小球和附钙多孔淀粉小球,三者的生物相容性都很好,且止血时间较云南白药明显缩短,其中附钙多孔淀粉比交联多孔淀粉和多孔淀粉的止血效果更好。
2 合成高分子止血材料
合成高分子止血材料是利用原料的性能和其所造成的局部环境促进止血和伤口愈合,如合成纤维吸收性能更高、更不易脱落;由多氨基甲酸乙酪制成的半通透性吸收膜在伤口处形成润湿低氧的环境,从而促进伤口愈合[42]。
2.1 海绵止血材料
以PVA 为基体制成的海绵具有多孔结构,可作为药物传递物,但同时也存在术后取出困难、抗伤口粘连差、易引发炎症等问题[43-44]。Ji Won Kim 等[43]设计了一种由弹性纳米纤维素纤维包裹PVA 的海绵,在鼻黏膜缺损动物模型中,与纱布和单一PVA 相比,其失血量最少(0.074 mg左右),且炎症细胞数量最少,表明纳米纤维素增强了其抗炎作用。
林志丹等[44]以缩醛化PVA 海绵为基材,在缩醛化反应形成泡沫过程中加入PVA/壳聚糖共混液,制备了壳聚糖改性缩醛化PVA 海绵,其泡孔结构更均匀,可促进伤口止血愈合,且伤口与取出海绵无粘连,炎症反应也得到有效抑制,这是由于适度增加发泡剂含量可使其孔隙率增大(图7),有利于提高海绵的吸水能力;添加混合液有利于提高其黏附、药效和力学强度。
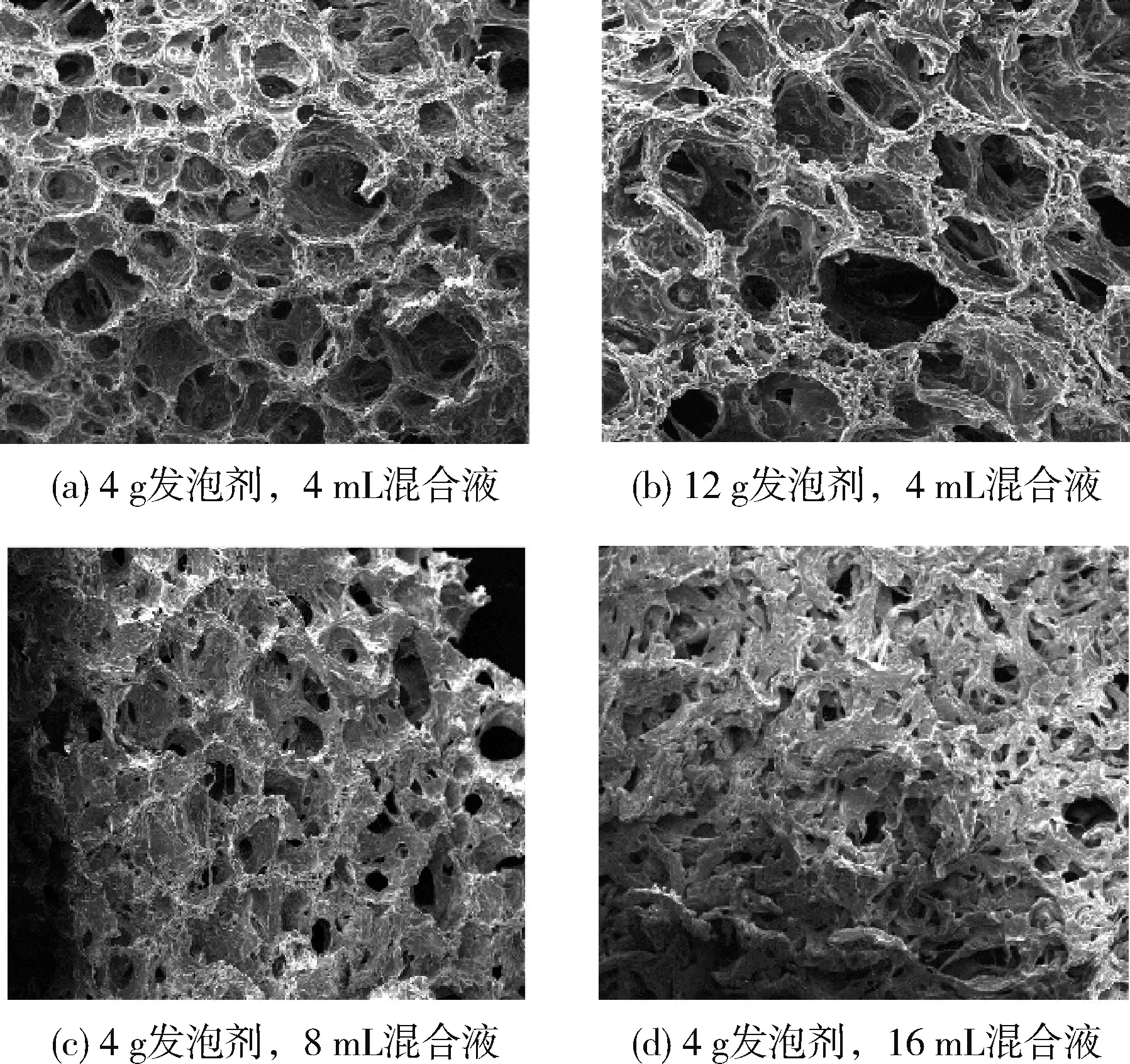
图7 不同含量发泡剂和混合液的样品Fig.7 Samples of different amounts of foaming agent and mixture
2.2 水凝胶止血材料
范先谋等制备了聚丙烯酰胺-单宁酸-高岭土水凝胶,其中单宁酸丰富的儿茶酚基团不仅赋予了其湿润黏附性能,而且能促进凝胶中第二个网络的形成,使其具有高强高韧特点;高岭土则增强了其止血性能,使大鼠股动脉伤口的止血时间从148 s 缩短至24 s,是一种快速止血材料[45]。
臭氧具有良好的抑菌及止血促凝效果,也是一类较好的止血材料。但其稳定性差、极易分解,可以通过制备臭氧水凝胶来克服这一缺点[46]。刘方等[46]以卡波姆(聚丙烯酸、羧基乙烯共聚物)为基质制作了臭氧缓释水凝胶,其具有较好的稳定性、促进止血及伤口愈合功效。微观上呈三维网格状结构,网格之间相互连通(图8),使其具有较好的吸水性,接触血液时可以吸收血浆,浓缩血液,有利于血小板聚集,提高止血效果。

图8 臭氧缓释水凝胶的SEM照片Fig.8 SEM of ozone sustained-release hydrogel
2.3 气凝胶止血材料
Constanza Mellado 等[47]利用溶胶凝胶法制备了干燥的氧化石墨烯和PVA 杂化气凝胶,之后在其中加入了葡萄籽和果皮中富含原花青素(浓缩单宁)的天然提取物,得到的气凝胶具有多孔结构和较低的密度,对水分和血液的吸收率更高,具有凝血和输送化合物的性能。在治疗创伤出血、伤口愈合和皮肤给药方面具有极大的应用潜力。
Zheng等[48]提出以PVA为有机黏合剂,以具有生物相容性的无机超长羟基磷灰石(HAP)纳米线为主体,采用冷冻干燥技术构建三维多孔结构(图9),制备了具有良好可塑性和柔韧性的止血气凝胶。其中W-8HAP-2PVA(HAP 与PVA 的质量比为8∶2)气凝胶具有优异的亲水性和高孔隙率,能够加速止血。此外其还具有良好的血液相容性和细胞相容性,能够促进皮肤伤口愈合。

图9 不同成分的W-HAP-PVA气凝胶和P-8HAP-2PVA气凝胶(由80%质量的HAP纳米粉体和20%质量的PVA组成)的SEM照片Fig.9 SEM of W-HAP-PVA aerogel and P-8HAP-2PVA aerogel with different compositions(composed of 80 wt%HAP nanopowder and 20 wt%PVA)
2.4 纳米纤维膜止血材料
纳米纤维膜制备较为简单,具有良好的力学性能,且可以混合其他易于止血的材料或搭载抗菌、消炎粒子等活性物质制备纳米纤维膜,为创面愈合提供有效的杀菌促凝作用,可广泛应用于包扎止血材料。用于止血时,纳米纤维膜需要具有良好的生物相容性、抑菌性和吸水性。在结构上,具有一定的孔隙率,纤维形貌均匀的纳米纤维膜更适宜用作医用止血材料。目前研究较多的纳米纤维膜有PVA 纳米纤维膜和PLA 纳米纤维膜。
2.4.1 PVA纳米纤维膜
单一PVA 纳米纤维膜虽有一定止血效果,但生物相容性较差。壳聚糖与PVA 制成的纳米纤维膜具有更好的生物相容性,且可以抑菌抗菌。焦天宇等[49]采用静电纺丝技术制备了负载左氧氟沙星的PVA/壳聚糖纳米纤维膜,其比表面积大,有利于药物的释放。且壳聚糖与左氧氟沙星复合制备的纤维膜具有广谱、长效的抗菌性能。
李敏等[50]采用静电纺丝技术制备了负载银粒子的PVA/海藻酸钠复合纳米纤维膜(图10),银粒子和海藻酸钠均具有抗菌性,因而,纤维膜对大肠杆菌和金黄色葡萄球菌的过滤效率达99.2%。

图10 不同海藻酸钠含量的PVA/海藻酸钠复合纳米纤维的形貌Fig.10 Morphology of PVA/SA composite nanofibers with different SA contents
纤维膜的结构对其性能也有很大影响。刘晓妍等[51]用积雪草苷、壳聚糖和PVA 为芯层原料,海藻酸钠和PVA 为壳层原料,利用同轴静电纺丝技术制备出同轴纳米纤维膜。其对大鼠的烧伤愈合有明显的促进作用,且搭载药物的膜对伤口愈合的促进效果更好,有利于创面细胞的增殖和血管生成,抑制炎症的发生。
2.4.2 PLA纳米纤维膜
PLA 是优异的医用材料,搭载抗菌药物或者具有杀菌功能的粒子可提高其抗菌性。陈品鸿等[52]用静电纺丝技术制备出搭载了恩诺沙星的PLA纳米纤维膜并模拟了体外释药实验。其对恩诺沙星的缓释时间达到了72 h,且恩诺沙星具有良好的杀菌作用,有利于伤口的愈合。
罗炜等[53]用喷气纺丝技术构建了具有模拟细胞外基质结构的PLA 纳米纤维膜基底,并在膜表面引入氨基,同时将纳米银修饰到纤维膜表面。结果表明,引入氨基使纤维膜亲水性提高,改善了细胞在膜上的黏附,且对大肠杆菌的抗性也有显著提高。
刘荣涛等[54]用静电纺丝技术制备了掺杂酒石酸的聚苯胺与PLA 复合纳米纤维膜,加入聚苯胺可提高纤维膜的生物相容性和亲水性,且酒石酸和聚苯胺不会改变PLA 膜的多孔结构。此外,具有空心管状结构的纳米纤维膜的生物相容性更好。
2.5 薄膜类止血材料
薄膜类合成高分子医用材料可以人为地控制其孔隙率、抗菌性、力学性能、吸水性和降解性,在促进创伤愈合领域中广泛使用。
2.5.1 PU薄膜
PU 薄膜具有良好的生物相容性和力学性能,在失血材料中广泛应用。张凌昊等[55]用流延法制备了PU薄膜,研究了异氰酸根与氢氧根的比值(R值)对薄膜性能的影响。结果表明,PU 薄膜具有优秀的延展性,可以通过降低R值来提高薄膜的吸水性。
胡丹丹等[56]利用湿法成膜技术制备了PU/醋酸淀粉(ASt)共混膜和PU/聚乙二醇(PEG)共混膜。实验表明,ASt 和PEG 均可增大PU 薄膜的孔隙率、吸水性和渗透性,但不降低薄膜的抗菌能力。在PEG 含量为40%时,PU薄膜的力学性能较好,接触角急剧下降,薄膜的亲水性大幅度提高。另外,ASt 和PEG 都可以促进PU薄膜的降解。
任振俶等[57]用化学接枝法将PEG 和羧基化壳聚糖接枝到PU 薄膜表面,制得的薄膜亲水性和血液相容性均有提高,溶血率<2 %,属于非溶血性生物医用材料。
2.5.2 PVA薄膜
王培等[58]用流延法制备了搭载了姜黄素的PVA/羧甲基纤维素钠薄膜。姜黄素具有抗菌性能,搭载在薄膜上有利于伤口的愈合。PVA 与羧甲基纤维素钠的质量比为1∶2 时,薄膜的降解率最大,达到了79.8 %。在二者质量比为1∶1 时,薄膜具有较好的缓释性和较高的包封率。
石锐[59]等以淀粉和PVA 为原料,通过冷冻干燥制备出具有多孔结构的PVA 薄膜,具有良好的力学性能和亲水性。PVA 含量增大使薄膜的孔径减小。PVA∶淀粉=1∶1 时,其拉伸强度为7.2 MPa、孔隙率为52.4 %、24 h 吸水率为296 %、换液后7 d 细胞增殖率达到90%。
刘力等[60]用成膜法制得PVA-AlgCa2+(海藻酸盐)-透明质酸复合薄膜,透明质酸含量在1%~4%时,其呈网状交织多孔结构,孔径分布随着透明质酸含量的增加而更均匀,含水率上升。
2.5.3 PLA薄膜
辛强伟[61]利用活性自由基聚合法将不同浓度的2-甲基丙烯酰氧乙基胆碱磷酸(MCP)聚合物分子刷接枝到PLA 膜表面。单体MCP 投入量越大,PLA 膜的粗糙度和亲水性越大。经MCP功能化的PLA 膜不影响PLA原有的生物相容性,还会减轻机体的炎症反应。
张彬等[62]以PLA、壳聚糖和明胶为原料制备了PLA/明胶/壳聚糖复合薄膜,采用热诱导相分离法对其致孔,使薄膜具有微孔结构。壳聚糖和明胶提高了薄膜的亲水性,与自然冻干和-50 ℃预冻后再冻干的样品相比,-10 ℃预冻后再冷冻干燥的薄膜的泡孔率最大、亲水性最好。
陈米娜等[63]用流延法将PLA 制成薄膜,之后将其浸泡在含新生牛血清的达尔伯克(氏)必需基本培养基中预处理。可以抵消PLA薄膜对细胞的抑制增殖和分化作用。
3 天然高分子与合成高分子多层复合止血材料
目前为止,市场上有超过3 000 种不同的止血材料[64],但单一止血材料难以实现多功能化,因此,在伤口愈合研究领域,研制具有多功能的复合止血材料备受关注[65]。
邱玉宇[4]将玉米醇溶蛋白/乙基纤维素/王不留行黄酮苷和玉米醇溶蛋白/乙基纤维素/光敏剂混合溶液静电纺丝,在静电场下将2种混合溶液的纳米纤维分别沉积在细菌纤维素膜/聚酯无纺布复合膜的两面,并用热压仪将3 层结构加固形成多层复合创伤止血材料。用其处理的小鼠伤口在造模后第10 天愈合率达到92.4%,明显高于对照组;而且在维持伤口湿性愈合环境的同时还能促进伤口愈合。
止血材料作用于人体,酸碱性指标合格才能抵御外界细菌侵蚀,保持皮肤弹性和水分的最佳状态。吴杰[66]通过壳聚糖纤维、黏胶纤维和聚酯纤维的配比和纤维排列方向的设计,制备了7种不同纤网结构的壳聚糖多层水刺复合功能性医用止血材料,其水浸出液的酸碱度都在6.0~7.0之间,有利于皮肤的修复;此外还具有优异的抑菌性能,对金黄色葡萄球菌抑菌率>99%,对大肠杆菌的抑菌率也在90%~99%之间。
孙玮[67]以盐酸环丙沙星为抗菌剂、将PVA/壳聚糖纤维膜、海藻酸钠/羧甲基纤维素钠气凝胶与医用无纺布胶布复合得到多层复合止血材料。实验表明,载药纤维膜有明显的抑菌圈,抗菌性随着药物的含量增加也逐渐增强。
He 等[68]制备了一种能实时监测感染发展情况的创面止血材料,这种由硬脂酰三甲基氯化铵、负载抗菌性亚甲基蓝的PVA 泡沫和电纺丝羧甲基纤维素钠网片组成的多层创面止血材料具有良好的凝血作用、高吸水性及显著抑菌作用,在细菌载量超过止血材料的抑菌阈值时,材料内的亚甲基蓝会使颜色发生明显变化,实时监测感染发展情况,能够及时向医护人员反馈患者伤口情况。
4 结语
理想的止血材料应该具有优异的抗菌、止血性能、不损伤人体皮肤、便于加工制作、经济、便携等特点,才能满足医学应用的需求。目前尽管在生物高分子止血材料和合成高分子止血材料方面有着持续发展,但仍然存在很多难以解决的问题,如设计一种易于取出且不剥离血块、不引起继发性出血和疼痛的材料仍是一个重大挑战;在使用可降解材料时,应保证降解产物的生物相容性且体内血栓无炎症反应的风险;同时,降解率必须与组织修复过程相匹配,目前尚且无法做到真正完全满足临床需求。相信随着科学技术的不断进步,研究人员定会研制出性能优异的止血材料,满足患者术后快速康复的需求。

