弗氏完全佐剂肌肉注射诱发炎性痛敏及免疫应答的转录组测序分析
石惊涛张晓宁曹婉萦何 伟刘一寒王 睿宿杨帅万红叶曲正阳景向红王晓宇*
(1.中国中医科学院针灸研究所,北京 100700;2.北京理工大学,北京 100081)
将弗氏完全佐剂(complete Freund’s adjuvant,CFA)注射到实验动物不同组织中(如关节[1]、足底[2]、尾根[3]、肌肉[4])是基础研究中最常用的炎症模型造模方法。 它能够诱导局部发生强烈而持久的炎症反应,并伴随着剧烈疼痛[5],同时CFA 也是许多自身免疫性疾病实验动物模型诱导方案中不可替代的组成部分[6]。 CFA 注射部位中较常见的是足底注射,用于观察急性和慢性炎症所带来的痛觉过敏和原发痛行为[7],以及慢性炎性痛诱发的焦虑抑郁样情绪行为[8]。 其次是关节腔内或尾根部皮下注射CFA[1,3,9],常用于类风湿关节炎的基础研究[10]。 肌肉注射CFA 则较多的运用于抗体的制备[11]。 近几年来,在肌肉中注射CFA 并观察肌肉炎性疼痛和反应的研究逐渐增多,相关研究较多的聚焦于CFA 诱发的肌肉炎性反应所带来的实验动物行为学上的改变[12-13],而对肌肉炎性反应中免疫应答的病理生理过程及其痛敏相关基因组学的观察和研究仍较少。
细胞因子参与不同免疫细胞亚群的发育、成熟、分化、活化、效应过程,能直接调节免疫应答的过程。 基于Meso Scale Discovery(MSD)的微孔板电化学发光的多重免疫测定法是目前细胞因子检测中灵敏度和准确度最高的技术,并可同时检测疾病组织模型样本中多种细胞因子的含量[14-15]。 RNA测序(RNA-sequencing,RNA-Seq)是近年来发展迅速的高通量测序技术,具有分辨率高、应用广泛等特点,可从转录组水平揭示疾病模型的基因表达模式[16]。 本研究通过观察股二头肌CFA 注射后1~15 d 痛行为学、局部组织结构细胞形态的变化,使用电化学发光法测量局部组织和外周血中炎性因子含量,对CFA 肌肉炎性模型进行系统的观察;采用RNA-Seq 技术比较炎症前期和炎症后期局部肌肉中的基因表达变化,分析差异基因的功能,为在此模型上进行的基础实验研究提供重要的参考。
1 材料和方法
1.1 实验动物
本实验选用7 周龄清洁级Wistar 大鼠90 只,体重(209.47±4.86)g,由斯贝福(北京)生物技术有限公司提供[SCXK(京)2019-0010]。 实验动物均饲养于中国中医科学院基础研究所[SYXK(京)2021-0017]。 实验动物的喂养遵守《实验动物照料和使用指南》的要求,室温在(24±1)℃,室温维持照明12 h、黑暗12 h 交替的昼夜光照节律。 Wistar 大鼠随机分为正常组和CFA 注射后第1 天(MD1)、第3天(MD3)、第5 天(MD5)、第7 天(MD7)、第9 天(MD9)、第11 天(MD11)、第13 天(MD13)和第15天(MD15)模型组。 每组10 只大鼠,观察各组大鼠左侧足底的机械痛和热痛阈值变化、各组大鼠随机选择其中8 只进行局部组织和外周血中炎性因子表达水平的检测;从正常组、MD3 组和MD13 组大鼠中每组选取6 只,用于转录组测序进行差异表达基因分析,2 只大鼠用于局部组织的形态学观察。 全部实验内容经中国中医科学院针灸研究所伦理委员会审查批准(中科针伦D2018-04-13-1),实验过程严格遵循3R 原则。
1.2 主要试剂与仪器
弗氏完全佐剂(货号:F5881,Sigma,美国);异氟烷(宁芬,中国);高效RIPA 组织/细胞快速裂解液(货号:R0010,索莱宝,中国);10%福尔马林固定液(货号:G2160,索莱宝,中国);二甲苯(货号:CAS1330-20-7 国药集团, 中国); V-PLEX Proinflammatory Panel 2 Rat Kit(货号:K153A0H,Meso Scale Discovery,美国);TRIzol(货号:15596026,赛默飞,美国)。
大(小)鼠热辐射痛测定仪(Ugo Basile,意大利);动态足底触觉仪(Ugo Basile,意大利);大鼠呼吸麻醉机(瑞沃德,中国);Thermo 4℃低温高速离心机(Thermo,美国);EG1150H 组织包埋机(徕卡,德国);RM2235 石蜡切片机(徕卡,德国);光学显微镜(奥林巴斯,日本);多因子检测仪(Meso Scale Discovery,美国);Agilent 2100(Agilent,美国)。
1.3 实验方法
1.3.1 炎性痛模型的建立
在异氟烷吸入麻醉下,将大鼠固定于俯卧位,对左侧后肢进行备皮。 在左侧股二头肌肌腹注入200 μL 的CFA,注射深度约0.5 cm,注射时间大于30 s,缓慢出针防止药液渗漏。
1.3.2 足底机械痛阈和热痛阈的测量
测试前将大鼠放入玻璃板面上的围箱,适应环境30 min。 测机械痛阈时,匀速上升的金属探针穿过网眼垂直刺激大鼠左、右侧足底,当出现明显缩腿反应时,计时器计时结束,记录大鼠缩足潜伏期(paw withdraw latency,PWL)。 左、右侧各测3 次,每次间隔10 min,分别记录双侧缩足潜伏期数值平均后为机械痛的缩足潜伏期。
测试前将大鼠放入玻璃板面上的围箱内,适应环境30 min,测热痛阈时,将红外光源移至玻璃板下方,对准大鼠左右侧足底,按下红外光发射器的按钮,测试即开始,直至大鼠感觉到疼痛,缩回后爪致使发热反射突然下降并切断红外光源,计时器计时结束,此时记录大鼠PWL。 左、右侧各测3 次,每次间隔10 min,分别记录双侧缩足潜伏期数值平均后为热痛的缩足潜伏期。
1.3.3 局部肌肉组织石蜡切片的观察
随机选取正常组、MD3 组和MD13 组中2 只大鼠进行灌流固定,取左侧股骨头至踝关节的肌肉组织,使用4%的多聚甲醛溶液进行固定,组织修块后进行石蜡包埋、切片并进行HE 染色,染色完成后使用中性树脂封片进行观察。
1.3.4 外周血及局部肌肉组织中炎性因子含量的测量
大鼠在异氟烷麻醉状态下经心脏采血,使用含抗EDTA 的采血管收集血液,然后将大鼠放入二氧化碳箱内处死。 用12 mm 取皮器取炎症部位的肌肉组织并放入液氮中冷冻,研磨称量后置于-80℃冰箱保存。 收集到的血浆静置15 min 后离心取上清液,而组织则加入10 倍质量体积的高效RIPA 裂解液进行裂解,提取蛋白。 根据说明书,使用VPLEX Pro-inflammatory Panel 2 Rat Kit 测量组织和血浆中炎性因子含量。 利用多因子检测仪对样本进行分析,以量化电化学发光信号,测定各细胞因子的浓度。
1.3.5 转录组测序分析
随机挑选正常组、MD3 组和MD13 组大鼠每组6 只,采集CFA 注射部位的肌肉组织进行转录组测序分析。 TRIzol 法提取各组样本总RNA,并在北京奥维森基因科技有限公司完成RNA 测序分析。 用Nanodrop 和Agilent 2100 分别检测RNA 纯度和完整性。 样品检测合格后,使用带有Oligo(dT)的磁珠富集得到mRNA,再加入fragmentation buffer 将mRNA 打断成短片段。 随后,用六碱基随机引物(random hexamers)以mRNA 为模板进行反转录合成cDNA,并进行末端修复、加A、加接头。 通过AMPure XP beads 对双链cDNA 进行片段大小选择,最后进行PCR 扩增以构建cDNA 文库。
建好的文库先进行文库质检,质检合格的文库使用Illumina 高通量测序平台,采用PE150 测序策略。 对下机的原始数据Raw reads 质控后,获得Clean reads。 分别利用star 和Cufflinks 软件完成比对和转录本拼接分析,然后对所有基因进行定量分析。 获得基因表达量后,使用DESeq 进行差异表达分析,以Q value <0.05 为标准,筛选出MD3 组和MD13 组大鼠与正常组之间显著差异表达的基因。利用GOseq 软件对差异表达的基因进行GO(Gene Ontology) 功能及利用KOBAS 软件进行KEGG(kyoto encyclopedia of genes and genomes)通路富集分析,帮助了解差异表达基因的功能。 将得到的差异表达基因互作网络数据文件导入Cytoscape 软件,进行蛋白互作(protein-protein interaction,PPI)网络分析。 计算每个基因的连通性连接程度,即其连接的基因数量,以评估其在该网络中的重要性。
1.4 统计学方法
采用SPSS 21.0 软件进行数据处理,计量资料以平均数±标准误差(±s)表示。 符合正态分布且方差齐者,采用单因素方差分析,进一步两两比较采用SNK-q检验;不满足方差齐性或正态分布则采用Dunnett’s T3 检验,以P<0.05 作为差异有统计学意义的标准。 配对样本数据采用配对样本t检验,以P<0.05 作为差异有统计学意义的标准。
2 结果
2.1 肌肉注射CFA 对大鼠患侧足底机械痛阈值和热痛阈值的影响
CFA 肌肉注射1 d 后,模型组大鼠患侧足底对于机械刺激的缩足潜伏期为(10.94±1.71)s,与正常组大鼠(23.69±4.21)s 相比明显降低,差异具有统计学意义(P<0.05)。 CFA 注射3、5、7、9、11、13和15 d 后大鼠机械痛缩足潜伏期分别为(9.57±2.88)s、(11.69±3.01)s、(9.70±3.48)s、(10.17±2.56)s、(8.98±2.10)s、(10.13±4.30)s 和(10.54±1.77)s,与正常组相比均显著降低(P<0.05)(见图1A)。 在注射CFA 1 d 后,模型组大鼠对热刺激的缩足潜伏期为(9.54±2.15)s,与正常组大鼠(17.03±3.81)s 相比明显降低,差异具有显著的统计学意义(P<0.05)。 CFA 注射3、5、7、9、11、13 和15 d 后大鼠热痛缩足潜伏期分别为(8.65±2.01)s、(9.07±1.19)s、(7.89±1.96)s、(7.47±0.94)s、(7.27±1.28)s、(7.52±1.7)s 和(6.09±0.76)s,与正常组相比均显著降低(P<0.05)(见图1B)。 说明肌肉注射CFA 造成的炎症反应可诱导大鼠同侧足底产生持续的机械和热痛敏。
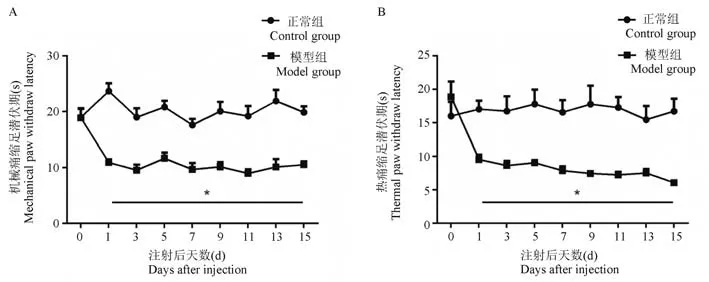
图1 肌肉注射CFA 对大鼠足底机械和热痛阈的影响(±sx¯,n=10)Note. A, Changes of PWL for mechanical stimulation. B, Changes of PWL for heat stimulation.Compared with control group, *P<0.05.Figure 1 Effects of plantar mechanical and thermal pain thresholds in rats after injection of CFA in muscle
2.2 肌肉注射CFA 对大鼠局部组织中细胞因子含量的影响
CFA 肌肉注射1 d 后,模型组大鼠局部组织中IL-6、IL-1β 含量分别为(103.76±29.69) ng/mg、(9615.42±3941.95)pg/mg,与正常组大鼠(4.51±1.00)ng/mg、(269.81±96.07)pg/mg 相比明显升高,具有极显著的统计学差异(P<0.01)。 造模后不同时间大鼠局部肌肉组织中IL-6、IL-1β 均高于正常组(P<0.05),其中CFA 肌肉注射13 d 后,模型组大鼠局部组织中IL-6、IL-1β 含量分别为(36.76±22.54)ng/mg、(5134.07±2955.51)pg/mg,与正常组大鼠相比均明显升高,具有极显著统计学差异(P<0.01)(图2A、2B)。 CFA 肌肉注射1 d 后,模型组大鼠局部组织中TNF-α 含量为(644.33±208.81)pg/mg,与正常组大鼠(52.71±11.41)pg/mg 相比明显升高,差异具有统计学意义(P<0.05)。 造模后不同时间大鼠局部肌肉组织中TNF-α 均高于正常组(P<0.05),其中CFA 肌肉注射13 d 后,模型组大鼠局部组织中TNF-α 含量达到最高值(1110.99±541.99)pg/mg,与正常组大鼠相比明显升高,具有极显著统计学差异(P<0.01)(图2C)。 造模后第1天组大鼠局部组织中抗炎因子IL-10 含量为(90.60±13.19)pg/mg,与正常组大鼠(141.35±41.42)pg/mg 相比明显降低,差异具有统计学意义(P<0.05)。造模后不同时间大鼠局部肌肉组织中抗炎因子IL-10 含量均明显低于正常组大鼠,差异具有统计学意义(P<0.05)(图2D)。 提示肌肉注射CFA 后,注射局部的肌肉组织分别在注射后第1~3 天和第13 天发生两次明显的炎性反应。

图2 CFA 注射对大鼠局部组织中炎性因子含量的影响(±s,n=8)Note. Compared with control group, *P<0.05, **P<0.01.Figure 2 Effect of CFA injection on the inflammatory factors levels in the local tissues of rats
2.3 肌肉注射CFA 对大鼠外周血中细胞因子含量的影响
CFA 肌肉注射1 d 后,模型组大鼠外周血中IL-6、IL-1β 含量分别为(570.45 ± 225.86) pg/mL、(14.30 ± 3.40) pg/mL,与正常组大鼠(83.20 ±22.92)pg/mL、(7.96±5.05)pg/mL 相比明显升高,差异具有显著的统计学意义(P<0.05)。 造模后不同时间大鼠局部外周血中IL-6、IL-1β 与正常组相比无统计学差异(图3A、3B)。 CFA 肌肉注射1 d后,模型组大鼠外周血中TNF-α 含量为(45.92±7.19)pg/mL,与正常组大鼠(26.65±2.63)pg/mL相比明显升高,差异具有统计学意义(P<0.05)。 造模后不同时间大鼠局部外周血中TNF-α 与正常组相比无统计学差异(图3C)。 而外周血中IL-10 的含量在局部肌肉注射CFA 后,随着时间的变化逐渐降低。 在造模后的第7、9、11、13、15 d,外周血中IL-10 的含量分别为(7.04±1.86)pg/mL、(5.68±2.98)pg/mL、(6.10±2.96)pg/mL、(6.59±1.67)pg/mL、(5.07±0.92)pg/mL,与正常组大鼠(9.69±3.28)pg/mL 相比明显降低,差异具有统计学意义(P<0.05)(图3D)。 提示肌肉注射CFA 后,在注射后第1 天可诱导发生全身性的炎性反应。

图3 CFA 注射对血浆中炎性因子含量的影响(±s,n=8)Note. Compared with control group, *P<0.05.Figure 3 Effect of CFA injection on the inflammatory factors levels in plasma
2.4 CFA 注射后对炎症局部组织结构、细胞形态的影响
基于细胞因子的结果,我们选择CFA 注射后第3天(去除CFA 注射后第1 天全身性炎性反应对局部炎症的影响)和第13 天的大鼠作为观察对象,使用HE 染色方法对局部组织结构、细胞形态进行观察。正常组大鼠股二头肌肌肉组织纹理清晰,结构正常,未见炎性细胞浸润。 造模后第3 天,可观察到注射CFA 后肌肉组织被大量中性粒细胞浸润,并出现一定数量的脓性空泡和肉芽肿。 CFA 注射后第13 天,浸润在肌肉组织中的细胞种类主要为以淋巴细胞为主的单核细胞,及少量的中性粒细胞(图4)。 通过细胞形态的差异推测发生于CFA 注射后第3 天的炎性反应是由固有免疫所介导的,而发生于CFA 注射后第13 天的炎性反应是由适应性免疫所介导的。

图4 各组大鼠局部组织病理改变(HE 染色)Note. A, Control group. B, MD3 group. C, MD13 group. A1, B1, C1 is the enlarged diagram of the black block area in the A, B, C diagram respectively.Figure 4 Local histopathological changes in rats in each group (HE staining)
2.5 CFA 诱导大鼠肌肉炎症中固有免疫和适应性免疫基因表达的比较
为了进一步比较CFA 诱导大鼠肌肉炎症中固有免疫和适应性免疫基因表达的差异,我们将取材于CFA 注射后第3 天和第13 天的组织样本进行了转录组测序分析。 首先为了证明实验的可重复性及评估结果的可靠性,我们对样本间RNA 相关性进行了分析。 由图5A 可见组内样本之间的表达模式相似度高,差异性小,具有可重复性。 在转录组中,获得基因表达量后,以Q value<0.05 标准对差异基因进行筛选。 在MD3 组大鼠与MD13 组大鼠之间确定了5661 个差异表达基因,包括2950 个上调基因和2711 个下调基因。 绘制火山图以展示差异显著性基因的整体分布情况(图5B)。
之后我们对差异基因集进行GO 功能富集分析和KEGG 通路富集分析,进一步揭示差异表达基因所参与的生物学功能。 由图可见,与CFA 注射后第3 天的炎症组织相比,第13 天的炎症组织中上调基因GO 富集的生物过程主要有免疫系统对抗原刺激的防御反应和处理过程、白细胞的激活等(图5C)。KEGG 富集分析结果显示差异基因参与了核糖体、细胞粘附分子、抗原加工和呈递、细胞因子-细胞因子受体相互作用、Th1 和Th2 细胞分化、T 细胞受体信号通路、NF-κB 信号通路、趋化因子信号通路等(图5D)。 说明第13 天的炎症组织中存在明显的抗原呈递、淋巴细胞分化并发挥效应的现象,这与适应性免疫的功能相符。

图5 RNA-Seq 分析Note. A, RNA correlation analysis between samples. Value within the square represent the correlation coefficient R2between the two samples. The closer R2value is to 1, higher the similarity of expression patterns between the samples. B, Heatmap of differential expressed genes. Abscissa indicates the expression of multiple genes in different samples (log2 fold change) and the ordinate indicates the significance of the difference in expression (-log10 Padj). C, GO enrichment analysis. Biological process involved in upregulated differentially expressed genes in the MD13 group compared to the MD3 group. D, KEGG enrichment analysis.Figure5 RNA-Seqanalysis
2.6 CFA 注射诱导的固有和适应性免疫应答中与痛敏相关基因表达的差异
研究人员继续对既往文献中确认炎性机械和热痛敏相关Ccl3 基因[17-18],进行蛋白质互作(protein protein interaction,PPI)网络分析。 在正常组与MD3 组和MD13 组相比的差异表达基因网络图中,分别鉴定出24 和30 个基因。 通过PPI 分析得到主要枢纽基因包括Ccl3、Cxcl1、Cxcl2、Cxcl9、Cxcl10 等(图6A、6B)。 利用上述基因定量分析所获得的FPKM(Fragments Per Kilobase of exon model per Million mapped reads)值,绘制热图以展示目的基因在各组的表达水平(图6C)。 由图可见CFA 注射后上述基因的表达水平均高于正常组大鼠。 其中与MD3 组大鼠相比,MD13 组大鼠局部组织中Cxcl9、Cxcl10 基因的表达水平明显升高,而Ccl3、Cxcl1 和Cxcl2 基因表达水平明显降低(图6D)。 固有和适应性免疫应答中与痛敏相关基因表达的差异,说明不同的免疫应答通过调节不同的趋化因子基因表达对疼痛的敏化发挥作用。

图6 PPI 网络分析与聚类热图Note. A, PPI network analysis of the Ccl3-related in the MD3 group. B, PPI network analysis of the Ccl3-related in the MD13 group. Larger volume indicates more gene junction points. C, High expression is shown in red, while low expression is shown in blue. D, Compared with the MD3 group,*P<0.05. **P<0.01.Figure 6 PPI network analysis and heatmap
3 讨论
本研究观察到肌肉注射CFA 可引起足底持续性的机械和热痛敏,造成局部组织明显的炎性反应。 其具体表现为外周血和炎症组织中IL-6、IL-1β和TNF-α 的水平在注射后24 h 显著升高,局部组织中此类促炎因子在注射后第13 天再次升高,说明在这两个时间均出现了明显的免疫反应[19]。 我们通过观察浸润在炎症组织中的细胞形态差异推测CFA 注射后第3 天的炎性反应是由固有免疫所介导的,而发生于注射后第13 天的炎性反应是由适应性免疫所介导的。 通过转录组测序分析,观察到相对于注射后第13 天,在CFA 注射后第3 天局部组织中与免疫反应相关的差异表达基因上调并增强免疫系统对抗原的处理和反应,其中涉及到Th 细胞的分化、细胞因子受体相互作用等重要生物学通路。 CFA 注射后局部组织中痛敏相关基因的表达水平升高,包括Ccl3、Cxcl1、Cxcl2、Cxcl9、Cxcl10 等基因。
在CFA 所诱导的固有免疫反应中,外周血和炎症组织中促炎因子主要由聚集到损伤部位的中性粒细胞所释放。 前哨白细胞(如巨噬细胞和树突状细胞)与病原体接触时表面toll 样受体识别并激活,从而产生炎性介质,包括血管活性物质(如组胺、5-羟色胺)和趋化因子[19]。 组织驻留和招募的免疫细胞在炎症局部分泌大量炎症介质(如IL-6、IL-1β、TNF-α),与伤害性感受神经末梢上相应的受体结合,激发伤害性感受神经元动作电位和降低动作电位阈值,导致疼痛敏感性或“痛觉过敏”[20]。 有研究表明足底内注射CFA 可明显降低后足对机械刺激和热刺激的痛阈值(3 h),同时炎症足中TNF-α、IL-1β 和NGF 水平显著升高。 在注射CFA 前1 h,足底注射抗TNF-α 血清能显著延迟炎症性痛觉过敏[21]。 随后激活的中性粒细胞释放出颗粒蛋白,促进单核-巨噬细胞向炎症病灶的募集与浸润[22],共同发挥以中性粒细胞为主导的吞噬、杀菌作用,来限制损伤或感染的范围,完成固有免疫反应[23]。 随着中性粒细胞的吞噬凋亡以及脓疱的形成[24],巨噬细胞对凋亡中性粒细胞的摄取促进脂质蛋白的产生,进而降低中性粒细胞活性,减少促炎趋化因子和细胞因子的合成[25]。 脂质蛋白抑制中性粒细胞进入炎症部位,防止白细胞的进一步浸润,并促进单核-巨噬细胞迁移,增强对凋亡细胞的摄取和清除,从而促使炎症的消退[26]。 这也解释了本研究观察到炎症组织中IL-6、IL-1β 含量在注射CFA 24 h后逐渐降低的现象。 而组织中TNF-α 水平保持升高,则是因为炎症部位的TNF-α 主要来源于巨噬细胞。
除了清除凋亡的中性粒细胞外,吞噬细胞(以及密切相关的树突状细胞)对病灶中的抗原进行摄取、吞噬和处理后,迁移到引流淋巴结并发育成熟,将抗原成分呈递给T 淋巴细胞[27]。 Th 细胞表面受体被DC 细胞以MHCⅡ类分子途径递呈的抗原性多肽激活,开始增值分化产生相同的Th 效应细胞[28-29],促进适应性免疫的发生。 本研究针对 CFA诱导的肌肉炎性痛模型大鼠在固有免疫和适应性免疫应答中基因表达水平的变化,对差异表达基因进行GO 功能和 KEGG 富集分析。 研究结果表明,差异表达基因主要参与了Th 细胞分化、Rap1 信号通路、NF-κB 信号通路和细胞因子受体相互作用等重要生物学通路。 随着免疫应答的进展,Th1 细胞受趋化因子诱导迁移到外周炎症部位,分泌细胞因子(主要为IL-2、IFN-γ 和LT),使巨噬细胞高度活化、吞噬作用增强,并上调附近其他抗原呈递细胞MHCⅡ类分子的表达[6]。 NK 细胞作为天然免疫细胞,能够通过释放细胞毒蛋白杀死感染和恶性细胞,以及产生细胞因子(IFN-γ 和TNF-α)来终止炎症[30]。 Th 细胞以特异性识别抗原,辅助NK 细胞、巨噬细胞清除并吞噬被感染的细胞宿主,发挥细胞免疫反应。 在炎症后期组织中TNF-α 主要来源于巨噬细胞和NK 细胞,而TNF-α 的释放增加又可以诱导组织中IL-6、IL-1β 水平升高[21]。
在CFA 诱导的不同免疫反应时期,免疫系统通过对调整基因的差异性表达来控制疼痛。 痛觉的感知依赖于伤害性信息从外周伤害性感受器神经元到脊髓二级中间神经元的有效传递。 其中脊髓背角是这些神经元之间发生联系的区域,对疼痛强度起着至关重要的控制作用[31]。 由于持续的炎性刺激使得伤害性感受器通过其中枢神经末梢表达和释放炎症介质到脊髓,包括三磷酸腺苷、降钙素基因相关肽和集落刺激因子1 等。 这些介质激活了中枢神经系统的常驻免疫细胞-小胶质细胞,使其产生炎症介质(如TNF-α、IL-1β 和前列腺素E2),从而诱导初级痛觉感受器神经元和二级疼痛介导的中间神经元过度兴奋(中枢敏化)[32]。 有研究观察到紫杉醇诱导的周围神经病变模型大鼠在后爪出现持久的机械痛和热痛超敏反应,同时伴随着脊髓背角中星形胶质细胞和小胶质细胞的激活,并在模型组大鼠的脊髓背角中鉴定出Ccl3 基因表达水平显著增加[33]。 小胶质细胞中Ccl3 基因的表达与紫杉醇诱导的机械性异常性疼痛有关,鞘内注射CCL3 中和抗体可显著减轻大鼠机械性痛觉超敏[18]。 在本研究中通过差异表达基因网络图分析Ccl3 基因,得到参与CFA 诱导的炎性痛敏机制的趋化因子家族基因。 我们注意到趋化因子家族基因在CFA 诱导的固有和适应性免疫应答中表达水平有所差异,将会在下一步的研究工作中继续关注。综上所述CFA 的注射可有效刺激免疫反应的发生,诱导炎性痛敏,其中趋化因子家族基因发挥了重要的作用。

