咪喹莫特致不同免疫状态小鼠银屑病模型比较研究
赵 亚吴亚运刘丽娟赵瑞芝*
(1.广州中医药大学第二附属医院,广州 510006;2.省部共建中医湿证重点实验室,广州 510006;3.广东省中医症候研究重点实验室,广州 510006)
银屑病是一种常见的慢性、炎症性表皮增殖性、无传染性的红斑鳞屑性皮肤病,其发病率高,是目前国内外皮肤科领域内的研究热点[1]。 然而,银屑病发病机制不清,导致银屑病的治疗目前主要还是对症治疗,复发率极高,且无法预防[2-3]。 目前普遍认为其发病机制主要是与T 细胞异常活化相关,其中辅助T 细胞Th1、Th17 及其相关因子IFN-γ、TNF-α、IL6、IL23、IL17 和IL22 等以及调节性T 细胞Treg 已先后发现成为影响银屑病的关键因子,然而,这些因子在银屑病中的具体作用机制并未完全阐明或存在争议[4-5]。 此外目前也有报道认为B 细胞、NK 细胞、中性粒细胞等其他免疫细胞介导的免疫功能紊乱在银屑病疾病进展过程中起着重要作用[6-7]。 然而其他免疫细胞是否与T 细胞对银屑病发病起着同样重要的作用,是否存在其他非免疫因素对银屑病发病有影响也值得深入探讨。
近年来,大量研究表明,不同疾病机体状态的单一或多种组织器官中ATP 酶活性能被疾病状态所影响,生理及病理的变化在一定程度上会影响机体内的ATP 酶的改变,从而影响ATP 酶催化ADP氧化磷酸化成ATP,进而影响机体的能量供给[8-10]。因此,研究疾病状态下ATP 酶活性有助于研究疾病的发病机制及临床用药。 ATP 酶与细胞功能,繁殖密切相关,而皮肤细胞过度增生是银屑病表现之一,且前期有文献报道银屑病病人红细胞中Ca2+Mg2+-ATP 酶活性下降,提示非免疫因素ATP 酶活性改变可能与银屑病发病相关[11]。
因此本文拟通过比较不同免疫状态小鼠Balb/c鼠(免疫细胞正常)、裸鼠(T 免疫细胞缺陷)和NOG小鼠(重度免疫细胞缺陷)在咪喹莫特诱导下皮肤和脾外观及组织病理变化的不同,及其ATP 酶活性变化研究探讨不同免疫细胞及非免疫因素对银屑病发病的影响,为银屑病发病机制的阐明提供实验依据。
1 材料和方法
1.1 实验动物
雄性SPF 级Balb/c 小鼠、裸鼠、NOG 小鼠各20只,体重18~22 g,由北京维通利华实验动物技术有限公司[SCXK(京)2021-0011]提供,大鼠饲养于广东省中医院SPF 级动物实验中心[SYXK(粤)2018-0094],饲养温度为(24±2)℃,相对湿度(60±10)%,采用12 h:12 h 昼夜间断照明,动物自由饮食饮水。 动物实验方案通过广东省中医院广东省中医药科学院试验动物伦理委员会审批(2014001),并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
咪喹莫特(四川明欣药业有限责任公司,20030128);超微量Na+K+、Ca2+Mg2+、总ATP 酶测试盒(南京建成生物工程研究所,20170228);BCA 蛋白浓度测定试剂盒(美国Thermo scientific 公司,ML166920);IL6、IL17、IL22、IL23 ELISA 试剂盒(美国Raybiotech 公司,EKL54698-BM,EKL54533-BM,EKL58293-BM,EKL58298-BM);氯化钠(天津市富宇精细化工有限公司,20160524)。 Saturius BS224S电子天平(北京赛多利斯科学仪器有限公司);VICTOR X5 酶标仪(美国PerkinElmer 公司);T10匀浆机(德国IKA 公司);Centrifuge 5430 离心机(德国Eppendorf 公司)。
1.3 实验方法
1.3.1 动物分组及药物诱导银屑病动物模型的建立
Balb/c 小鼠、NOG 小鼠、裸鼠各20 只适应性饲养1 周后均无异常后纳入实验。 每种小鼠随机分为模型和空白2 组,每组10 只,称重标记。 将鼠尾根部以上长3 cm、宽2 cm 长方形皮肤上被毛除去,模型组每日上午于小鼠背部涂抹5%咪喹莫特乳膏(每只50 mg),空白组不做任何处理。
1.3.2 取材及处理
每日拍照观察皮肤皮损情况,参照银屑病样皮损面积和疾病严重程度(PASI)评分标准进行评分。造模5 d 后,小鼠禁食不禁水12 h,称重,麻醉后处死。 取小鼠背部皮肤、脾,脾拍照称重,生理盐水冲洗皮肤和脾后分为2 份,1 份置于10%甲醛溶液固定用于HE 染色,另1 份置于-80℃保存,备用。
1.3.3 皮肤中炎症因子的测定
取皮肤50 mg,精密称定,按重量(g) ∶体积(mL)= 1 ∶9 的比例,加入预冷的9 倍体积蛋白裂解液,匀浆机下机械匀浆12000 r/min 离心5 min,取上清液,精密吸取100 μL 样品加入包被好抗体的96孔板,在室温下孵育2.5 h,弃孔中废液后洗涤;加入100 μL 二抗,孵育1 h,弃废液后洗涤;加入100 μL streptavidin-HRP 溶液,孵育45 min 后弃废液洗涤;加入100 mL TMB 后避光孵育30 min;加入终止液后使用酶标仪在450 nm 下检测,根据制作好的标准曲线计算各组蛋白表达量差异。 采用酶联免疫吸附法(ELISA)检测小鼠皮肤中IL6、IL17、IL22 及IL23 蛋白表达水平。
1.3.4 皮肤、脾中ATP 酶活力的测定
取皮肤和脾组织50 mg,精密称定,按重量(g):体积(mL)= 1 ∶9 的比例,加入预冷的9 倍体积的生理盐水,匀浆机下机械匀浆,低温高速离心机中2000 r/min 离心10 min,取上清液(即10%的匀浆上清液),再用生理盐水10 倍稀释成1%,制得组织混悬液。 严格按照超微量Na+K+-ATP 酶、Ca2+Mg2+-ATP 酶、总ATP 酶试剂盒说明书测定酶活力。
1.4 统计学方法
数据使用SPSS 20.0 统计软件处理,计量资料以平均数±标准差(±s)表示,P<0.05 表示具有显著性差异,两均数比较采用t检验。
2 结果
2.1 皮肤外观、病理组织切片比较
由图1A 可见,空白组动物均皮肤光滑,颜色正常;而造模组在涂抹咪喹莫特5 d 后,Balb/c 小鼠出现皮肤粗糙、红色,起皱,触之变硬伴斑片、严重起皮、脱屑;裸鼠粗糙、红色,起皱,触之变硬,部分起皮;NOG 小鼠皮肤红色,起皱,皮肤稍硬,少量起皮。3 种小鼠造模组PASI 评分均显著高于空白对照组(P<0.05,P<0.01),且按评分从高到低排序为Balb/c 小鼠>裸鼠>NOG 鼠(见图1B)。

图1 咪喹莫特诱导银屑病3 种动物模型皮肤形态学改变及PASI 评分Note. Compared with the blank group, **P<0.01.Figure 1 Skin morphological changes and PASI score of three animal models of psoriasis induced by imiquimod
皮肤HE 染色结果显示空白组颗粒层完整,棘层较薄、基底整齐,真皮层小血管正常;3 种模型小鼠均出现角化过度或角化不全,棘层明显增厚,颗粒层细胞减少或排列异常,真皮层小血管增生、扩张,真皮乳头向下突出,炎细胞浸润现象,且Balb/c小鼠角质层中可见Munro 小脓疡,按病理严重程度排序为Balb/c 小鼠>裸鼠>NOG 鼠(见图2)。

图2 咪喹莫特诱导银屑病3 种动物模型组织病理改变(HE 染色)Figure 2 Histopathological changes of three animal models of psoriasis induced by imiquimod(HE staining)
2.2 皮肤中炎症因子水平比较
与空白组比较,Balb/c 小鼠、裸鼠、NOG 小鼠模型组皮肤中IL6 蛋白表达水平均显著升高,依次为81.7%、39.4%和37.5%(P<0.05,P<0.01)(见图3A);IL17A 蛋白表达水平也均显著升高,依次为41.0%、43.8%和46.4%(P<0.05,P<0.01)(见图3B);IL22 蛋白表达水平均有升高,依次为41.0%,24.4%和18.9%,但仅Balb/c 小鼠模型组差异具有显著性(P<0.05)(见图3C);IL23 蛋白表达水平也均显著升高,增加幅度依次为53.3%、63.7%、66.4%(P<0.05)(见图3D)。
2.3 脾外观、脾指数和病理组织切片比较
我们接着观察了3 种小鼠造模前后脾外观和病理学变化。 如图3A 所示,我们观察到与正常组比较,Balb/c 小鼠、裸鼠、NOG 小鼠模型组的脾均明显增大,脾指数结果显示其脾指数增加幅度依次为200.0%、102.2%、118.2% (P<0.01) (见图4A、4B)。 脾病理学结果显示正常Balb/c 小鼠脾红、白髓结构清晰,生发中心清晰可见。 与Balb/c 小鼠比较,正常裸鼠脾白髓中中央动脉周围淋巴细胞大量减少,白髓区相对变小,正常NOG 小鼠脾白髓萎缩,淋巴细胞严重缺失。 与正常组比较,Balb/c 小鼠和裸鼠模型组脾中白髓均明显增大,生发中心不可见,红髓区扩张充血,NOG 小鼠模型组白髓区无明显变化,红髓区扩张充血(见图4C)。

图3 咪喹莫特诱导银屑病3 种动物模型皮肤中IL6、IL17A、IL22 和IL23 蛋白水平比较Note. Compared with the blank control group, *P<0.05, **P<0.01.Figure 3 Comparison of IL6, IL17A, IL22 and IL23 protein levels in the skin of three animal models of psoriasis induced by imiquimod
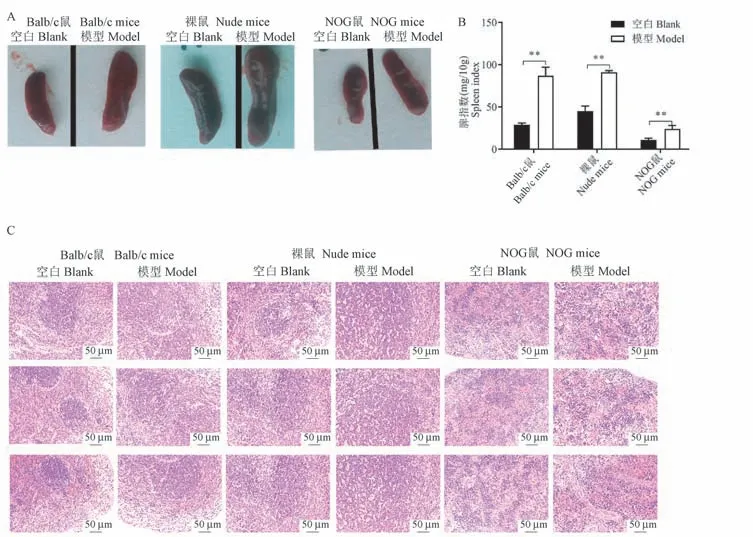
图4 咪喹莫特诱导银屑病3 种动物模型脾外观、脾指数和病理组织切片比较Note. Compared with the blank control group, **P<0.01.Figure 4 Comparison of spleen appearance, spleen index and pathological sections in three animal models of psoriasis induced by imiquimod
2.4 皮肤和脾中ATP 酶活力比较
与空白组比较,Balb/c 小鼠、裸鼠模型组皮肤中Na+K+-ATP 酶活力显著下降,下降幅度依次为41.7%和20.0%(P<0.05)(见图5A);Balb/c 小鼠、裸鼠、NOG 小鼠模型组皮肤中Ca2+Mg2+-ATP 酶活力均显著下降,下降幅度依次为40.7%、34.3%和14.2%(P<0.05,P<0.01)(见图5B)。
与空白组比较,Balb/c 小鼠、裸鼠、NOG 小鼠模型组脾中Na+K+-ATP 酶活力均略有降低,但无显著性(见图5C);但3 种小鼠模型组脾中Ca2+Mg2+-ATP 酶活力均显著下降,下降幅度依次为55.6%、6.8% 和17.5%(P<0.05)(见图5D)。
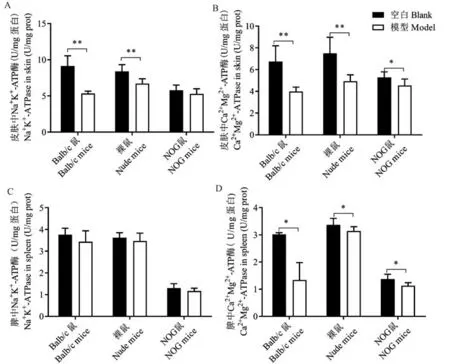
图5 咪喹莫特诱导银屑病3 种动物模型皮肤和脾中ATP 酶活力比较Note. Compared with the blank control group, *P<0.05, **P<0.01.Figure 5 Comparison of ATPase activities in skin and spleen of three animal models of psoriasis induced by imiquimod
3 讨论
银屑病是常见的以鳞屑性红斑为临床特点的慢性复发性炎症性皮肤病,通常认为其为免疫介导的器官特异性自身免疫性疾病。 本研究采用咪喹莫特对3 种不同免疫状态小鼠诱导银屑病模型由结果可知,3 种小鼠都出现了银屑病病变现象,皮肤外观显示3 种小鼠均出现皮肤红色,起皱,但免疫细胞无缺失的Balb/c 小鼠模型组皮肤还显著变硬伴斑片、严重起皮、脱屑;T 细胞缺失的裸鼠皮肤变硬,部分起皮,重度免疫缺陷的NOG 小鼠皮肤稍变硬,仅少量起皮或不起皮。 3 种动物比较,Balb/c 小鼠银屑病样模型症状更严重,银屑病样皮损更典型,其次为裸鼠,再次为NOG 小鼠。 PASI 评分比较,Balb/c 小鼠远高于裸鼠和NOG 小鼠,裸鼠稍高于NOG 小鼠。 病理切片结果显示3 种动物模型均出现角化过度或不全,棘层增厚,真皮乳头向下突出,炎细胞浸润等现象,但与皮肤外观形态改变一致,Balb/c 小鼠的各项病理指标变化较裸鼠和NOG 小鼠更显著。 3 种模型动物各炎症因子水平均升高,3种动物之间IL17 和IL23 因子水平差异不明显,但IL6 和IL22 变化趋势与外观形态和病理切片结果一致,Balb/c 小鼠>裸鼠>NOG 小鼠,以上结果均表明体内有T 细胞的Balb/c 小鼠比体内T 细胞缺失的裸鼠和NOG 小鼠更易诱导为典型的银屑病样症状,提示T 细胞在银屑病发病中起最为关键的作用,且银屑病的诱发是多种T 细胞相关因子综合作用的结果。 此外仅T 细胞缺失的裸鼠比重度免疫缺陷的NOG 小鼠银屑病样症状显著,提示其它免疫细胞活化也对银屑病发病有促进作用。 而由于重度免疫缺陷NOG 小鼠仍然可以诱发出银屑病,提示在银屑病发病过程中还存在一些非免疫因素的刺激因素。 脾是体内最大的免疫器官,主要由白髓和红髓组成,其中白髓由密集的淋巴细胞构成,特别是T细胞和B 细胞,分别占25%和55%,是机体发生特异性免疫的主要场所[12]。 本实验结果显示3 种小鼠的脾均明显变大,病理结果显示造模后Balb/c 小鼠和裸鼠的白髓区明显增大,其中淋巴细胞明显增多,进一步证实免疫细胞特别是T、B 细胞活化是银屑病发病的重要因素。 但是NOG 模型小鼠的白髓与正常组相比无明显差异,但与其余2 种模型小鼠一样出现了红髓扩张充血现象,红髓储血、滤血的主要场所,当滤血功能异常时,机体内异物与毒素的排出受到阻碍,该结果也进一步提示存在一些非免疫细胞活化因素与银屑病发病有关。
ATP 是体内组织细胞一切生命活动所需能量的直接来源,被誉为细胞内能量传递的“分子货币”,用来储存和传递化学能。 ATP 酶是一类介导主动转运的膜蛋白,可将细胞内的 ATP 水解为ADP,利用高能磷酸键贮存的能量完成离子的跨膜转运,其中重要的是 Na+K+-ATP 酶和Ca2+Mg2+-ATP酶[13]。 当Na+K+-ATP 酶和Ca2+Mg2+-ATP 酶活性降低时,细胞内Na+和Ca2+外流减少,胞浆内Na+和Ca2+大量积累它打破了生物膜上跨膜转运的平衡,进而影响物质的交换和毒素的排出[14]。 我们的研究显示3 种银屑病模型小鼠皮肤和脾中Ca2+Mg2+-ATP 酶和Na+K+-ATP 酶活性均降低,提示机体内物质交换以及毒素排出受到了阻碍,该结果与脾病理结果中红髓功能可能存在异常的结果相符,而其中深入的内在机制有待进一步研究。
综上可见,本实验通过采用咪喹莫特对3 种不同免疫状态小鼠诱导银屑病模型,整体直观的验证了T 细胞异常活化在银屑病发病中关键性的作用,但其他多种免疫细胞活化也在银屑病发病中有重要作用,此外在后续研究中我们还需关注可能诱导银屑病发病的非免疫因素,有助于银屑病发病机制的全面深入阐明。

