天门冬水提物对人结肠癌细胞增殖、凋亡、迁移的影响
赵嘉宁梁惠玲杨 姁李艳菊王飞清陶奕汐王 琨严雪梅刘 洋*
(1.贵州中医药大学,贵阳 550025;2.贵州医科大学,贵阳 550004;3.贵州中医药大学第一附属医院,贵阳 550001)
结直肠癌是消化系统高发的恶性肿瘤,由于其起病较隐匿、发病时多已属中晚期,预后较差。 据最新全球癌症数据统计显示,结直肠癌是男性第三、女性第二高发肿瘤,一般人群累计终生风险为5%,恶性致死率排名第三[1-2]。 在中国,结直肠癌死因排位上升到第5 位,且呈年轻化趋势[3],这给患者、家庭乃至整个国家带来了巨大的身体和经济负担[4]。 众所周知,化学疗法的毒副反应较大,而新兴的靶向治疗方法面临耐药性和价格昂贵的严峻挑战,因此,开发具有多种化学结构和药理作用的天然抗肿瘤药物与治疗肿瘤疾病需求的殷切期盼不谋而合[5]。 天门冬是百合科植物天冬(asparagus cochinchinensis (Lour) Merr)的块根[6],是我国一种传统中草药,《神龙本草经》将其归为上品,记载此药主风湿偏痹,强骨髓,杀三虫,去浮尸,言久服轻生益气延年,当代临床常用于治疗阴虚发热、咳嗽吐血、肺痈、咽喉肿痛、消渴、便秘等病症。近年来国内外研究从天门冬分离出天门冬素、甾体皂苷、低聚糖和多糖类等多种成分[7-8],据文献报道这些成分具有抗炎、抗氧化、增强免疫力、抗肿瘤活性等药理作用,且几乎对人体没有毒副反应[9-11]。目前有关天门冬抗肿瘤作用的研究主要集中在单体及粗提物通过诱导肿瘤细胞凋亡、周期阻滞,抑制其增殖、迁移、肿瘤生长,延长荷瘤小鼠生存期等方面[12-15],然而有关天门冬对人结直肠癌HCT116细胞的影响报道尚属空白。 本研究评价了天门冬水提取物对人结肠癌HCT116 细胞的增殖、迁移、侵袭的抑制及促进凋亡等作用效果,旨为天门冬的开发和应用提供依据。
1 材料和方法
1.1 细胞
人结肠癌HCT116 细胞系由中国科学院上海细胞生物所提供。
1.2 主要试剂与仪器
天门冬(贵阳济仁堂药业有限公司);高糖DMEM 细胞培养基(美国 GIBCO 公司, 批号2200905); 胎牛血清(以色列 BI 公司, 批号1706126);PBS 缓冲液(北京索莱宝公司,批号422R023);青/链霉素混合液(北京索莱宝公司,批号 20201023);胰酶细胞消化液(南京碧云天公司,批号 70120500);二甲基亚砜(北京索莱宝公司,批号 710N0317);4%多聚甲醛(北京索莱宝公司,批号70085400);结晶紫染料(北京索莱宝公司,批号20191119);细胞增殖-毒性检测试剂盒CCK-8(日本同仁公司);EdU/Hoechst 33342 试剂盒(广州锐博公司,批号 S0626);Annexin V-FITC 细胞凋亡检测试剂盒(南京凯基生物科技公司, 批号20210727);逆转录试剂盒、荧光定量PCR 检测试剂盒(北京全式金生物技术有限公司);氯仿、异丙醇、无水乙醇(国药集团化学试剂有限公司);引物合成、DEPC 处理水(上海生物工程有限公司)。
CO2恒温培养箱、酶标仪(美国 Thermo 公司);超净工作台(上海博讯实业有限公司);低速离心机、微量移液器(德国Eppendorf 公司);流式细胞分析仪(美国BD 公司);倒置显微镜、荧光显微镜BX53(日本Olympus 公司);PCR 扩增仪(北京东胜创新生物科技有限公司);6 孔培养板、48 孔培养板、96 孔培养板、Transwell 小室(美国Corning 公司)。
1.3 实验方法
1.3.1 天门冬水提取物制备
精密称取天门冬饮片50 g,加10 倍体积水称重,浸泡2 h,回流提取2 次,每次1 h,抽滤,合并滤液,用水补足减少的重量,药液在70℃减压浓缩,浓缩至含生药1 g/mL 浓度,取浓缩液2 mL 加水稀释至10 mL,1000 r/min 离心5 min,上清液用0.22 μm微孔滤膜过滤,滤液分装于无菌离心管,置于-20℃冰箱中保存备用。 天门冬水提取物的制备方法参考了先前的研究[16-17]。
1.3.2 细胞培养
将人结肠癌HCT116 细胞培养于添加100 U/mL 青霉素、100 U/mL 链霉素、10%胎牛血清的高糖DMEM 培养基,置于37℃、5% CO2的恒温加湿培养箱中培养,2~3 d 以1 ∶3 的比例传代1 次。 取对数生长期的细胞用于后续实验。
1.3.3 CCK-8 检测天门冬水提取物对人结肠癌细胞HCT116 增殖的影响
取生长状态良好的HCT116 细胞接种于96 孔板中,接种密度为6×103个/孔,置于37℃、5% CO2的培养箱中培养,待细胞完全贴壁生长后,去除原培养基,添加含不同浓度的天门冬水提取物的完全培养基,各组对应浓度分别为25、50、100、150、200 μg/mL,并设置空白对照组(control),每个药物浓度设6 个复孔,96 孔板周围一圈均每孔加入200 μL PBS 溶液,培养24、48 或72 h,换液,每孔加入含10% CCK-8 的完全培养基100 μL,培养箱中继续孵育4 h。 用酶标仪测定450 nm 波长处的OD 值。 实验重复3 次,记录每块板的数值,并计算IC50及抑制率。
细胞增殖抑制率=(1-实验组吸光度值/对照组吸光度值)×100%
1.3.4 结晶紫染色
待细胞生长至70%~90%融合度时,消化收集细胞,按细胞密度为每毫升1×105个的要求在6 孔细胞培养板进行接种,37℃,5%的CO2细胞培养箱培养24 h,待细胞融合度达50%时开始加药,以完全培养基作为空白对照组,分别加入50、100、200 μg/mL(依据CCK-8 实验结果确定此浓度为余下实验设计浓度)天门冬水提取物的完全培养基作用24 h。 PBS 洗涤2 遍,4%多聚甲醛固定20 min,PBS 洗涤2 遍,1%结晶紫染色15 min,自来水洗去多余结晶紫染料,室温自然晾干后在倒置显微镜下对细胞形态变化进行观察分析、拍照。
1.3.5 集落形成实验
将细胞密度为700 个/孔生长状态良好的HCT116 细胞接种到6 孔板中,37℃,5%的CO2细胞培养箱培养24 h,吸弃旧培养基,给药组分别加入含50、100、200 μg/mL 浓度天门冬水提取物培养基,对照组加入完全培养基,每3 d 换液1 次,待细胞集落形成合适大小时(药物处理14 d),吸弃条件培养基,PBS 洗涤2 次,然后将细胞集落固定在4%多聚甲醛中20 min,弃液后PBS 洗涤2 次,结晶紫溶液染色15 min,吸弃染色液,PBS 洗涤2~3 次,室温自然晾干,用光镜计数含有50 个以上细胞的集落数。实验重复3 次。
1.3.6 EdU 染色检测细胞DNA 合成率
将生长对数期细胞按每毫升2×104个细胞悬液接种在48 孔板中,待细胞贴壁且融合度达50%时,吸弃旧培养基,添加含50、100、200 μg/mL 天门冬水提取物的完全培养基,对照组添加完全培养基,继续培养24 h,加入1000 ∶1 浓度的EdU 标记液在37℃温箱内孵育2 h。 PBS 洗涤细胞2 次,4%多聚甲醛中固定30 min,2 μg/mL 甘氨酸溶液中摇床孵育5 min,PBS 洗涤5 min,0.5% TritonX-100 摇床10 min,PBS 洗涤5 min,荧光染料避光孵育30 min,PBS 每次洗涤10 min,共3 次。 然后用倒置荧光显微镜成像。 实验重复3 次,并对每个孔中至少10 个来自3 个位置的细胞进行拍照、分析。
DNA 合成率=(红色荧光细胞数/蓝色荧光细胞数)×100%
1.3.7 Annexin V-FITC/PI 双染法检测细胞凋亡率
选取生长状态良好的HCT116 细胞消化并计数,按为每毫升1×105个细胞密度求接种于6 孔板中,放入CO2孵箱中培养24 h。 根据实验分组设计加入相应药物浓度的条件培养基,药物作用24 h 后使用不含EDTA 的胰酶消化,消化时间不宜过长,2000 r/min 离心5 min,收集细胞,并用预冷的PBS缓冲液洗涤细胞2 次,每个样品管加入500 μL Binding Buffer 重悬细胞,加入Annexin V-FITC/PI荧光染料,避光反应5 min 后,利用流式细胞仪分析结果。 实验重复3 次,FlowJo 10.0 软件分析细胞凋亡率。
1.3.8 伤口愈合试验
用伤口愈合法测定细胞迁移率,将2×105个/孔细胞接种到6 孔板上,在37℃温箱、完全培养基中培养24 h。 天门冬水提取物与不含FBS 的新鲜培养基配置成实验设计浓度,将单层划伤,分别在不同药物浓度环境中孵育24 h。 在倒置显微镜下拍摄了6 个不同的位置,实验重复3 次。 用Image J 软件分析伤口面积。
1.3.9 Transwell 侵袭试验
将各浓度组处理24 h 并饥饿24 h 的HCT116细胞(5×104个/孔)重悬于200 μL 的无FBS 高糖DMEM 培养基中,接种到上室内(有基质凝胶涂层膜),下室加入600 μL 含20%FBS 完全培养基,孵育24 h 后,用棉签从膜上表面取出未侵入的细胞,侵入细胞固定,结晶紫染色,倒置显微镜拍照,每组随机6 各视野。 实验重复3 次,Image J 软件计数。1.3.10 Real-time PCR 检测p53、Bax基因表达
取生长对数期HCT116 细胞按实验设计药物浓度组接种细胞于6 孔板中,每组3 个复孔,处理24 h。 用预冷的PBS 洗涤细胞2 次,TRIzol 法提取总RNA,按TRIzol 试剂说明书进行操作,紫外分光光度计测定RNA 溶液浓度和纯度。 取总RNA 1 μL按要求逆转录为cDNA 循环进行扩增。 再以此为模版,按25 μL 体系进行PCR 反应。 以GAPDH 基因为内参,反应条件为:95℃ 5 s,59℃ 20 s,72℃20 s,40 cycles。 Melt curve:95℃ 5 s,65℃ 5 s,60 cycles。 结果通过PCR 仪记录的Ct 值对起始模板相对定量分析,每个样本设3 个复孔,重复3 次。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据处理,用Graph Pad Prism 8 软件进行统计作图。 数据结果用平均数±标准差(±s)表示,获得数据分析为正态性分布,多组间比较采用单因素方差分析,当P<0.05视为差异有统计学意义。
2 结果
2.1 天门冬水提取物抑制HCT116 细胞的增殖
CCK-8 法检测天门冬水提取物对HCT116 细胞活性的影响,结果如(图1)所示,天门冬水提取物以浓度和时间依赖性方式抑制HCT116 细胞的活性,且差异均具有统计学意义(P<0.01)。 通过Graph Pad Prism 8 软件计算其24 h 半抑制浓度IC50为(200.17±12.08)μg/mL,结果表明天门冬水提取物在24 h 已发挥抑制HCT116 细胞生长的作用,接下来我们的实验均采取天门冬水提取物浓度为50、100、200 μg/mL,以0 μg/mL 作为空白对照组,处理时间为24 h 的干预条件。

图1 各组细胞12~72 h 细胞存活率Note. Compared with the control group, **P<0.01.Figure 1 12~72 h cell survival rate of cells in each group
结晶紫染色观察到随着天门冬水提取物浓度的增加,细胞数量逐渐减少,贴壁不牢,细胞皱缩,出现不同程度的核固缩,细胞核内空泡化(图2)。
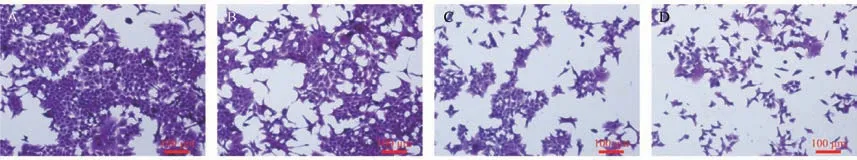
图2 天门冬水提取物对HCT116 细胞形态的影响Note. A, Control group. B, Asparagus 50 μg/mL. C, Asparagus 100 μg/mL. D, Asparagus 200 μg/mL.Figure 2 Effect of the water extract of asparagus on HCT116 cells morphology
集落形成试验结果表明,药物组的集落数明显低于空白对照组(图3),且差异均具有统计学意义(P<0.01),提示天门冬水提取物对HCT116 细胞的集落形成能力有明显抑制作用。
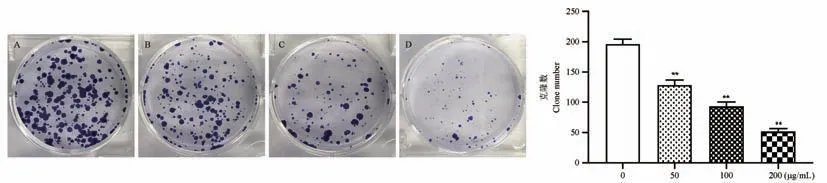
图3 各组细胞克隆形成能力比较Note. A, Control group. B, Asparagus 50 μg/mL. C, Asparagus 100 μg/mL. D, Asparagus 200 μg/mL. Compared with the control group, **P<0.01.Figure 3 Comparison of cell clone formation ability in each group
EdU/Hoechst 33342 荧光双染法结果如(图4)所示,在天门冬水提取物中培养24 h 的细胞数量与对照组相比随浓度梯度显著减少,EdU 相对荧光强度百分率随浓度增加显著降低,且差异均具有统计学意义(P<0.05)。 表明天门冬水提取物对HCT116细胞的DNA 合成能力有明显抑制作用。

图4 各组EdU 阳性细胞率比较Note. A, Control group. B, Asparagus 50 μg/mL. C, Asparagus 100 μg/mL. D, Asparagus 200 μg/mL. Compared with the control group, *P<0.05, **P<0.01.Figure 4 Comparison of EdU positive cell rate in each group
2.2 天门冬水提取物促进HCT116 细胞的凋亡
流式细胞术检测分析结果表明,50、100、200 μg/mL 的天门冬水提取物均可促进HCT116 细胞凋亡,且呈浓度依赖性,总凋亡率分别为(4.20 ±0.19)%、(6.68 ± 0.04)%、(12.45 ± 0.17)%,与对照组比较差异均具有统计学意义(P<0.01),其中早期凋亡率较对照组增加,且差异均具有显著统计学意义(P<0.05),晚期凋亡率与对照组相比,100、200 μg/mL 组差异具有统计学意义(P<0.01)(图5)。
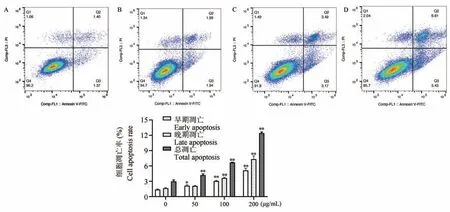
图5 各组细胞凋亡比较Note. A, Control group. B, Asparagus 50 μg/mL. C, Asparagus 100 μg/mL. D, Asparagus 200 μg/mL. Compared with the control group, *P<0.05, **P<0.01.Figure5 Comparisonofapoptosisofcellsineachgroup
Real-time PCR 结果表明,随着天门冬水提取物浓度的增加,凋亡相关基因p53、Bax的mRNA 表达水平升高,与空白对照组比较,100、200 μg/mL 组差异具有显著的统计学意义(P<0.01)(图6)。

图6 各组细胞中p53、Bax 基因mRNA 表达水平变化Note. Compared with the control group, **P<0.01.Figure 6 Changes in the expression of mRNA levels of p53 and Bax genes in cells of each group changed
2.3 天门冬水提取物抑制HCT116 细胞的迁移和侵袭
天门冬水提取物处理HCT116 细胞24 h 后,伤口愈合实验检测结果显示,划伤24 h 后,随着药物浓度的增加,其迁移率逐渐降低,具体结果如(图7)所示,各浓度组与control 组比较均具有统计学差异(P<0.01)。 提示天门冬水提取物能抑制HCT116细胞的迁移能力。
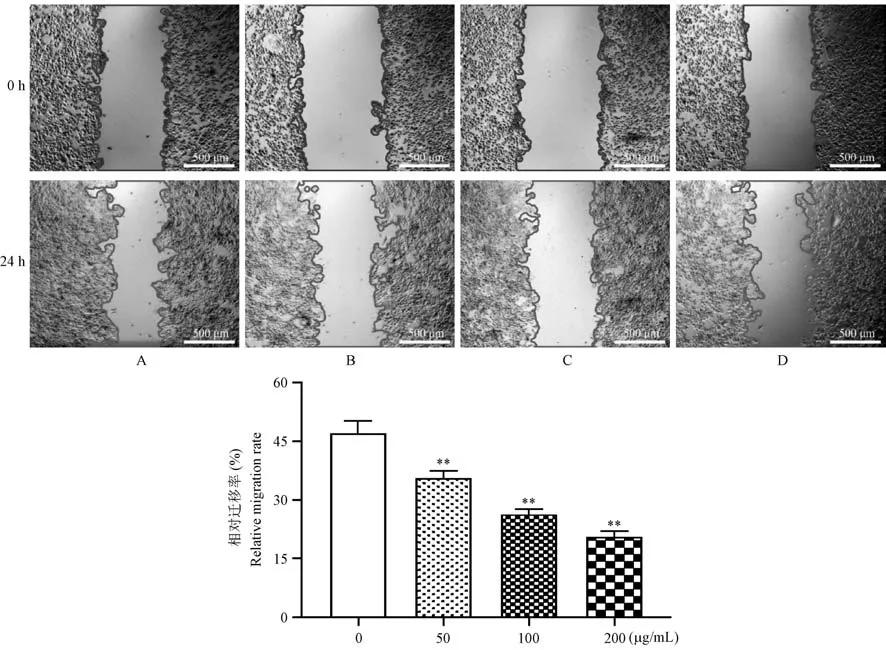
图7 天门冬水提取物对HCT116 细胞迁移能力的影响Note. A, Control group. B, Asparagus 50 μg/mL. C, Asparagus 100 μg/mL. D, Asparagus 200 μg/mL. Compared with the control group, **P<0.01.Figure 7 Effect of asparagus on the migration ability of colon cancer HCT116 cell
Transwell 侵袭试验结果表明,不同浓度的天门冬水提取物均能抑制HCT116 细胞的侵袭能力,且呈现剂量依赖关系。 统计学分析显示在HTC116 细胞侵袭能力方面,各天门冬水提取物浓度组与control 组之间比较存在统计学差异(P<0.01)(图8)。

图8 天门冬水提取物对HCT116 细胞侵袭能力的影响Note. A, Control group. B, Asparagus 50 μg/mL. C, Asparagus 100 μg/mL. D, Asparagus 200 μg/mL. Compared with the control group, **P<0.01.Figure 8 Effect of asparagus on the invasion ability of colon cancer HCT116 cell
3 讨论
结直肠癌的形成是一个复杂的过程,中医学认为,大抵是患者正气亏损,邪毒侵袭,导致气滞、痰凝、湿聚等病理变化所致,是一个整体为虚,局部为实的全身性疾病。 临床研究发现结直肠癌患者大多出现免疫抑制[18],这种免疫功能紊乱可对应中医“正气虚损”的微环境。 基于此,扶正法是中医理论中非常重要的治疗大法,刘嘉湘教授主张[19]“扶正治癌”,认为准确辨证、严守病机,立足扶正,据实祛邪,把握疾病的主要矛盾和矛盾的主要方面,让扶正与祛邪有机结合,如此可掌握治疗肿瘤的主动权。 所以近年来益气扶正类中药在恶性肿瘤治疗中的研究与应用越来越受到重视[20-22]。
天冬始载于《神农本草经》,包含天门冬素、甾体皂苷、低聚糖和多糖类等多种成分[6-7],具有清热、养肺肾阴的功效。 天冬除了显著的抗炎、抗氧化、增强免疫力等作用,亦被发现具有抗癌活性。临床常采用以天门冬等中药组成的复方治疗恶性肿瘤性疾病[23],其能够发挥稳定病灶、改善生存质量及延长生存期等功效。 研究发现天门冬皂苷提取物对结直肠癌细胞[24]有显著的细胞毒性作用,Bousserouel 等[13]结果更详细地表明,ASP 的甲醇提取物可以通过激活人结肠腺癌细胞SW480 和SW620 的TRAIL 死亡受体通路诱导细胞凋亡。 程伟[25]研究表明天冬多糖体在外常氧和缺氧下可抑制人肝癌细胞(SK-Hep1 和Hep-3B) HIF1α 和VEGF 表达,从而抑制人肝癌细胞(SK-Hep1 和Hep-3B)增殖、迁移、侵袭和血管形成。 本课题以天门冬水提物为研究对象,因前期药物分析发现,天门冬水提物主要活性成分包括总皂苷、多糖、槲皮素、β-谷甾醇和7-甲氧基-2-甲基异黄酮,故天门冬水提物可能具有多效协同抑制结直肠癌增殖的作用,且天门冬水提物获取程序较简化,易于临床广泛推广[26]。
本研究采用人结直肠癌HCT116 细胞为载体,通过CCK-8 法、集落形成实验、EdU 荧光染色法检测天门冬水提取物对HCT116 细胞增殖的影响,结果表明,天门冬水提取物可有效抑制HCT116 细胞增殖,并呈一定的时间和浓度依赖性。
细胞凋亡又称细胞程序性死亡(programmed cell death,PCD),在大多数恶性肿瘤发病学上占有重要地位。 Liu 等[27]用流式细胞术进行细胞凋亡分析,评价天门冬皂苷G(7)对细胞凋亡的影响,结果显示,随着天门冬皂苷浓度的增加,肺癌细胞NCIH460 的凋亡细胞的百分比增加,天门冬皂苷可呈剂量依赖性地促进人大细胞肺癌细胞系NCI-H460 的凋亡,从而发挥抑制肿瘤细胞增殖的作用。 本研究采用流式细胞术检测天门冬水提物对HCT116 细胞的抑制作用,结果显示经天门冬水提物处理后,细胞凋亡率随浓度升高而升高。 另外,通过伤口愈合实验和Transwell 侵袭实验模拟HCT116 细胞的侵袭迁移状况,结果显示天门冬水提取物干预HCT116细胞后,迁移距离减少,细胞侵袭穿过小室的细胞数目明显减少。 提示天门冬水提物可诱导HCT116细胞发生凋亡,并以浓度依赖方式明显抑制人结肠癌HCT116 细胞增殖、迁移和侵袭。
p53 基因是肿瘤领域研究最为广泛的基因之一,大多数人类肿瘤与其变化有关[28]。Bax是Bcl-2 基因家族的成员,通过剪切露出BH3 结合域,释放细胞色素C,激活细胞内Caspase 酶原,其表达量增多往往导致细胞凋亡加速[29]。 近年研究发现,Bax基因是p53 的转录靶标[30],Bax基因表达上调可能是由激活的p53 诱导的。 薯蓣皂苷元是天冬抗肿瘤的活性成分,有研究表明其能抑制乳腺癌生存和增殖,主要是通过增强p53 蛋白表达,抑制核因子-κB(NF-κB)与DNA 结合和p38 有丝分裂原活化的蛋白激酶(MAKP)的活化,诱导细胞凋亡[31]。 本研究发现,天门冬水提物可上调HCT116 细胞p53和Bax的mRNA 表达水平,提示天门冬水提物可调控凋亡相关因子,促进HCT116 细胞的凋亡,且其对信号分子的调控具有一定的剂量依赖性趋势。
中药复方现代研究中,由于水与乙醇的极性不同,醇提取物和水提取物有效成分的含量、种类存在差异[32],考虑到醇提法的成本及对工人的毒性,本研究以水作为提取溶剂,提高提取效率的同时的保留了天冬中的多糖和总氨基酸等活性成分,在诱导结肠癌肿瘤细胞凋亡,抑制肿瘤细胞增殖方面,取得了较好的结果[33-35]。 本实验以人结肠癌肿瘤细胞系HCT116 为研究对象,通过CCK-8 实验、细胞凋亡率及凋亡相关基因p53、Bax表达的检测,发现:一定浓度的天门冬水提取物能够上调HCT116 结肠癌细胞p53、BaxmRNA 的表达、诱导HCT116 结肠癌细胞凋亡,降低其迁移、侵袭能力,具有较好的抗肿瘤潜力,其机制可能与上调Bax、p53 的表达有关,进而为扶正类中药水提物治疗结肠癌提供一定的实验依据,为其后期的研究与开发奠定基础。

