白毛乌蔹莓化学成分及抗类风湿性关节炎活性研究
彭伊玲,张在其,李明姣,余黄合,姚 旺,易刚强,李 斌*,王 炜
1湖南中医药大学药学院 中医药民族医药国际联合实验室,长沙 410208;2湖南医药学院侗药湖南省重点实验室,怀化 418000
白毛乌蔹莓隶属于葡萄科(Vitaceae)乌蔹莓属(CayratiaJuss),该属约45种,广泛分布于亚洲,非洲及大洋洲等世界各地,中国约有16种,主要分布在我国江西、浙江、福建、湖北、湖南、广东、广西、四川、贵州、云南等地区,生于海拔300~2 000 m的山谷林中或山坡岩石上[1]。乌蔹莓属植物通常具有清热解毒,活血散瘀,利尿的功效,在民间多被用于咽喉肿痛、痢疾、痈肿、跌打肿痛、毒蛇咬伤等证的治疗,也常被用于治疗风湿性疾病、泌尿系统感染、口腔疱疹等疾病[2]。现代药理研究显示乌蔹莓属植物具有抗菌、抗炎、抗病毒和抗肿瘤活性,本属植物主要含有黄酮类、甾体、脂类、萜类、挥发油等化学成分[3,4]。在湖南湘西北侗族聚居区,由于复杂的地势环境和独特的气候环境,使得侗族人民在与自然环境和疾病的斗争中积累了丰富的用药经验,并形成了独特的侗医药体系。白毛乌蔹莓作为常用侗药,被称为“教美姑”或“教眉库”,其干燥地上部分被长期用于治疗类风湿性关节炎,疗效确切,具有很大的开发前景,但目前尚未查到白毛乌蔹莓化学成分与现代药理活性研究的相关报道。为了更合理地开发利用该植物资源,充分发挥其药用价值,本实验对其化学成分及体外抗类风湿性关节炎活性作用开展了研究,以期为白毛乌蔹莓的进一步开发和临床应用提供有利的科学参考。
1 材料与方法
1.1 仪器与材料
N-1300旋转蒸发仪(上海爱朗仪器有限公司);6470LC/TQ型质谱仪(安捷伦公司);BRUKER-600超导核磁共振仪(Bruker公司);HAD496酶标仪(北京恒奥德仪器有限公司);Micro17R高速冷冻离心机(赛默飞世尔科技有限公司);AL204分析天平(瑞士苏黎世的梅特勒-托利多集团);二氧化碳细胞培养箱(赛默飞世尔科技有限公司)。
薄层色谱硅胶G、GF254、柱色谱硅胶(100~200目,200~300目)(青岛海洋化工厂);葡聚糖凝胶SephadexTMLH-20(瑞典GE Healthcare Bio-Sciences AB公司);石油醚、环己烷、二氯甲烷、氯仿、乙酸乙酯、乙醇、甲醇(分析纯,国药集团化学试剂有限公司);二甲基亚砜、DMEM/F-12培养基、DMEM高糖培养基、胎牛血清、PBS、LPS、吲哚美辛(北京索莱宝科技有限公司);胰酶细胞消化液(上海碧云天生物技术有限公司);小鼠TNF-α、IL-1β、IL-6炎症因子Elisa试剂盒(武汉博士德生物工程有限公司);RAFLS细胞、RAW 264.7细胞(北京北纳创联生物技术研究有限公司)。
1.2 植物材料
白毛乌蔹莓于2017年9月采集于湖南省怀化市通道侗族自治县,经湖南中医药大学药用植物学教研室王智鉴定为葡萄科乌蔹莓属植物白毛乌蔹莓(CayratiaalbifoliaC.L.Li)。植物标本(20170923)现存放在湖南医药学院侗药湖南省重点实验室。
1.3 提取与分离
白毛乌蔹莓干燥地上部分(1 500.00 g)经粉碎后用75%的乙醇渗漉提取,在小于60 ℃的温度下用旋转蒸发仪进行减压浓缩,得到460.00 g干燥浸膏。取其中235.00 g干燥浸膏于700 mL水中分散,依次用石油醚,二氯甲烷,乙酸乙酯,正丁醇萃取。萃取后浸膏分别干燥称重得:石油醚层浸膏(12.86 g),二氯甲烷层浸膏(12.04 g),乙酸乙酯层浸膏(4.57 g),正丁醇层浸膏(25.85 g)。
石油醚层浸膏(12.86 g)拌入19.00 g硅胶(200~300目),搅拌均匀干燥后,经硅胶柱色谱(硅胶柱8 cm × 60 cm)用石油醚-乙酸乙酯系统(20∶1→15∶1→10∶1→4∶1→2∶1)梯度洗脱,以5%硫酸香草醛作为显色剂在TLC上检识,合并后得到14个流分,记为Fr. A~Fr. N。Fr. E流分(2.00 g)用硅胶柱色谱以石油醚-乙酸乙酯(9∶1)系统等度洗脱,得到8个流分Fr. E-1~Fr. E-8,Fr. E-1通过硅胶柱色谱和葡聚糖凝胶Sephadex LH-20柱色谱反复分离,从中分离得到化合物2(10.0 mg)和化合物19(143.8 mg)。Fr. F流分(814.9 mg)用硅胶柱色谱以石油醚-乙酸乙酯(6∶1→5∶1)系统梯度洗脱,得到两个流分Fr. F-1和Fr. F-2;Fr. F-1用硅胶柱色谱以石油醚-乙酸乙酯(10∶1)系统等度洗脱,得到化合物1(52.6 mg);Fr. F-2用硅胶柱色谱以氯仿-乙酸乙酯(30∶1)系统等度洗脱,得到化合物3(348.6 mg)。Fr. H流分(99.1 mg)先经硅胶柱色谱以氯仿-丙酮系统(10∶1)系统等度洗脱,再经葡聚糖凝胶Sephadex LH-20柱色谱分离,洗脱体系为石油醚-氯仿-甲醇(4∶5∶1),从中分离得到化合物5(4.9 mg)和化合物15(2.7 mg)。Fr. L流分(209.6 mg)用硅胶柱色谱以二氯甲烷-甲醇(1∶0→99∶1→19∶1)系统梯度洗脱,从中分离得到化合物17(20.9 mg)。Fr. N流分(335.1 mg)经硅胶柱色谱以二氯甲烷-甲醇(1∶0→20∶1→10∶1)系统梯度洗脱,得到三个流分Fr. N-1~Fr. N-3;Fr. N-2流分经重结晶纯化后得到化合物4(119.3 mg),Fr. N-3经硅胶柱色谱和葡聚糖凝胶Sephadex LH-20柱色谱反复分离,从中分离得化合物11(2.1 mg)。
乙酸乙酯层浸膏(4.57 g)拌入6.00 g硅胶(200~300目),搅拌均匀干燥后,经硅胶柱色谱(硅胶柱4 cm × 60 cm)用氯仿-甲醇系统(1∶0→19∶1→9∶1→17∶3→4∶1→3∶1)梯度洗脱,用5%硫酸香草醛作为显色剂在TLC上检识,合并得到12个流分,记为Fr. Y-A~Fr. Y-L。Fr. Y-A流分(173.1 mg)通过葡聚糖凝胶Sephadex LH-20柱色谱分离,洗脱体系为石油醚-氯仿-甲醇(4∶5∶1),从中得到化合物3(50.0 mg)。Fr. Y-B流分(93.3 mg)用硅胶柱色谱分离,纯氯仿洗脱,从中分离得到化合物18(63.4 mg)。Fr. Y-D流分(45.0 mg)通过凝胶柱色谱分离,洗脱体系为石油醚-氯仿-甲醇(4∶5∶1),从中分离得到化合物9(10.0 mg)。Fr. Y-E流分(126.7 mg)用硅胶柱色谱以环己烷-乙酸乙酯(1∶1→1∶3)系统梯度洗脱,从中分离得到化合物16(28.1 mg)。Fr. Y-G流分(216.4 mg)用硅胶柱色谱以环己烷-乙酸乙酯(1∶1→1∶3)系统梯度洗脱后,再经硅胶柱色谱和葡聚糖凝胶柱色谱反复分离,从中分离得到化合物6(3.3 mg),化合物12(3.0 mg)和化合物14(50.7 mg)。Fr. Y-H流分(89.1 mg)经硅胶柱色谱以环己烷-乙酸乙酯(1∶2→1∶4)系统梯度洗脱得到两个流分Fr. Y-H-1和Fr. Y-H-2,其中Fr. Y-H-2经葡聚糖凝胶Sephadex LH-20柱色谱以石油醚-氯仿-甲醇(4∶5∶1)体系等度洗脱,从中分离得到化合物13(1.9 mg)。Fr. Y-L流分(147.3 mg)用硅胶柱色谱以乙酸乙酯-甲醇(1∶0→20∶1)系统梯度洗脱,再经硅胶柱色谱和葡聚糖凝胶柱色谱反复分离,从中分离得到化合物10(3.5 mg)和20(1.0 mg)。Fr. Y-O流分(127.6 mg)用硅胶柱色谱以乙酸乙酯-甲醇(10∶1)系统等度洗脱后,再经硅胶柱色谱和葡聚糖凝胶Sephadex LH-20柱色谱反复分离,从中分离得到化合物7和化合物8(22.9 mg)。
1.4 化合物抗RAFLS增殖
取对数生长期生长良好的类风湿关节炎成纤维样滑膜(rheumatoid arthritis fibroblast-like synoviocytes,RAFLS)细胞,移除原培养基,用1 × PBS清洗2次,每个培养皿加入含0.02% EDTA的胰酶消化液500 μL于5% CO2,37 ℃的培养箱中消化2 min,再加入500 μL 10% FBS的DMEM/F-12培养基终止消化,充分混匀后,转移至1 mL EP管中,以800 r/min离心5 min,计数,调节细胞密度为1 × 104个/mL种植于96孔板,100 μL/孔恒温箱中37 ℃培养24 h。化合物1~20用DMSO 5 mM浓度的母液,再加DMEM培养基分别稀释至500 μmol/L备用。除对照组(吲哚美辛)及空白孔外,其余各组加入各化合物使其在100 μL体系终浓度为0、1、2、4、6、8、16、20 μmol/L,处理48 h后,每孔加入含有10% MTT的DMEM溶液(5 mg/mL)100 μL,37 ℃继续孵育4 h后,小心移除孔内培养上清液,每孔加入100 μL DMSO在摇床上避光震荡10 min,使结晶物充分溶解。选择490 nm波长,在酶标仪上测定各孔光吸收值(OD)。记录各组的OD值,并按公式(1)计算各化合物对RAFLS细胞的IC50值。
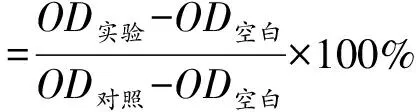
(1)
1.5 化合物抗LPS诱导的RAW 264.7细胞炎症因子生成
取对数生长期生长良好的RAW 264.7细胞,移除原培养基,用1 × PBS清洗2次,每个培养皿加入含0.02% EDTA的胰酶消化液500 μL,于5% CO237 ℃的培养箱中消化2 min,再加入500 μL 10% FBS的DMEM培养基终止消化,充分混匀后,转移至1 mL EP管中,以800 r/min离心5 min,计数,调节细胞密度为1 × 104个/mL种植于96孔板,100 μL/孔恒温箱中37 ℃培养24 h。除对照组(吲哚美辛)及空白孔外,其余各组加入各化合物使其在100 μL体系终浓度为0、1、2、4、6、8、16、20 μmol/L,药物处理后的第44 h,每孔加入LPS,使其在100 μL体系终浓度为100 ng/mL,继续放置培养箱中培养4 h,得到细胞上清液待测。用ELISA试剂盒严格按照说明书检测各孔上清液中含有的炎性因子浓度。最后在450 nm波长条件下依序读取各孔的OD值。根据公式(2)进行计算出各个化合物对各种炎性因子的IC50值。
(2)
2 结果
2.1 结构鉴定
化合物1无定型粉末(CHCl3);ESI-MS:m/z451 [M+Na]+;1H NMR(600 MHz,CDCl3)δ:0.96(3H,s,H-19),0.93(3H,d,J=6.5 Hz,H-21),0.86(3H,s,H-29),0.84(3H,d,J=8.2 Hz,H-26),0.81(3H,d,J=8.2 Hz,H-27),0.69(3H,s,H-18);13C NMR(150 MHz,CDCl3)δ:38.3(C-1),39.5(C-2),209.3(C-3),37.2(C-4),57.7(C-5),211.5(C-6),46.8(C-7),37.6(C-8),53.6(C-9),41.4(C-10),21.8(C-11),38.2(C-12),43.2(C-13),56.2(C-14),24.2(C-15),28.2(C-16),56.8(C-17),12.7(C-18),12.2(C-19),36.2(C-20),18.9(C-21),34.0(C-22),26.2(C-23),45.9(C-24),29.3(C-25),20.0(C-26),19.2(C-27),23.1(C-28),12.1(C-29)。以上数据与文献[5]报道基本一致,故鉴定该化合物为豆甾-3,6-二酮。
化合物2无定型粉末(CHCl3);ESI-MS:m/z413 [M+H]+;1H NMR(600 MHz,CDCl3)δ:5.72(1H,br s,H-4),1.18(3H,s,H-19),0.92(3H,d,J=6.5 Hz,H-21),0.84(3H,d,J=7.0 Hz,H-29),0.83(3H,d,J=6.5 Hz,H-26),0.81(3H,d,J=6.8 Hz,H-27),0.71(3H,s,H-18);13C NMR(150 MHz,CDCl3)δ:35.8(C-1),34.1(C-2),199.8(C-3),123.9(C-4),171.9(C-5),33.1(C-6),32.2(C-7),35.8(C-8),54.0(C-9),38.7(C-10),21.2(C-11),39.8(C-12),42.5(C-13),56.0(C-14),24.3(C-15),28.3(C-16),56.1(C-17),12.1(C-18),17.5(C-19),36.3(C-20),18.8(C-21),34.0(C-22),26.2(C-23),46.0(C-24),29.3(C-25),20.0(C-26),19.2(C-27),23.2(C-28),12.1(C-29)。以上数据与文献[6]报道基本一致,故鉴定该化合物为豆甾-4-烯-3-酮。
化合物3白色针状结晶(CHCl3);ESI-MS:m/z437 [M+Na]+;1H NMR(600 MHz,CDCl3)δ:5.38(1H,br s,H-6),1.03(3H,s,H-19),0.95(3H,d,J=6.5 Hz,H-21),0.89(3H,m,H-26),0.88~0.86(3H,m,H-29),0.83(3H,d,J=6.8 Hz,H-27),0.70(3H,s,H-18);13C NMR(150 MHz,CDCl3)δ:37.4(C-1),31.8(C-2),72.0(C-3),42.5(C-4),140.9(C-5),121.9(C-6),32.1(C-7),32.1(C-8),50.3(C-9),36.7(C-10),21.2(C-11),39.9(C-12),42.5(C-13),56.9(C-14),24.5(C-15),28.4(C-16),56.2(C-17),12.0(C-18),19.6(C-19),36.3(C-20),18.9(C-21),34.1(C-22),26.2(C-23),46.0(C-24),29.3(C-25),20.0(C-26),19.2(C-27),23.2(C-28),12.1(C-29)。以上数据与文献[7]报道基本一致,故鉴定该化合物为β-谷甾醇。
化合物4白色无定型粉末(CHCl3);ESI-MS:m/z599 [M+Na]+;1H NMR(600 MHz,C5D5N)δ:5.37(1H,br s,H-6),5.08(1H,d,J=7.7 Hz,H-1′),1.01(3H,s,H-19),0.95(3H,d,J=6.5 Hz,H-21),0.93~0.91(3H,m,H-29),0.90(3H,m,H-26),0.88(3H,d,J=6.8 Hz,H-27),0.68(3H,s,H-18);13C NMR(150 MHz,C5D5N)δ:37.9(C-1),30.7(C-2),78.5(C-3),39.7(C-4),141.3(C-5),122.3(C-6),32.6(C-7),32.5(C-8),50.7(C-9),37.3(C-10),21.7(C-11),40.4(C-12),42.9(C-13),57.2(C-14),24.9(C-15),29.0(C-16),56.6(C-17),12.4(C-18),19.4(C-19),36.8(C-20),19.6(C-21),34.6(C-22),26.8(C-23),46.4(C-24),29.9(C-25),19.8(C-26),20.4(C-27),23.8(C-28),12.6(C-29),103.0(C-1′),75.8(C-2′),79.0(C-3′),72.1(C-4′),78.9(C-5′),63.2(C-6′)。以上数据与文献[8]报道基本一致,故鉴定该化合物为β-D-胡萝卜苷。
化合物5无定型粉末(CHCl3);ESI-MS:m/z479 [M+Na]+;1H NMR(600 MHz,DMSO-d6)δ:4.68(1H,s,H-29α),4.58(1H,br s,H-29β),1.64(3H,s,H-30),0.93(3H,s,H-24),0.87(3H,s,H-27),0.86(3H,s,H-26),0.76(3H,s,H-23),0.64(3H,s,H-25);13C NMR(150 MHz,DMSO-d6)δ:38.0(C-1),26.9(C-2),76.5(C-3),38.2(C-4),54.6(C-5),17.7(C-6),33.6(C-7),40.0(C-8),49.6(C-9),36.4(C-10),20.2(C-11),24.8(C-12),37.3(C-13),41.7(C-14),29.8(C-15),31.4(C-16),55.1(C-17),46.3(C-18),48.2(C-19),150.0(C-20),28.9(C-21),36.0(C-22),27.8(C-23),15.4(C-24),15.5(C-25),15.7(C-26),14.1(C-27),176.9(C-28),109.4(C-29),18.7(C-30)。以上数据与文献[9]报道基本一致,故鉴定该化合物为白桦脂酸。
化合物6无色针状结晶(MeOH);ESI-MS:m/z227 [M-H]-;1H NMR(600 MHz,CD3OD)δ:7.35(2H,d,J=8.5 Hz,H-2′,6′),6.97(1H,d,J=16.2 Hz,H-8),6.81(1H,d,J=16.2 Hz,H-7),6.77(2H,d,J=8.5 Hz,H-3′,5′),6.44(2H,d,J=2.1 Hz,H-2,6),6.16(1H,t,J=2.1 Hz,H-4);13C NMR(150 MHz,CD3OD)δ:141.3(C-1),105.7(C-2),159.7(C-3),102.6(C-4),159.7(C-5),105.7(C-6),127.0(C-7),129.4(C-8),130.4(C-1′),128.8(C-2′),116.5(C-3′),158.4(C-4′),116.5(C-5′),128.8(C-6′)。以上数据与文献[10]报道基本一致,故鉴定该化合物为白藜芦醇。
化合物7白色粉末(MeOH);ESI-MS:m/z413 [M+Na]+;1H NMR(600 MHz,CD3OD)δ:7.35(2H,d,J=8.5 Hz,H-2′,6′),7.02(1H,d,J=16.2 Hz,H-8),6.85(1H,d,J=16.2 Hz,H-7),6.79(1H,t,J=2.1 Hz,H-2),6.76(2H,d,J=8.5 Hz,H-3′,5′),6.61(1H,t,J=2.1 Hz,H-6),6.44(1H,t,J=2.1 Hz,H-4),4.88(1H,d,J=7.2 Hz,H-1′′);13C NMR(150 MHz,CD3OD)δ:141.5(C-1),108.4(C-2),160.5(C-3),104.1(C-4),159.6(C-5),107.0(C-6),126.7(C-7),130.0(C-8),130.4(C-1′),128.9(C-2′,6′),116.5(C-3′,5′),158.5(C-4′),102.5(C-1′′),75.0(C-2′′),78.1(C-3′′),71.5(C-4′′),78.3(C-5′′),62.6(C-6′′)。以上数据与文献[11]报道基本一致,故鉴定该化合物为反式白藜芦醇苷。
化合物8白色粉末(MeOH);ESI-MS:m/z413 [M+Na]+;1H NMR(600 MHz,CD3OD)δ:7.08(2H,d,J=8.5 Hz,H-2′,6′),6.64(2H,d,J=8.5 Hz,H-3′,5′),6.52(1H,br s,H-2),6.46(1H,d,J=12.2 Hz,H-8),6.39~6.37(2H,m,H-4,6),6.35(1H,d,J=12.2 Hz,H-7),4.68(1H,d,J=7.2 Hz,H-1′′);13C NMR(150 MHz,CD3OD)δ:141.1(C-1),109.2(C-2),160.1(C-3),103.9(C-4),159.4(C-5),111.1(C-6),129.1(C-7),131.4(C-8),129.9(C-1′),131.4(C-2′,6′),116.1(C-3′,5′),157.8(C-4′),102.3(C-1′′),74.8(C-2′′),78.0(C-3′′),71.1(C-4′′),77.8(C-5′′),62.2(C-6′′)。以上数据与文献[12]报道基本一致,故鉴定该化合物为顺式白藜芦醇苷。
化合物9淡黄色粉末(CHCl3);ESI-MS:m/z160 [M-H]-;1H NMR(600 MHz,C5D5N)δ:13.03(1H,s,-COOH),8.91(1H,d,J=7.9 Hz,H-4),8.55(1H,d,J=2.8 Hz,H-2),7.65(1H,br d,J=8.1 Hz,H-7),7.45(1H,ddd,J=8.1,7.0,1.1 Hz,H-5),7.36(1H,td,J=8.1,7.0,1.1 Hz,H-6);13C NMR(150 MHz,C5D5N)δ:168.2(COOH),133.2(C-2),110.2(C-3),122.5(C-4),122.1(C-5),123.2(C-6),113.0(C-7),138.2(C-8),128.1(C-9)。以上数据与文献[13]报道基本一致,故鉴定该化合物为1H-吲哚-3-羧酸。
化合物10白色粉末(MeOH);ESI-MS:m/z245 [M+H]+;1H NMR(600 MHz,C5D5N)δ:6.86(1H,dd,J=15.9,0.9 Hz,H-7),6.53(1H,dd,J=15.9,6.1 Hz,H-8),4.93(1H,ddd,J=15.7,10.2,4.3 Hz,H-3),4.79(1H,p,J=6.1 Hz,H-9),2.61(1H,t,J=11.9 Hz,H-2β),2.51(1H,ddd,J=12.2,4.2,2.0 Hz,H-4α),2.49(1H,t,J=11.9 Hz,H-2α),2.07(1H,ddd,J=12.2,4.2,2.0 Hz,H-4β),1.69(3H,s,H-12),1.69(3H,s,H-13),1.52(3H,d,J=6.4 Hz,H-10),1.29(3H,s,H-11);13C NMR(150 MHz,C5D5N)δ:40.3(C-1),47.1(C-2),64.1(C-3),46.9(C-4),76.9(C-5),78.4(C-6),130.4(C-7),136.4(C-8),68.2(C-9),24.9(C-10),27.7(C-11),26.3(C-12),27.7(C-13)。以上数据与文献[14]报道基本一致,故鉴定该化合物为 (3S,5R,6S,7E)-megastigma-7-ene-3,5,6,9-tetrol。
化合物11无定型粉末(MeOH);ESI-MS:m/z231 [M+Na]+;1H NMR(600 MHz,C5D5N)δ:4.83(1H,d,J=7.8 Hz,H-1),4.05(1H,t,J=8.2 Hz,H-2),4.26~4.29(1H,m,overlap,H-3),4.23~4.26(1H,m,overlap,H-4),3.96(1H,m,H-5),4.57(1H,dd,J=11.8,2.1 Hz,H-6α),4.39(1H,dd,J=11.8,5.5 Hz,H-6β),3.69(1H,dq,J=9.4,7.0 Hz,H-1′α),4.10(1H,dq,J=9.4,7.0 Hz,H-1′β),1.19(3H,t,J=7.1 Hz,H-2′);13C NMR(150 MHz,C5D5N)δ:105.9(C-1),75.4(C-2),78.8(C-3),71.9(C-4),78.7(C-5),63.0(C-6),65.2(C-1′),15.8(C-2′)。以上数据与文献[15]报道基本一致,故鉴定该化合物为乙基-β-D-吡喃葡萄糖苷。
化合物12无定型粉末(MeOH);ESI-MS:m/z241 [M+K]+;1H NMR(600 MHz,C5D5N)δ:6.23(1H,s,H-2),2.77(1H,m,H-4α),3.76(1H,d,J=12.3 Hz,H-6),2.46(1H,m,H-4β),2.42(3H,s,3-CH3),2.13(1H,m,H-5α),1.86(1H,m,H-5β),1.52(1H,s,H-8),1.48(3H,s,7-CH3);13C NMR(150 MHz,C5D5N)δ:169.7(C-1),117.9(C-2),159.8(C-3),39.1(C-4),30.7(C-5),78.5(C-6),72.9(C-7),26.4(C-8),19.2(3-CH3),26.2(7-CH3)。以上数据与文献[16]报道基本一致,故鉴定该化合物为6,7-二羟基-3,7-二甲基-2-辛烯酸。
化合物13无定型粉末(MeOH);ESI-MS:m/z155 [M+Na]+;1H NMR(600 MHz,C5D5N)δ:5.00(1H,m,H-4),4.91(1H,m,H-5),4.13(1H,dd,J=12.2,3.4 Hz,H-6α),4.03(1H,dd,J=12.2,3.2 Hz,H-6β),3.33(1H,dd,J=17.5,6.7 Hz,H-3α),2.86(1H,dd,J=17.5,2.5 Hz,H-3β);13C NMR(150 MHz,C5D5N)δ:177.0(C-2),39.5(C-3),69.2(C-4),89.8(C-5),62.1(C-6)。以上数据与文献[17]报道基本一致,故鉴定该化合物为D-(+)-核糖酸-γ-内酯。
化合物14无定型粉末(MeOH);ESI-MS:m/z153 [M-H]-;1H NMR(600 MHz,C5D5N)δ:8.37(1H,d,J=1.9 Hz,H-2),8.10(1H,dd,J=8.2,1.8 Hz,H-6),7.33(1H,d,J=8.2 Hz,H-5);13C NMR(150 MHz,C5D5N)δ:123.3(C-1),117.9(C-2),146.7(C-3),151.8(C-4),115.9(C-5),123.5(C-6),169.1(C-7)。以上数据与文献[18]报道基本一致,故鉴定该化合物为3,4-二羟基苯甲酸。
化合物15无色结晶(CHCl3);ESI-MS:m/z133 [M+Na]+;1H NMR(600 MHz,CD3OD)δ:6.77~6.74(1H,m,H-4,5),6.67~6.64(1H,m,H-3,6);13C NMR(150 MHz,CD3OD)δ:146.3(C-1,2),116.4(C-3,6),120.9(C-4,5)。以上数据与文献[19]报道基本一致,故鉴定该化合物为邻苯二酚。
化合物16白色结晶型粉末(MeOH);ESI-MS:m/z141[M-H]-;1H NMR(600 MHz,CD3OD)δ:7.87(2H,d,J=8.7 Hz,H-3,4),6.80(2H,d,J=8.7 Hz,H-2,5);13C NMR(150 MHz,CD3OD)δ:163.3(C-1,6),116.0(C-2,5),133.0(C-3,4)。以上数据与文献[20]报道基本一致,故鉴定该化合物为己二烯二酸。
化合物17白色粉末(CHCl3);ESI-MS:m/z355 [M+H]+;1H NMR(600 MHz,CDCl3)δ:5.41~5.31(4H,m,H-9,10,11,12,13),4.21(1H,dd,J=11.7,4.5 Hz,H-1′α),4.15(1H,dd,J=11.7,6.2 Hz,H-1′β),3.93(1H,br s,H-2′),3.70(1H,dd,J=11.4,3.5 Hz,H-3′α),3.62(1H,dd,J=11.4,5.7 Hz,H-3′β),2.79(2H,t,J=6.8 Hz,H-11),2.37(2H,t,J=7.6 Hz,H-2),2.09~2.01(4H,m,H-8,14),1.66~1.61(2H,m,H-3),1.38~1.25(14H,m,H-4~7,15,17),0.91(3H,t,J=6.9 Hz,H-18);13C NMR(150 MHz,CDCl3)δ:174.5(C-1),34.3(C-2),25.1(C-3),29.2~29.7(C-4~7,15),27.4(C-8),128.2(C-9),130.4(C-10),25.8(C-11),130.2(C-12),128.0(C-13),27.3(C-14),31.7(C-16),22.7(C-17),14.2(C-18),65.3(C-1′),70.4(C-2′),63.5(C-3′)。以上数据与文献[21]报道基本一致,故鉴定该化合物为9,12-亚油酸-2′,3′-二羟基丙酯。
化合物18白色粉末(CHCl3);ESI-MS:m/z321 [M+Na]+;1H NMR(600 MHz,CDCl3)δ:2.36(2H,t,J=7.5 Hz,H-2),1.65(2H,p,J=7.5 Hz,H-3),1.38~1.27(30H,m,H-4~18),0.90(3H,t,J=7.0 Hz,H-19);13C NMR(150 MHz,CDCl3)δ:179.9(C-1),34.2(C-2),24.8(C-3),29.2~29.9(C-4~16),32.1(C-17),22.9(C-18),14.3(C-19)。以上数据与文献[22]报道基本一致,故鉴定该化合物为正十九烷酸。
化合物19白色粉末(CHCl3);ESI-MS:m/z255 [M-H]-;1H NMR(600 MHz,CDCl3)δ:2.35(2H,t,J=7.5 Hz,H-2),1.66~1.61(2H,p,J=7.5 Hz,H-3),1.35~1.25(24H,m,H-4~15),0.88(3H,t,J=7.0 Hz,H-16);13C NMR(150 MHz,CDCl3)δ:179.9(C-1),34.1(C-2),24.8(C-3),29.2~29.8(C-4~13),32.1(C-14),22.9(C-15),14.3(C-16)。以上数据与文献[23]报道基本一致,故鉴定该化合物为正十六烷酸。
化合物20白色粉末(CHCl3);HRESI-MS:m/z295 [M-H]-;1H NMR(600 MHz,CD3OD)δ:7.97(1H,d,J=16.0 Hz,H-4),6.38(1H,d,J=16.0 Hz,H-5),5.86(1H,br s,H-2),3.84(1H,tt,J=10.8,7.1 Hz,H-3′),2.27(1H,ddd,J=14.2,7.0,1.5 Hz,H-2′α),2.07(3H,s,3-CH3),1.90(1H,ddd,J=13.5,7.0,1.5 Hz,H-4′α),1.85(1H,dd,J=14.2,10.1 Hz,H-2′β),1.73(1H,dd,J=13.5,11.1 Hz,H-4′β),1.35(3H,s,1′-CH3),1.09(3H,s,5′-CH3);13C NMR(150 MHz,CD3OD)δ:171.0(C-1),122.7(C-2),147.5(C-3),133.5(C-4),131.1(C-5),89.9(C-1′),42.3(C-2′),65.2(C-3′),41.0(C-4′),53.5(C-5′),181.1(C-6′),82.8(C-7′),20.9(3-CH3),18.5(1′-CH3),14.5(5′-CH3)。以上数据与文献[24]报道基本一致,故鉴定该化合物为rel-5-(3S,8S-dihydroxy-1R,5S-dimethyl-7-oxa-6-oxobicyclo[3,2,1]oct-8-yl)-3-methyl-2Z,4E-pentadienoic acid。
2.2 化合物抗RAFLS增殖活性
MTT法测试20个单体化合物对RA-FLS细胞增殖抑制活性结果显示,化合物1、15、19和20对RA-FLS的增殖具有一定的抑制活性,但小于阳性对照药物吲哚美辛,其IC50值分别为23.07、26.92、23.59及19.22 μmol/L。
2.3 化合物抗LPS诱导的RAW 264.7细胞炎症因子生成活性
化合物抗LPS诱导的RAW 264.7细胞炎症因子生成的影响结果显示,化合物1、15、19和20均能抑制LPS诱导RAW 264.7细胞中炎性因子TNF-α生成,IC50值分别为13.58、18.51、13.45及9.58 μmol/L,化合物15和20能抑制LPS诱导RAW 264.7细胞中炎性因子IL-1β、IL-6的生成,其IC50值分别为13.56、17.30和14.42、8.71 μmol/L。
3 结论
侗药“教美姑”在湖南湘西北侗族聚居区被长期用于治疗类风湿性关节炎,疗效确切,为了更合理地开发利用该植物资源,本文对其化学成分开展了研究,综合运用多种色谱分离方法,从白毛乌蔹莓地上部分75%乙醇提取物中首次分离得到了20个化合物,并鉴定了它们的结构。其中除化合物3和4外,其他化合物均为首次从乌蔹莓属植物中分离得到,进一步明确了白毛乌蔹莓的物质基础。评价了各化合物对RAFLS细胞体外增殖抑制活性,及对LPS诱导RAW 264.7细胞中炎性因子TNF-α、IL-1β及IL-6生成的影响,发现部分化合物具有中等强度的抗炎活性,其活性可能与其抑制炎性因子的生成有关,但白毛乌蔹莓抗类风湿性关节炎的药效物质基础和作用机制还需通过系统的体内外实验进一步深入研究。本文的研究结果可为白毛乌蔹莓的质量标准提升、进一步开发和临床应用提供一定的实验依据。

