基于网络药理学和分子对接探讨黄芪治疗病毒性心肌炎的作用机制
李中豪,顾凯元,任晋宏
1山西中医药大学,晋中 030619;2南京中医药大学,南京 210023;3沈阳药科大学,沈阳 110016
病毒性心肌炎(viral myocarditis,VMC)是因病毒对心肌直接造成损伤或因自身免疫炎性反应而诱发心肌局灶性或弥漫性的炎蚀病变,其临床主要表现为患者发病前多出现肠道或上呼吸道感染症状,轻症患者无任何症状,而重者则出现休克、猝死等症状[1]。VMC的发病率大约为每10万人中10至22人[2]。但迄今尚无具体的临床治疗特效药物,抗病毒和营养心肌药物主要用于有效控制患者的病情。
结合VMC临床表现,中医学认为,VMC应归属于“温病”“胸痹”“心悸”等范畴[3]。其病因为人之正气亏虚,而外感温热邪毒;病机为因热毒内侵,致人气阴耗伤,致瘀血阻络、心失所养,患者多出现虚、滞、瘀等表现[4],治疗上讲究分期辩证与分型辩证相结合,应强调益气养阴、活血化瘀。近年来,众多研究证明黄芪在治疗VMC方面疗效甚佳,临床常单用黄芪注射液或联合其他药物共同治疗VMC[5,6],已于临床推广。
传统中药黄芪含黄芪多糖、黄芪甲苷、黄芪黄酮、槲皮素、山奈酚等多种活性成分。现代医学研究表明,黄芪及其活性成分单体(如黄芪甲苷、黄芪黄酮、黄芪多糖等)治疗病毒性心肌炎的潜在机制较多,包括氧化应激作用、免疫调节作用、抑制炎性反应、调节细胞凋亡等方面[7],然而详细作用机制尚不明确。
网络药理学作为一门新兴研究学科,首次由英国药理学家Hopkins提出概念[8],近年来发展迅速。它凭借系统生物学理论基础,对药物活性成分及其潜在作用靶点和信号通路进行预测,以期提高药效研究或临床试验的准确性[9]。因此,本研究基于网络药理学和分子对接技术预测黄芪治疗病毒性心肌炎的活性成分及相关靶标和通路,以期阐明其生物过程及作用机制。
1 材料与方法
1.1 筛选黄芪活性成分
本研究通过TCMSP数据库(http://tcmspw.com/tcmsp.php),筛选黄芪活性成分信息。其中筛选条件为“口服生物利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18”,获得20个活性成分。此外,查阅相关文献[10],整理活性成分单体纳入讨论。
1.2 收集黄芪活性成分潜在靶点
本研究将黄芪潜在靶点分为已验证靶点和预测所得靶点两部分。
活性成分已验证靶点是通过Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)中生物测定结果(BioAssay results)得到数据,然后限定“Active”和“Human”来筛选已验证靶点。最后利用Uniprot数据库(https://www.uniprot.org/)将备选药物靶点转换成基因名称。
预测靶点是首先查询Pubchem数据库中黄芪活性成分的SMILES,将其输入SwissTargetPrediction(http://www.swisstargetprediction.ch/)中,依据化学相似性寻找靶点。并通过Uniprot数据库将靶点规范化基因名称,并剔除非人类或未验证UniprotID的基因。
最后汇总两部分靶点,删去重复靶点信息,获得黄芪活性成分靶点库。
1.3 构建“黄芪活性成分-靶点”网络
将上述获得的活性成分及靶点建立相应的数据表,并将其作为输入文件导入Cytoscape 3.7.1软件中,以完成“黄芪活性成分-靶点”网络的构建,对黄芪活性成分及靶点进行可视化分析。
1.4 收集病毒性心肌炎疾病靶点及黄芪作用靶点
分别通过GeneCards数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)及DisGeNET数据库(https://www.disgenet.org/)以“viral myocarditis”为关键词检索与VMC相关的基因,去重后获得VMC相关基因。将挖掘到的VMC相关基因与黄芪活性成分的靶点基因映射筛选以获取交集靶点,即黄芪活性成分治疗VMC的潜在作用靶点,并绘制Venn图。
1.5 构建“黄芪活性成分-VMC-靶点”网络
依据所得数据,建立网络文件和属性文件,并导入Cytoscape 3.7.1软件中,以构建“黄芪活性成分-VMC-靶点”网络。接着利用network analyzer等插件进行网络特征分析,来突出黄芪中较重要的活性成分及潜在靶点。
1.6 构建黄芪-VMC靶点蛋白相互作用网络和归属作用靶点类型
将交集靶点输入String在线软件(https://string-db.org/),其中筛选条件限定物种为人,最低互作分数为0.4,保存数据结果。其次将数据结果文件导入Cytoscape 3.7.1软件中构建蛋白互作(PPI)图,计算出degree值以调整靶点大小及颜色,区分靶点重要程度。接着借助DisGeNET数据库对degree值较大的作用靶点进行检索,获取靶点类型信息,来推测重要靶点在治疗过程中可能发挥的作用。
1.7 GO功能分析与KEGG通路富集
将黄芪-VMC交接靶点使用R语言进行基因本体(GO)富集分析和KEGG通路分析,设置P<0.01为筛选标准,整理结果按照Pvalue大小排序,并绘GO功能分析、KEGG通路富集信息柱状图及气泡图。整理分析结果数据,筛选富集程度较高的前20条通路,利用Cytoscape 3.7.1软件构建“靶点-KEGG通路”网络。
1.8 分子对接
为检验黄芪关键活性成分及重要靶点的结合方式和契合度,本研究选择连接靶点数目最多的前8种活性成分和5个关键作用靶点依次进行分子对接验证。首先从TCMSP数据库中下载活性成分的mol2格式文件,利用Sybylx-2.0软件进行能量优化,获得修正后的小分子mol2格式文件。随后从RSCB PDB数据库中(http://www.rcsb.org/)中筛选5个重要靶点蛋白较合适的蛋白结构,并下载其PDB格式文件。接着将蛋白结构导入Sybylx-2.0中进行预处理,包括修正蛋白、提取配体结构、删除水分子、为蛋白加氢等。最后,利用Sybylx-2.0中的Surflex-Dock功能依次将小分子与蛋白进行分子对接,利用Total Score评价对接结果。
2 结果
2.1 黄芪活性成分的筛选
通过TCMSP数据库检索“黄芪”,获得符合条件的20种活性成分;检索文献获得对VMC有明显治疗效果的成分:黄芪甲苷和黄芪三萜皂苷。因此,共获得22种黄芪活性成分,结果见表1。
2.2 黄芪活性成分潜在靶点的收集
通过上述数据库获得已验证靶点200个,预测所得靶点418个,汇总去重后共获得黄芪活性成分潜在靶点505个。
2.3 “黄芪活性成分-靶点”网络的构建
利用Cytoscape 3.7.1对黄芪活性成分和潜在作用靶点的关系网络进行绘制和分析,如图1所示,构建的网络共获得528个节点和1 392个关系,图中橙色方块代表潜在靶点,黄色菱形代表黄芪活性成分。
2.4 疾病靶点及药物作用靶点的筛选
通过GeneCards数据库获得847个靶点,OMIM数据库获得248个靶点,GeneCards数据库获得129个靶点,去除重复靶点,最终获得1 116个VMC疾病相关靶点。
将黄芪潜在靶点与VMC疾病相关靶点取交集,共收集到97个共同靶点(见图2)。
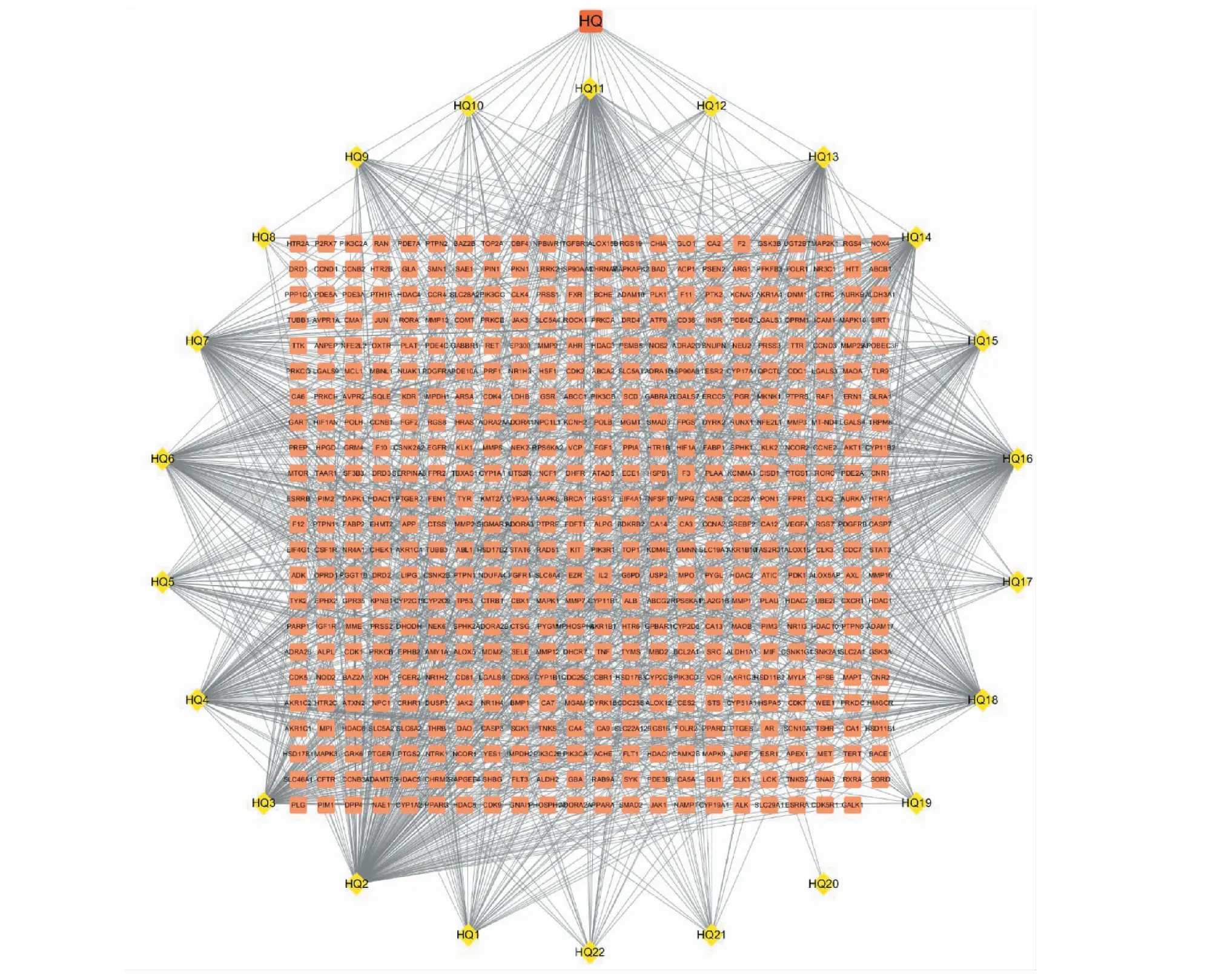
图1 “黄芪活性成分-靶点”网络Fig.1 “Astragali Radix active ingredient-target” network
2.5 “黄芪-VMC-靶点”网络的构建
使用Cytoscape 3.7.1软件构建的“黄芪-VMC-靶点”网络如图3所示,共获得120个节点和397个关系。图中六边形代表病毒性心肌炎,圆形代表黄芪活性成分,八边形代表这些活性成分治疗VMC的相关作用靶点。图形填充的颜色越深,表示这个成分或者靶点相连的边越多,即节点的degree越高。其中槲皮素相连34个靶点,3,9-二-O-甲基尼森香豌豆紫檀酚相连25个靶点,山奈酚相连23个靶点,(3R)-3-(2-羟基-3,4-二甲氧基苯基)铬-7-醇相连22个靶点,华良姜素相连22个靶点,美迪紫檀素相连19个靶点,白桦脂酸相连17个靶点,异鼠李素相连13个靶点。这提示黄芪在治疗VMC方面上述成分会起到关键作用。
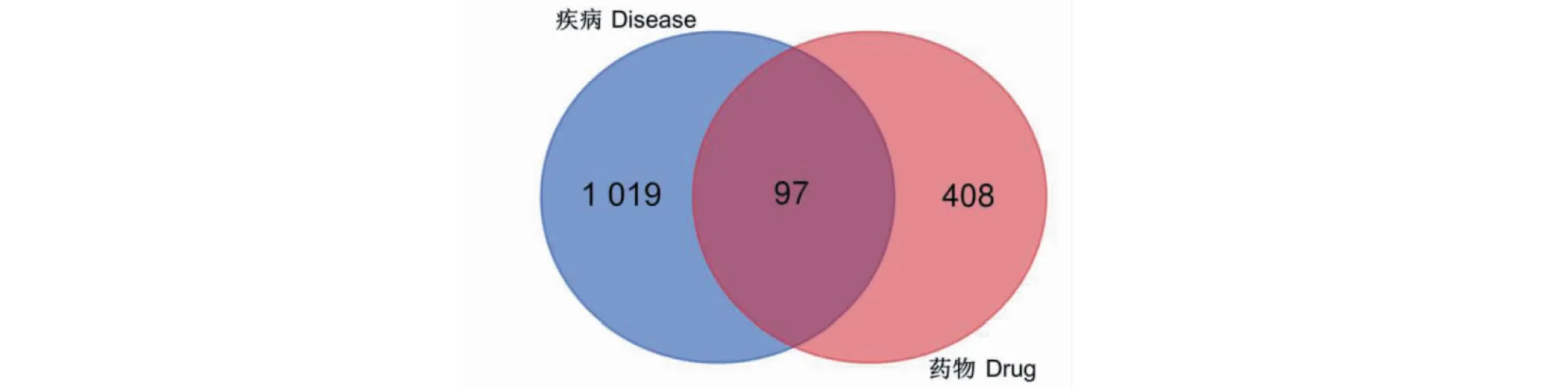
图2 疾病与药物交集靶点韦恩图Fig.2 Venn diagram of the intersection of disease and drug target
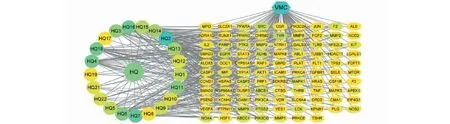
图3 “黄芪活性成分-VMC-靶点”网络Fig.3 “Astragali Radix active ingredient-VMC-target” network
2.6 PPI图的构建
图4展示了根据黄芪潜在作用的97个靶点绘制所得的PPI网络,共有96个靶点蛋白节点(有1个靶点游离,与其他蛋白无相互作用),共有1 271条边。其中颜色较深的靶点蛋白有ALB、TP53、AKT1、MAPK3、VEGFA、CASP3、EGFR等,表明相连的其他靶点数目较多。通过Cytoscape 3.7.1软件的网络分析工具,将degree值≥50的重要靶点依次导入DisGeNET数据库,获取靶点对应的类型,详细信息见表2。
2.7 基因功能及通路分析
利用R语言对97个靶点进行GO分析和KEGG通路分析,设定阈值P<0.01。GO富集分析包括3个分支,分别是细胞组分(cellular component,CC)、分子功能(molecular function,MF)和生物过程(biological process,BP)对基因产物进行相关注释。
CC分析中可知,相关靶点主要涉及膜(membrane)、转录因子复合体(transcription factor complex)、细胞质囊泡腔(cytoplasmic vesicle lumen)、细胞-底物连接(cell-substrate junction)以及免疫突触(immunological synapse)等。MF分析中,这些靶点很大程度上与磷酸酶结合(phosphatase binding)、细胞因子受体结合(cytokine receptor binding)、丝氨酸水解酶活性(serine hydrolase activity)、蛋白质酪氨酸激酶活性(protein tyrosine kinase activity)及转录因子的活性(transcription factor activity)等功能有关。BP分析,上述靶点大多涉及对营养水平和氧气水平的反应(response to nutrient and oxygen levels)、对肽基酪氨酸的修饰调控(modification and regulation of peptide tyrosine)、ERK1和ERK2级联的调控(regulation of ERK1 and ERK2 cascade)、细胞对氧化应激的反应(response to oxidative stress)。取排名前10的通路建立柱状图,如图5所示。
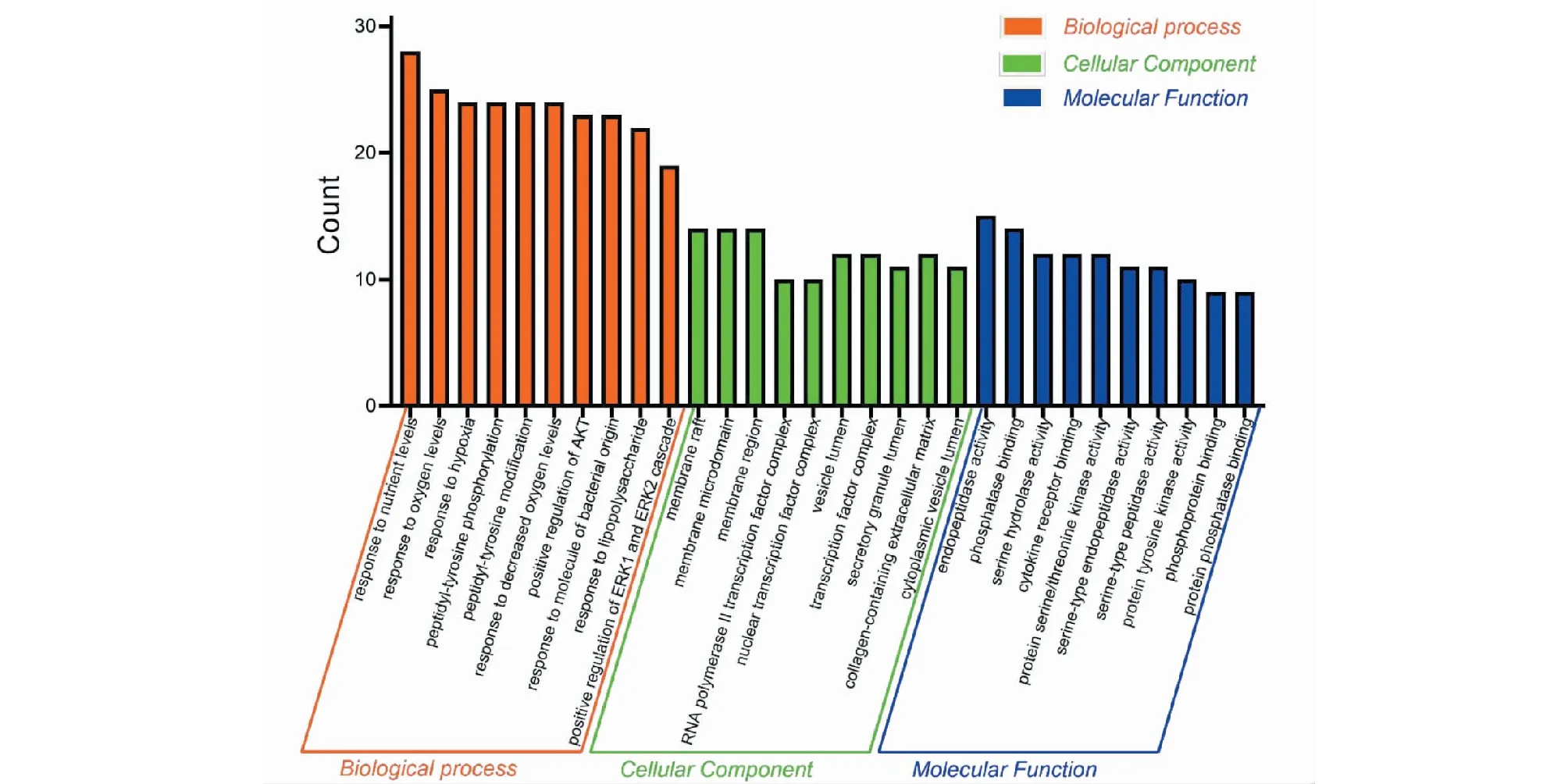
图5 黄芪活性成分潜在治疗VMC靶点的GO分析图Fig.5 GO analysis of Astragali Radix active ingredients for potential treatment of VMC targets
排名前20的KEGG通路富集信息气泡图(见图6)结果显示,黄芪治疗VMC的主要靶点主要涉及PI3K-Akt信号通路(22个靶点/24%)、TNF信号通路(15个靶点/16%)、细胞凋亡通路(15个靶点/16%)及Th17细胞分化(13个靶点/14%)等信号通路。
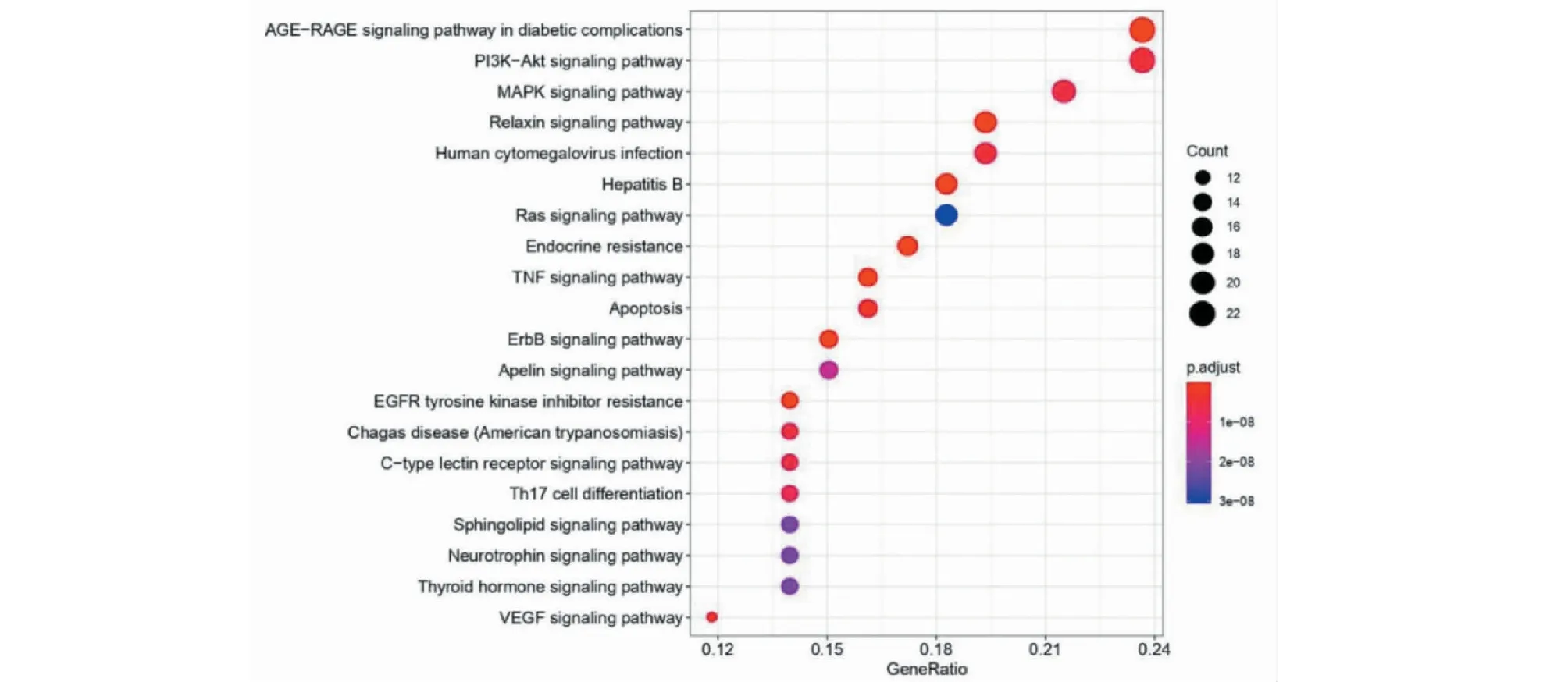
图6 黄芪治疗VMC关键靶点参与的通路富集信息气泡图Fig.6 Bubble map of pathway enrichment information involved in key targets of Astragali Radix in the treatment of VMC
依据KEGG通路分析数据结果,绘制出“靶点-KEGG通路”网络(见图7),共得到78个节点和310个关系。图中菱形代表关键作用靶点,六边形代表KEGG富集前20的通路。根据图形的透明度代表这个靶点或通路的富集程度。由图7可观察到,TP53(肿瘤蛋白p53)、AKT1(AKT丝氨酸/苏氨酸激酶1)、EGFR(表皮生长因子受体)、CASP3(半胱天冬酶3)、VEGFA(血管内皮生长因子A)等靶点及PI3K-Akt信号通路、TNF信号通路等通路富集程度较高。

图7 “靶点-KEGG通路”网络Fig.7 “Target-KEGG pathway” network
2.8 分子对接结果
Dock系统对接Total score>4.25时,表明分子与靶点之间存在结合活性,Total score>5.0证明结合活性较高,Total score>7.0说明两者存在强烈的结合活性[11]。本研究选择连接靶点数目最多的前8种活性成分(包括槲皮素、3,9-二-O-甲基尼森香豌豆紫檀酚、山奈酚、华良姜素、(3R)-3-(2-羟基-3,4-二甲氧基苯基)铬-7-醇、异鼠李素、美迪紫檀素和白桦脂酸)和5个关键作用靶点(TP53、AKT1、EGFR、CASP3和VEGFA)依次进行分子对接验证,对接参数详见表3。结果以热图的形式呈现(见图8),其中数值代表分子对接作用的分值,数值越大表示黄芪中的活性成分与靶点蛋白的分子对接亲和作用越强。
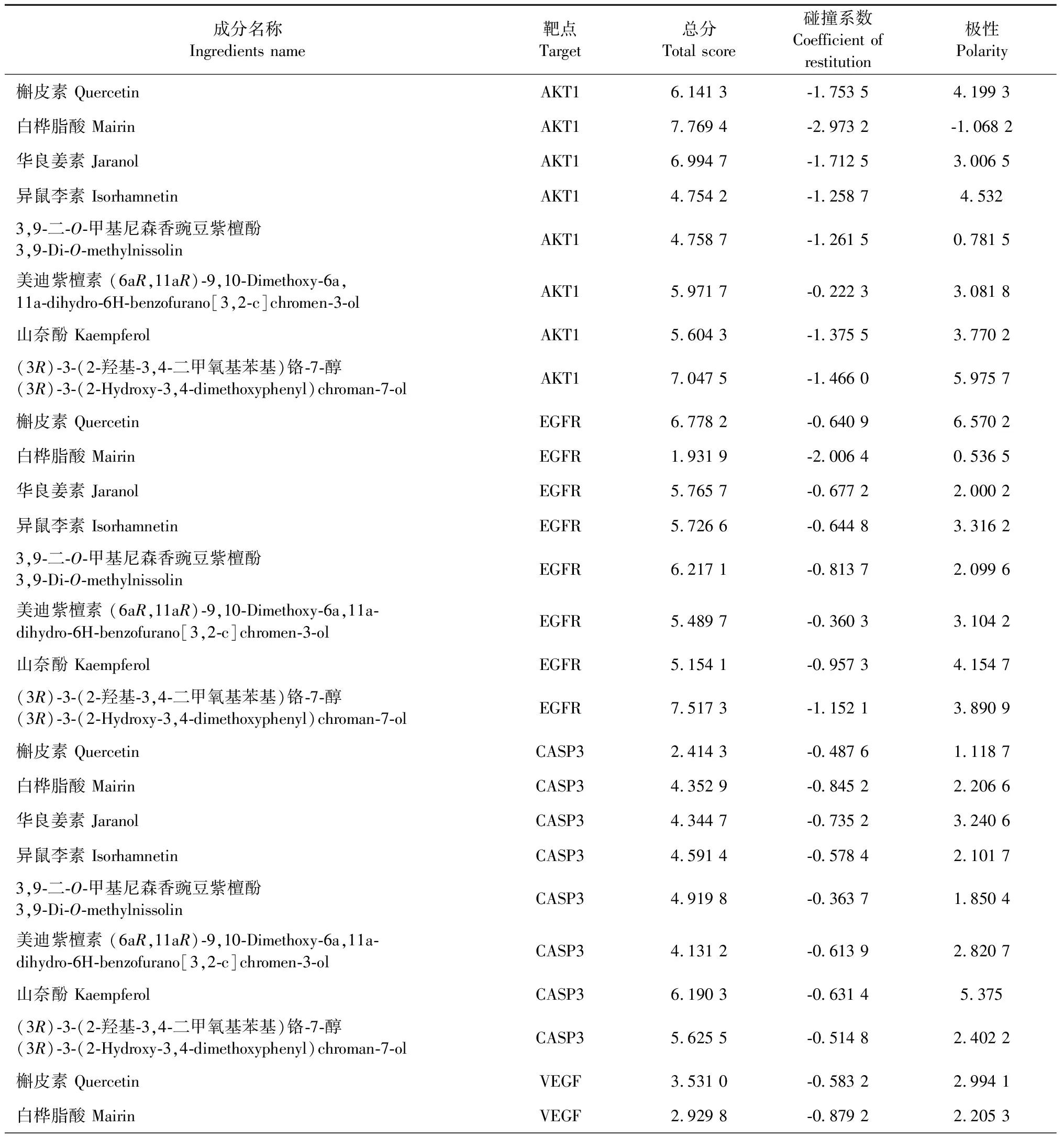
表3 黄芪活性成分与靶点分子对接结果
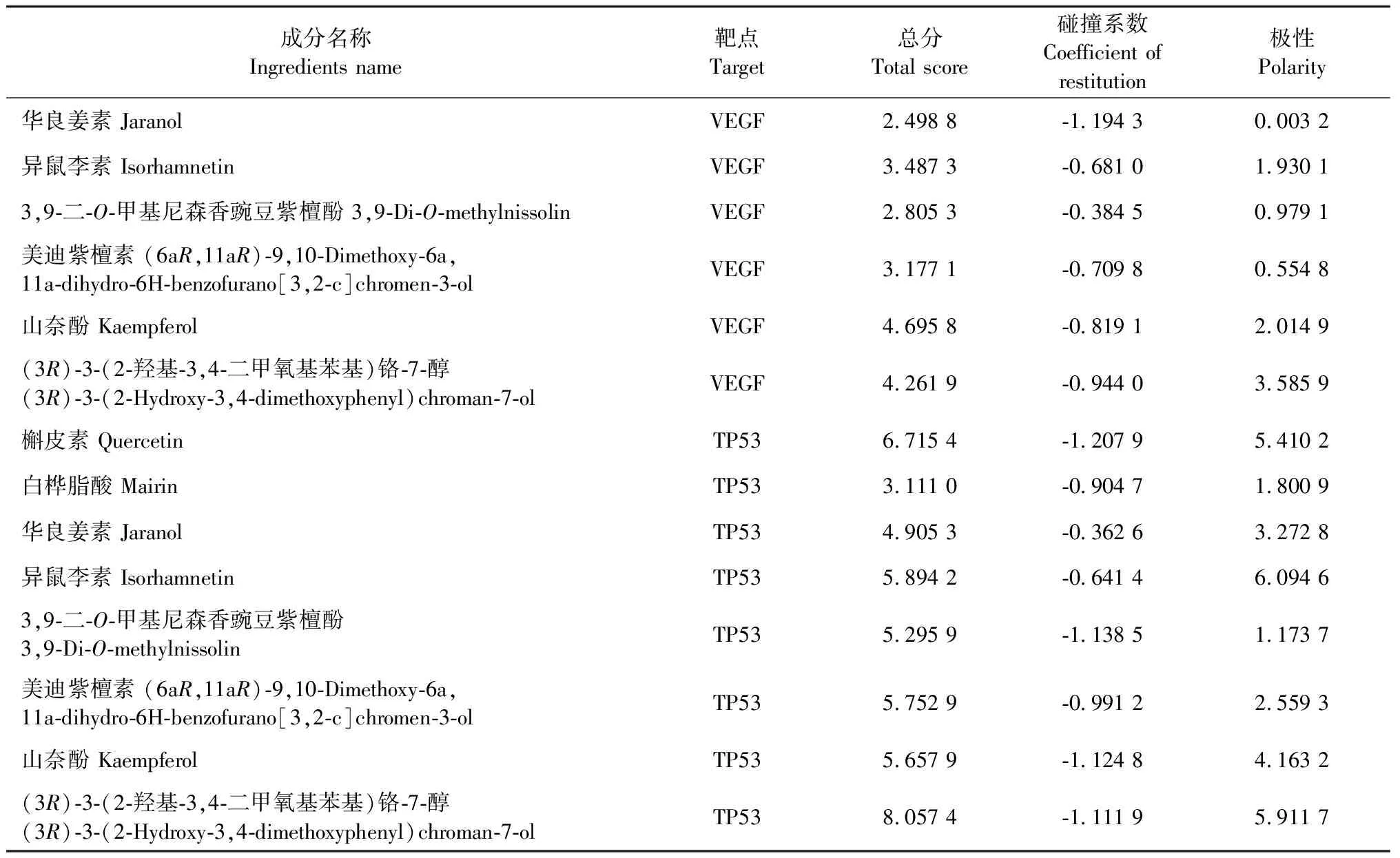
续表3(Continued Tab.3)
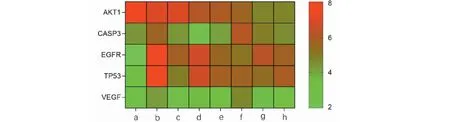
图8 黄芪活性成分与靶点分子对接结果Fig.8 Docking results of active components of Astragali Radix and target molecules注:a:白桦脂酸;b:(3R)-3-(2-羟基-3,4-二甲氧基苯基)铬-7-醇;c:华良姜素;d:槲皮素;e:美迪紫檀素;f:山奈酚;g:3,9-二-O-甲基尼森香豌豆紫檀酚;h:异鼠李素。Note:a:Mairin;b:(3R)-3-(2-Hydroxy-3,4-dimethoxyphenyl)chroman-7-ol;c:Jaranol;d:Quercetin;e:(6aR,11aR)-9,10-Dimethoxy-6a,11a-dihydro-6H-benzofurano[3,2-c]chromen-3-ol;f:Kaempferol;g:3,9-Di-O-methylnissolin;h:Isorhamnetin.
由上述图表可知,TP53与(3R)-3-(2-羟基-3,4-二甲氧基苯基)铬-7-醇(8.057 4)、AKT1与白桦脂酸(7.769 4)、EGFR与(3R)-3-(2-羟基-3,4-二甲氧基苯基)铬-7-醇(7.517 3)、CASP3与山奈酚(6.190 3)结合情况较好。以上分子对接模式见图9,配体与受体结合构象模式越稳定,提示黄芪活性成分在治疗VMC发挥作用的可能性越大。
3 讨论与结论
黄芪作为传统补气药,有着补脾益气、脱毒生肌等功效。而黄芪的不同主要活性成分在治疗病毒性心肌炎上影响不同,各有优势。本研究中,将黄芪的22个活性成分纳入讨论,共获得505个药物靶点,与VMC相关的靶点1 116个。其中槲皮素、3,9-二-O-甲基尼森香豌豆紫檀酚、山奈酚、(3R)-3-(2-羟基-3,4-二甲氧基苯基)铬-7-醇、华良姜素等相连靶点数目较多,在治疗VMC方面会起到关键作用。已有研究证明,槲皮素是通过激活PI3K/Akt通路,来减轻CVB3诱导的心肌细胞损伤的[12]。此外,槲皮素还能抑制炎性反应,具体表现为IL-1β、IL-6和iNOS水平降低[13]。而黄酮类化合物山奈酚能通过mTOR通路,抑制缺氧心肌细胞的凋亡[14]。而其他成分如何发挥作用还有待研究。
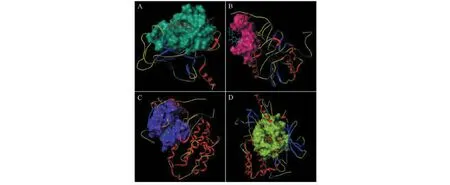
图9 黄芪活性成分与靶点分子对接模式Fig.9 Docking mode of Astragali Radix active components and target molecules注:A:TP53与(3R)-3-(2-羟基-3,4-二甲氧基苯基)铬-7-醇;B:CASP3与山奈酚;C:EGFR与(3R)-3-(2-羟基-3,4-二甲氧基苯基)铬-7-醇;D:AKT1与白桦脂酸。Note:A:TP53 and (3R)-3-(2-hydroxy-3,4-dimethoxyphenyl)chroman-7-ol;B:CASP3 and kaempferol;C:EGFR and (3R)-3-(2-hydroxy-3,4-dimethoxyphenyl)chroman-7-ol;D:AKT1 and mairin.
根据“黄芪活性成分-VMC-靶点”网络以及蛋白互作网络分析可知,能作用疾病的潜在靶点97个,可见黄芪治疗VMC具有多成分、多靶点的特点。重要的靶点蛋白(如ALB、TP53、AKT1、MAPK3、VEGFA、CASP3、EGFR等),它们的蛋白类型不同包括转录因子、信号转导因子、酶、转运因子等,这提示多靶点发挥协同治疗作用,这也体现了中医药治疗疾病的整体性与系统性。其中已有研究证明[15,16],黄芪能显著降低心肌组织中凋亡相关因子Caspase-3的表达水平,减轻心肌细胞凋亡程度。而其他因子的影响情况可以作为今后研究切入的方向。
白介素(IL)、肿瘤坏死因子(TNF)是重要的促炎细胞因子,参与调节细胞炎性反应。多项研究证明[17,18],黄芪治疗VMC后,血清中细胞炎性因子IL-6、IL-8、TNF-α水平显著降低,有效缓解患者体内炎症反应。STAT3(转录活化因子3)信号通路被激活,会诱发心肌内源性保护机制,从而促进心肌血管生长,减慢心肌细胞凋亡[19]。有研究发现,黄芪治疗VMC的过程中对STAT3及其通路有影响[20],主要是影响病毒的复制,而对正常心肌细胞的功能不会产生影响。此外,黄芪还能下调心肌组织中Caspase-3的表达[16],来减轻心肌细胞凋亡程度。其他靶点的作用方式值得进一步探索。
通过靶点GO富集分析,结果提示位于膜组织、转录因子复合体、免疫突触等细胞组分上的黄芪关键基因,可能通过影响潜在靶点与相关激酶、细胞因子受体、转录因子等的结合,从而调控营养水平、氧气水平、级联反应、应激反应等生物过程来治疗病毒性心肌炎的。靶细胞表面的Fas受体能与膜表面的FasL受体蛋白结合,可诱发靶细胞凋亡。Liu等[21]研究提示,黄芪或许是通过下调VMC小鼠心肌组织相关细胞表面的FasL与Fas基因转录,来减少Fas和FasL的表达发挥保护心肌作用。免疫突触可能也十分重要。Qi等[22]研究证明黄芪注射液能激活Treg细胞的免疫应答,进而分泌IL-10和TNF-β,抑制Th17细胞分泌IL-17和IL-21,发挥保护心肌作用。Zhang等[15]的基础研究证明,黄芪三皂苷(AST)可以显著抑制小鼠外周血中肌酸激酶同工酶(CK-MB)及乳酸脱氢酶(LDH)水平。已有临床研究证明[18],黄芪能通过抑制氧化应激的激活与扩散,减轻心肌损伤,从而起到保护心肌的作用。而营养条件和氧气供给对于心功能不足患者来说尤为重要,提示黄芪活性成分可能通过改善和调节患者的营养和氧气情况,来减轻心肌损伤的。有研究发现[17,23],黄芪抑制炎性反应发挥治疗VMC作用时,大多会下调TNF-α的表达。Zhong等[24]的基础研究证明,使用黄芪甲苷治疗后小鼠的心肌浸润和坏死积分明显降低,病灶周围细胞凋亡指数明显减轻。由此证明,黄芪治疗VMC可能是多靶点、多通路的调节机制。
就目前已有研究来看,黄芪治疗病毒性心肌炎机制较多,可能与氧化应激反应、抑制炎性反应、细胞凋亡、免疫调节等都存在一定的相关性。在KEGG通路富集分析后,提示这些机制或许与PI3K-Akt信号通路、TNF信号通路、细胞凋亡通路及Th17细胞分化等信号通路有关。此外,还有一些尚未涉及的生物过程和通路(如糖尿病并发症中的AGE-RAGE信号通路、ErbB信号通路、MAPK信号通路、松弛素信号通路、人巨细胞病毒感染)有待发掘和验证。
基于网络药理学,本研究阐述了中药黄芪治疗病毒性心肌炎的活性成分、潜在作用靶点及发挥药效的生物学通路。研究结果初步揭示了黄芪治疗VMC的相关作用机制,为接下来深入研究其药理作用机制提供理论基础。然而,本研究还存在一定的不足,仅借助数据库现有已验证数据对黄芪治疗VMC的药效机制进行预测,还需要通过许多基础研究和临床研究进行验证。因此,本研究旨在为黄芪治疗病毒性心肌炎相关的作用机制提供思路和参考。

