肠道微生物代谢苷类化合物的研究进展
谢果珍,黄莉莉,张水寒,谭周进*
1湖南中医药大学,长沙 410208;2湖南省中医药研究院中药研究所,长沙 410013
苷(glycosides)是由糖或糖的衍生物与苷元(aglycone)通过糖基端的碳原子连接而成的一类化合物[1],广泛存在于中药中。苷类化合物的苷元类型丰富,凡结构中有羟基、羧基、氨基或巯基等基团的化合物均可成为苷元。另外,苷类化合物的结构上有一个或多个糖基,极性大,脂溶性低,低膜通透性导致其口服的生物利用率普遍较低,但苷类药物在临床治疗中却表现出很好的疗效。苷类药物的生物利用度低但疗效好的现象引起了研究者们的极大兴趣。
研究认为,苷类化合物进入机体后被肠道中的微生物及其分泌的酶转化为极性小、脂溶性大的次级苷或苷元,苷元被吸收后在肠道上皮和肝脏中被I相和II相药物代谢酶所代谢,并通过尿液和胆汁排出或通过肝肠循环返回肠道[2]。随后,一些残留的苷元和/或代谢衍生物进入血管体循环。而苷类化合物在肠道的代谢产物,大多表现出比其母体更好的生物活性[3]。因此,肠道微生物对苷类成分的代谢是其药效发挥的前提,本文将综述肠道微生物对苷类化合物的代谢及其意义。
1 肠道微生物及代谢酶
健康成人的肠道微生物主要由厚壁菌门、拟杆菌门、变形菌门、放线菌门、梭杆菌门及疣微菌门的细菌组成,且90%以上物种属于厚壁菌门和拟杆菌门[4]。研究表明,双歧杆菌属、乳杆菌属、拟杆菌属、乳球菌属、肠球菌属、真杆菌属、毛螺菌属、梭菌属和大肠杆菌对苷类化合物的代谢起着非常重要的作用[5]。双歧杆菌、乳杆菌、毛螺菌及肠球菌高效参与了苷类化合物的脱糖水解反应,而拟杆菌和梭菌可进一步降解苷元[5]。肠道微生物对苷类化合物的代谢实质上是其所分泌的酶对底物选择性代谢的结果。
肠道微生物可分泌庞大的代谢酶系,包括糖苷水解酶、硝基还原酶、偶氮还原酶、脲酶、硫酸化酶以及甲基化酶等[3]。苷类化合物进入机体后,酶参与脱糖基、脱甲基、脱羟基、水解、氧化还原等反应,使苷类化合物的化学结构发生改变,活性也得以产生或增强[6]。
肠道微生物分泌的糖苷水解酶在苷类化合物的代谢中最为关键[7]。脱糖基通常是苷类化合物发挥益生元作用及进一步转化的先决条件[8]。糖苷水解酶利用二羧酸残基和水分子水解糖苷键,释放出游离糖及次级苷/苷元,游离的糖基可作为能量来源促进肠道特定微生物的生长[9],而次级苷/苷元或吸收入血发挥药效,或被其他酶进一步代谢。不同的糖苷水解酶作用于不同的糖苷键,具有底物特异性。如β-D-葡萄糖苷酶(β-D-glucosidase)的底物特异性较差,可广泛裂解含C-O、C-S、C-N和C-F等β-糖苷键的苷类化合物[10]。Bifidobacteriumadolescentis、Bifidobacteriumlongum、Enterococcusfaecalis、Bacteroidesovatus、Bacteroidesuniformis、Parabacteroidesdistasonis和Escherichiacoli等菌种具有β-D-葡萄糖苷酶活性[9]。β-D-葡萄糖醛酸苷酶(β-D-glucuronidase)是一种重要的II相代谢酶,可有效切割黄芩苷及甘草酸中的β-1,4-葡萄糖醛酸苷键,Eubacteriumsp.GLH、Ruminococcussp.PO1-3具有β-D-葡萄糖醛酸苷酶活性[10]。α-L-鼠李糖苷酶(α-L-rhamnosidase)可作用于苷类化合物结构中的α-L-鼠李糖基,Bifidobacteriumcatenulatum和Bifidobacteriumpseudoatenultum含有表达α-L-鼠李糖苷酶的基因[11]。葡萄糖是肠道微生物优先使用的碳源,因此结构中同时存在葡萄糖基和其他糖基时,肠道微生物对β-D-葡萄糖苷键的水解往往优先于其他糖苷键的水解[12]。
同一菌株具有表达不同代谢酶的能力,不同菌株表达的代谢酶的种类有差异,代谢酶具有一定的底物特异性,因此复杂的肠道微生物及其酶系共同影响着机体对苷类化合物的代谢。一个典型的例子是大豆异黄酮的肠内代谢。研究表明,大豆异黄酮的临床疗效可能是由其在肠道中转化的二氢大豆苷元、四氢大豆苷元、雌马酚和O-去甲基安哥拉素等代谢物所实现[13]。尤其是雌马酚,比其代谢前体具有更好的雌激素样、抗癌及抗氧化作用[14]。人类个体将大豆异黄酮转化为雌马酚的能力表现出高度的差异性,大约只有30%~40%的人群具有转化大豆异黄酮得到雌马酚的能力[15]。Hur[16]和Wang等[17]从人类粪便和牛瘤胃内容物中分离出能够将大豆异黄酮代谢为二氢大豆苷元的菌株Lactobacillussp.Niu-O16和将二氢大豆苷元代谢为雌马酚的菌株Eggerthellasp.Julong 732。Wang等[18]将上述两个菌株混合培养,发现大豆苷元完全转化为雌马酚而没有产生中间产物二氢大豆苷元,说明不同菌株代谢苷类化合物后得到的产物有差异,而苷类化合物在肠道中的代谢是多种细菌共同作用的结果[19],这一点也可由多种细菌混合代谢苷类成分得到的产物量高于单种细菌代谢所得到的产物量而加以证实。粪芽孢菌属的菌株MRG-1对大豆苷具有β-D-葡萄糖苷酶活性,对大豆苷元则表现出还原酶活性,可将大豆苷元转化为二氢大豆苷元,说明一个菌株可能具有多种代谢功能[20]。
因肠道微生物的个体多样性影响着药物代谢,比较生理状态及病理状态下肠道微生物对药物的差异化代谢为明确药效的物质基础提供了思路。正常小鼠及2型糖尿病小鼠对黄芩苷的转化有较大差别。厌氧孵育48 h后,2型糖尿病小鼠的粪便孵育液中黄芩素的数量比正常小鼠显著增加,且产生了特有的甲基化黄芩苷元——木蝴蝶素A,而2型糖尿病大鼠代谢黄芩苷能力的提高归因于肠道β-D-葡萄糖醛酸苷酶活性的增加[3,21]。Gao等[22]比较了甘草酸在肝炎患者和肝癌患者肠道中的代谢产物,发现除甘草酸单糖水解产物、苷元、脱氢苷元、脱羧基苷元等相同的代谢产物外,在肝炎患者肠道菌群的含药孵育液中还鉴定出脱羟基苷元,而在肝癌患者肠道菌群孵育液中并未检测到。Zhu等[23]比较了正常大鼠和免疫抑制大鼠代谢人参皂苷的差异,发现了特异性的代谢产物及菌群。以上报道说明疾病机体的肠道微生物及代谢酶发生改变并对药物进行特异性代谢,而特异性代谢产物可能是药物治疗疾病的真正有效成分。因此,从不同用药个体的肠道中寻找具有标志性的药物代谢物,可为解释“同药不同效”“异病同治”等现象提供参考。
综上所述,苷类化合物进入机体肠道后被特异性代谢的微生物及酶所识别,并首先对其进行脱糖水解,脱去的糖基成为肠道微生物的能量来源,而脱糖后的代谢产物被吸收入血发挥药效,因此苷类化合物可同时发挥益生元及药效作用。苷类化合物与肠道微生物的相互关系见图1。

图1 苷类化合物与肠道微生物的相互关系Fig.1 Interaction of glycosides with gut microbiota
2 肠道微生物对苷类化合物的代谢
苷类化合物根据苷元结构分为黄酮苷、萜苷、甾体皂苷、苯乙醇苷、蒽醌苷、香豆素苷、木脂素苷和生物碱苷等。结构相似的化合物,在肠道中具有相似的代谢途径和代谢产物。
2.1 肠道微生物对黄酮苷的代谢
目前有超过15 000个黄酮类成分从植物中被分离鉴定出来[24]。黄酮类化合物极少以游离的形式存在,多与糖相连,以糖苷的形式存在。黄酮苷由两个苯基环(A和B)、一个含氧杂环(C)和取代糖基组成(见图2)。根据糖基与苷元的连接方式可分为黄酮氧苷和黄酮碳苷。研究证明,黄酮氧苷在肠道中较易被水解,而黄酮碳苷因结构较稳定而较难被水解。
许多肠道细菌具有切断黄酮氧苷糖苷键的能力,只有少数几种细菌可裂解黄酮碳苷的糖苷键,但大多数可裂解黄酮碳苷的细菌也可作用于黄酮氧苷的去糖基化[9]。双歧杆菌属和拟杆菌属有大量菌株表现出活跃的代谢黄酮氧苷的能力,如BifidobacteriumadolescentisJCM 1275、BifidobacteriumangulatumMB 223、BacteroidesuniformisJCM 5828、BacteroidesuniformisATCC 8492。Robinsoniellsp.CG19-1和Eubacteriumcellulosolvens6可水解黄酮类碳苷,但对异黄酮类碳苷葛根素没有去糖基化的活性,表现出底物特异性[25]。Takagaki等[26]报道大鼠肠道中的Adlercreutziaequolifaciens和Flavonifractorplautii具有C环切割和进一步裂解间苯三酚的能力,可代谢产生一系列小分子物质。
大多数黄酮苷在肠道微生物及代谢酶的作用下通过脱糖水解产生苷元,苷元继续代谢产生多种环状裂变产物[27]。黄酮苷A环裂解后产生间苯三酚等羟基化芳香化合物,间苯三酚可在肠道微生物的作用下完全降解为短链脂肪酸[9];B环裂解后产生酚酸[27]。不同苷元类型的黄酮苷C环裂解后的产物不同,如黄烷酮苷C环裂解产生查尔酮,查尔酮进一步还原为二氢查尔酮,二氢查尔酮水解生成羟基苯基丙酸。异黄酮苷C环裂变生成O-去甲基安哥拉素,后者进一步降解为更小的酚类[9]。
2.1.1 葛根素
葛根素(puerarin)是中药葛根的主要活性成分,在大豆苷元的C-8位上连接着葡萄糖,属于异黄酮碳苷。葛根素与大豆苷(daidzin)为同分异构体,因此表现出相似的肠内代谢途径(见图2),即先脱去葡萄糖生成大豆苷元(daidzein),大豆苷元加氢成为二氢大豆苷元(dihydrodaidzein)、四氢大豆苷元(tetrahydrodaidzein),而后生成雌马酚(equol)。Kim等[28]将葛根素与人肠道菌群共孵24 h,检测到大豆苷元和毛蕊异黄酮2种代谢产物。Nakamura等[29]发现葛根素去糖基化时生成了关键的中间产物——3"-oxo-葛根素(3"-oxo-puerarin)。
Kim等[30]从人类粪便中分离出Lactococcussp.MRG-IFC-1和Enterococcussp.MRG-IFC-2,可裂解葛根素中的碳糖苷键,同时这两种细菌表现出氧糖苷酶活性,可广泛水解各种异黄酮和黄酮的氧糖苷键。Gaya等[31]首次在双歧杆菌属发现了将葛根素转化为大豆苷元和二氢大豆苷元的菌株B.animalisINIA P900,而肠球菌属的E.faecalisINIA P90和E.faeciumINIA P1将葛根素转化为大豆苷元,但没有产生二氢大豆苷元。以上3个菌株还表现出去甲基化的能力。Nakamura等[29]将Doreasp.PUE中的DgpA蛋白鉴定为葛根素氧化酶,其以3"-oxo-葛根素作为葛根素氧化的氢化物受体,随后DgpB-C切断3"-oxo-葛根素的C-糖苷键,从而生成大豆苷元。
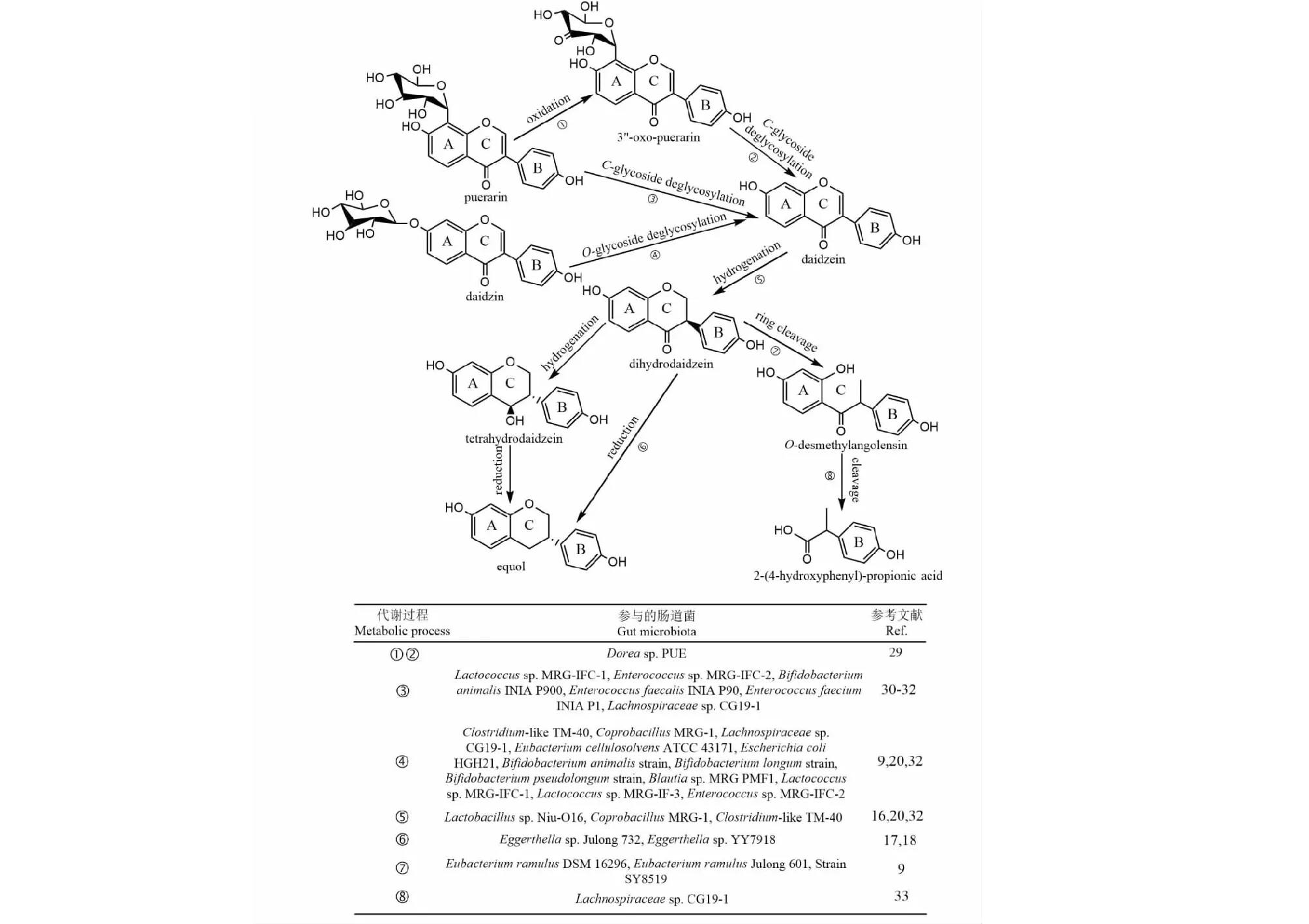
图2 肠道微生物对葛根素及大豆苷的代谢Fig.2 Metabolism of puerarin and daidzin by gut microbiota
2.1.2 芦丁
芦丁是槐米、黄芪、陈皮等中药的成分之一,以槲皮素为苷元,在C-3位羟基上连接了一分子葡萄糖和一分子鼠李糖,属于黄酮氧苷。芦丁在人体与动物肠道中都以脱糖水解为主,且表现出2条代谢途径。途径一为芦丁首先被α-L-鼠李糖苷酶水解成异槲皮苷,然后在β-D-葡萄糖苷酶的作用下进一步水解成苷元槲皮素。槲皮素在体内进一步发生羟基化、甲基化、开环、还原等反应[34,35]。途径二为芦丁在α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的作用下转化为无色花青素[34,35]。
Bifidobacteriumdentium能脱去芦丁结构中的α-L-鼠李糖[36]。芽孢杆菌属(Bacillus)、韦荣球菌属(Veillonella)、拟杆菌属的B.distasonis、B.uniformis和B.ovatuis将芦丁代谢为槲皮素、槲皮素3-O-葡萄糖苷和无色花青素[37]。Bacteroidesfragilis、Clostridiumperfringens、Clostridiumorbiscindens、Eubacteriumoxidoreducens、Eubacteriumramulus、StreptococcusS-2、LactobacillusL-2、BifidobacteriumB-9和BacteroidesJY-6将槲皮素3-O-葡萄糖苷转化为3,4-二羟基苯基乙酸、3,4-二羟基苯甲酸、4-羟基苯甲酸、乙酸、丁酸和间苯三酚等代谢产物[37,38]。
2.1.3 黄芩苷
黄芩苷是黄芩的药效成分,在苷元黄芩素的C-7位羟基上连接了葡萄糖醛酸,为黄酮氧苷。黄芩苷在大鼠肠道菌群孵育液中发生糖苷键断裂得到葡萄糖醛酸和黄芩素,黄芩素通过C环裂解和其他酶催化代谢生成4-羟基苯甲酸、3,4-二羟基苯甲酸、间苯三酚和苯乙酸[39]。
EscherichiacoliHGU-3、EubacteriumLG-22和Lactobacillusbrevissubsp.coagulans产生的β-葡萄糖醛酸苷酶催化水解黄芩苷中连接黄芩苷和葡萄糖醛酸的醚键[40]。将黄芩苷降解为酚酸代谢物的菌株为StreptococcusS-2、LactobacillusL-2和BifidobacteriumB-9[38]。Cui等[41]发现从人肠道中分离出来的Enterococcus和Escherichia具有代谢黄芩苷为黄芩素的能力,Escherichiasp.41还具有脱甲基功能,是生成脱甲基代谢物的关键菌株。
2.1.4 甘草苷
甘草苷是甘草的主要成分,属于二氢黄酮氧苷。甘草苷在肠道微生物的作用下可生成甘草素及其甲基化产物[42]。Zhang等[43]在甘草苷与人粪便的共孵液中发现了乙酰化甘草苷、甘草素、甲基化甘草素、双甲基化甘草素及甘草素脱氧和加氢产物,且从人粪便分离的Bacteroidessp. 57负责乙酰化、Veillonellasp.31和Veillonellasp.48负责脱糖基、Bacillussp.46负责脱氧和加氢反应,Veillonellasp.31、Clostridiumsp.51和Bacteroidessp.57使甘草素甲基化。在肠道碱性环境和肠道微生物的作用下,甘草素C环开环后转化为其同分异构体异甘草素,环裂解产物在体内进一步代谢为4-羟基苯甲酸、3-(4′-羟苯基)丙酸等产物[43]。
2.2 肠道微生物对皂苷的代谢
近年来,皂苷因具有抗肿瘤、抗炎、抗病毒等药理活性成为研究的热点。常见的皂苷为三萜皂苷和甾体皂苷。人参皂苷、三七皂苷、酸枣仁皂苷、黄芪皂苷、甘草皂苷等是被研究较多的皂苷。研究表明,皂苷类化合物在肠道中的代谢以脱糖反应为主,苷元会进一步脱水或脱氢[44,45]。
2.2.1 人参皂苷
人参皂苷是中药人参和三七的主要活性成分,种类繁多,根据苷元类型可分为原人参二醇型、原人参三醇型和齐墩果烷型人参皂苷。人参皂苷进入肠道后从末端开始依次脱去糖基,生成次生苷和苷元发挥药理作用[46,47]。
原人参三醇型皂苷Re,在肠道中的代谢路径为Re→Rg1/Rg2→Rh1/F1→PPT,即Re依次脱去鼠李糖和葡萄糖后得到苷元PPT[48,49]。而原人参二醇型人参皂苷的代谢途径及产物更多样化,以人参皂苷Rb1为例,4个葡萄糖基两两分别连接在C-3及C-20位上,且C-20位的葡萄糖基优先脱去,因此Rb1→Rd→F2/Rg3→CK/Rh2→PPD为主要代谢途径,Rb1→Gyp-XVII→Gyp-LXXV/F2→CK→PPD为次要代谢途径[50](见图3)。齐墩果烷型人参皂苷Ro在大鼠体内生成的主要代谢产物为zingibroside R1、chikusetsusaponin IVa、glucosyl oleanolate、silphioside F和苷元齐墩果酸。齐墩果酸可通过氧化得到齐墩果酸酮和11-oxoerythrodiol[51,52]。
不同的肠道微生物主导着不同的代谢路径。BifidobacteriumanimalisGM1可将Rb1代谢为Rd[53]。BifidobacteriumK-103及BacteroidesJY-6将Rd代谢为F2,并进一步将F2代谢为CK,而FusobacteriumK-60代谢Rb1为Gyp-XVII[54]。同时,BifidobacteriumK-103、BacteroidesHJ15、BacteroidesJY6及FusobacteriumK-60可脱去人参皂苷Re C-6位上的鼠李糖生成Rg1,并继续脱去C-20或C-6位的葡萄糖产生Rh1或F1[55]。值得注意的是,BacteroidesJY6的代谢能力突出,可全程参与人参皂苷Rb1及Re的代谢直至生成苷元,因此可作为体外转化人参皂苷的优选菌株。
2.2.2 柴胡皂苷
柴胡皂苷为齐墩果烷型五环三萜皂苷,其脱糖代谢依赖于肠道菌Eubacteriumsp.A-44、BifidobacteriumSaiko-1和BifidobacteriumSaiko-2所产生的β-D-葡萄糖苷酶和β-D-岩藻糖苷酶[59]。柴胡皂苷a、b1、b2、d在β-D-葡萄糖苷酶的水解作用下转化为前柴胡苷元F、A、D、G,再经β-D-岩藻糖苷酶代谢为柴胡皂苷元F、A、D、G[60]。Liu等[61]在大鼠粪便中发现柴胡皂苷a转化得到的柴胡皂苷元F还发生了脱氢反应生成3-keto-SGf,羟基化反应后生成SGf-27-oic acid。不同研究者对柴胡皂苷c的体内转化有不同观点。Yu等[62]发现不管在人体还是大鼠肠道中均沿着柴胡皂苷c→前柴胡苷元E1、E2→前柴胡苷元E3→前柴胡苷元E的途径转化,且BacteroidesJY-6和BacteroidesYK-4菌株在这一转化过程起着重要作用。而有学者则认为柴胡皂苷c的水解不形成中间产物前柴胡皂苷元,仅形成最终产物柴胡苷元[63]。
2.2.3 甘草酸
甘草酸为齐墩果烷型五环三萜皂苷,在C-3位有两分子葡萄糖醛酸与氧苷键相连。直接被肠道微生物代谢为甘草次酸是甘草酸在体内代谢的主要途径,还可先代谢生成中间产物18β-甘草酸3-O-单葡萄糖苷(GAMG),GAMG再经转化生成甘草次酸[64]。
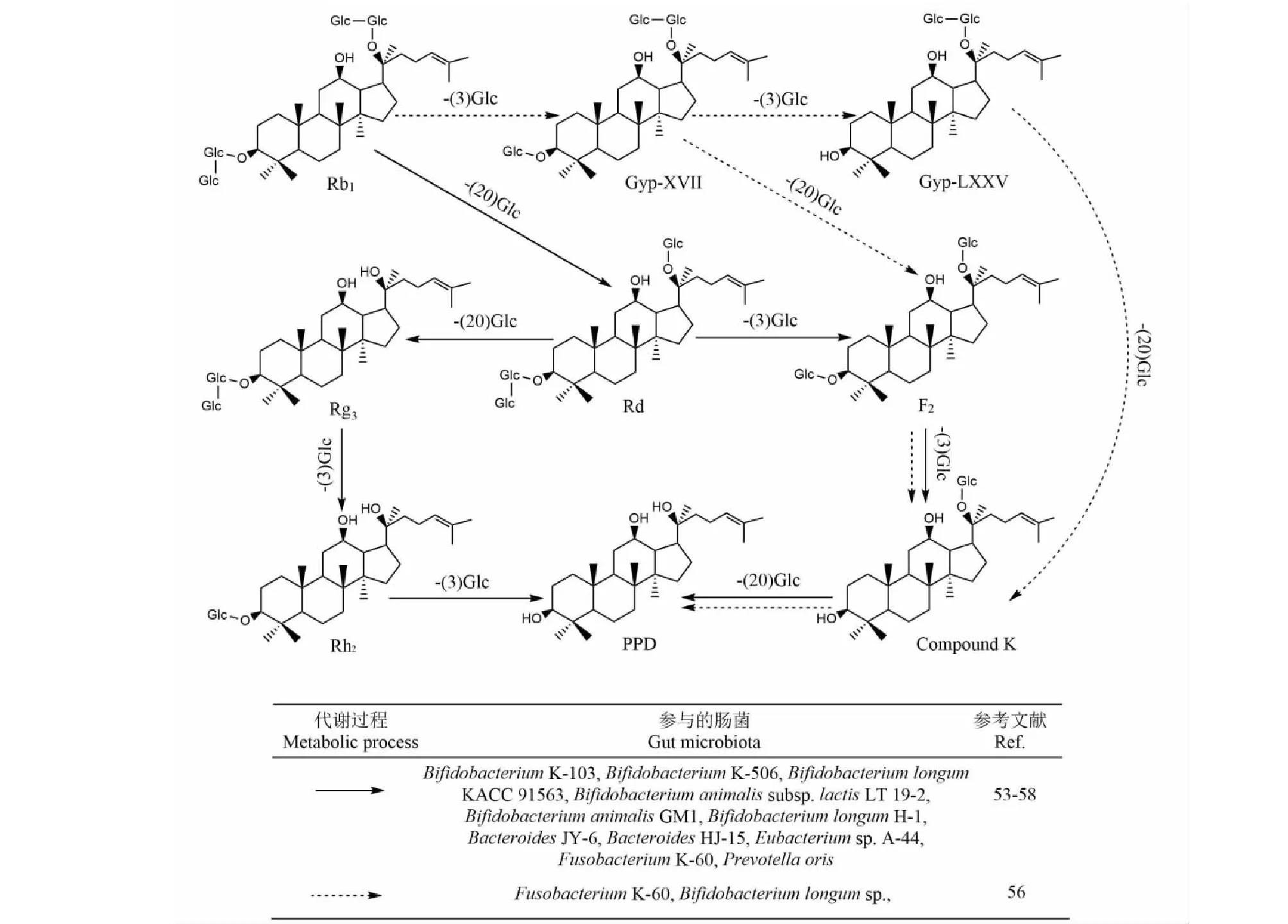
图3 肠道微生物对人参皂苷Rb1的代谢Fig.3 Metabolism of ginsenoside Rb1 by gut microbiota
Eubacteriumsp.GLH、Ruminococcussp.PO1-3、ClostridiuminnocuumES24-06、Streptococcussp.LJ-22和BacteroidesJ-37与甘草酸的体内代谢密切相关[65-67]。尤其是Eubacteriumsp.GLH,可产生甘草酸-β-D-葡萄糖醛酸苷酶和GAMG-β-D-葡萄糖醛酸苷酶,分别将甘草酸和GAMG转化成甘草次酸[68]。Streptococcussp.LJ-22可特异性地将甘草酸转化为GAMG[67]。
2.2.4 酸枣仁皂苷
酸枣仁皂苷A为达玛烷型四环三萜类化合物,由枣仁苷元连接着阿拉伯糖、鼠李糖、木糖和葡萄糖构成,除β-糖苷键在人体肠道环境中较易被水解外,其他糖苷键较难被水解。有研究显示酸枣仁皂苷在肠道内的水解不完全,其原形及代谢产物均可进入血液到达靶器官[69]。Pang等[70]在体外代谢研究中发现酸枣仁皂苷A经肠道菌群代谢仅失去一分子葡萄糖而转变成酸枣仁皂苷B。然而Zhang等[71]在大鼠肠道菌群与酸枣仁皂苷A的共孵液中发现酸枣仁皂苷A的系列脱糖水解产物和苷元,可能与肠道微生物的个体差异有关。
2.2.5 黄芪皂苷
黄芪皂苷是中药黄芪中含量较高的成分,多数黄芪皂苷为环阿屯烷型三萜皂苷。黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ和黄芪甲苷与人肠道菌群共孵的前8 h主要发生脱乙酰基和异构化反应,而在4~24 h均有C-3和C-6位糖苷键的脱糖反应,分别生成brachyoside B和cyclogaleginoside B,之后生成苷元环黄芪醇。共孵24 h之后主要是环黄芪醇发生脱氢反应[44]。霉菌AbsidiacorymbiferaAS2所表达的乙酰酯酶可有效地水解黄芪皂苷Ⅰ和黄芪皂苷Ⅱ中C-3位置的木吡喃酰基残基上的乙酰基并转化为黄芪甲苷[72],但人肠道中负责黄芪皂苷代谢的菌株尚未见报道。
2.2.6 知母皂苷BII
知母皂苷BII属于甾体皂苷,在肠道中依次脱去C-26和C-3位上的β-D-葡萄糖及β-D-半乳糖生成知母皂苷AIII、知母皂苷AI及知母皂苷元。另外,在大鼠粪便中还检测到知母皂苷BII的脱水环合产物知母皂苷BIII及E环裂解产物、知母皂苷BII及BIII的羟基化产物等[12,73]。
2.3 肠道微生物对环烯醚萜苷的代谢
环烯醚萜苷属于环戊烷单萜衍生物,其基本母核为环烯醚萜醇,不稳定。肠道微生物分泌的糖苷水解酶能催化环烯醚萜水解形成苷元。糖基中的半缩醛部分裂解,肠道细菌氮代谢产生的氨与醛基发生加成反应,最终生成含氮化合物[74]。
2.3.1 京尼平苷
Akao等[75]的研究表明,京尼平苷在肠道中先被β-D-葡萄糖苷酶水解为京尼平,继而被酯酶代谢为京尼平苷酸,Eubacteriumsp.A-44具有将京尼平苷转化为京尼平的能力。Kawata等[76]从人粪便中筛选了25种可将京尼平苷转化为京尼平的菌株,其中LactobacillusfermentumATCC 9338、LactobacillusacidophilusATCC 4356、LactobacillusxylosusATCC 155775、LactobacillusplantarumATCC 14917、Escherichiacoli0-127的转化效率较高。Peptostreptococcusanaerobius、KlebsiellapneumoniaeATCC 13883、Fusobacteriumnucleatum、Bacteroidesfragilisssp.thetaotus还可将京尼平苷转化为genipinine。
2.3.2 獐牙菜苦苷
El-Sedawy等[77,78]研究了人体肠道微生物对獐牙菜苦苷及龙胆苦苷的代谢,发现獐牙菜苦苷先被脱糖转化为苷元,苷元随即经过系列中间产物代谢为红白金花内酯,其中间体可以转化为含氮化合物龙胆碱,红白金花内酯的醛基可被细菌脱氢酶还原生成5-hydroxymethylisochroman-1-one。龙胆苦甘表现出相似的代谢路径,即先脱糖转化为苷元,苷元继而转化为红白金内酯和gentiopicral,二者的醛基被还原成相应的醇。
PeptostreptococcusintermediusEBF 77/25、Veillonellaparvulass.parvulaATCC 10790和ProteusmirabilisS2可高效地将獐牙菜苦苷和龙胆苦甘转化生成红白金花内酯。Veillonellaparvulass.parvulaATCC 10790还表现出还原酶活性,可还原红白金花内酯的醛基[77,78]。
2.3.3 芍药苷
Ke等[79]发现芍药苷在离体的大鼠肠道菌群中发生水解、脱葡萄糖、脱苯甲酰基和四元环裂解重排等反应,得到的代谢产物有芍药内酯苷、芍药内酯苷元、脱酰基芍药内酯苷、脱酰基芍药内酯苷元和芍药内酯B等。
2.3.4 桃叶珊瑚苷
桃叶珊瑚苷在人肠道菌群的作用下发生脱糖基和氨基化反应。桃叶珊瑚苷首先被肠道微生物代谢脱去葡萄糖,产生桃叶珊瑚苷苷元,但苷元本身不稳定,可与其同分异构体相互转化,进一步被氨基化生成氨环,同时羟基被氧化为酮基,生成aucubinine A[80]。
2.4 肠道微生物对苯乙醇苷的代谢
苯乙醇苷类化合物的结构包含3部分,即咖啡酸、羟基酪醇和糖基。苯乙醇苷在体内被代谢为羟基酪醇和咖啡酸,咖啡酸在还原酶作用下进一步发生氢化生成二氢咖啡酸,二氢咖啡酸的C-4位脱羟基后生成3-(3′-羟苯基)丙酸。苯乙醇苷的苷元不稳定,因此在肠道代谢物中很少发现苷元的存在[81]。
毛蕊花糖苷是苯乙醇苷的代表性化合物,由咖啡酸和羟基酪醇分别通过酯键和糖苷键与葡萄糖连接,葡萄糖上还连接了一分子鼠李糖。Cui等[82]比较了人与大鼠肠道菌群对毛蕊花糖苷的代谢,毛蕊花糖苷被人肠道微生物代谢的产物为3-(3′-羟苯基)丙酸、羟基酪醇、咖啡酸、二氢咖啡酸、毛蕊花糖苷羟基化产物和毛蕊花糖苷氢化产物;被大鼠肠道微生物代谢产生的主要产物为3-(3′-羟苯基)丙酸和毛蕊花糖苷脱咖啡酸产物。此外,在人与大鼠肠道菌群与毛蕊花糖苷的孵育液中还发现了毛蕊花糖苷的同分异构体异毛蕊花糖苷和连翘酯苷A,说明在肠道中发生了结构重排。松果菊苷和连翘酯苷A的代谢途径与毛蕊花糖苷相似[83,84]。
2.5 肠道微生物对蒽醌苷的代谢
蒽醌苷主要存在于茜草科、豆科、鼠李科、蓼科、百合科和马鞭草科植物中。中药虎杖、大黄、决明子、番泻叶和芦荟中都有蒽醌苷类成分。番泻苷、茜草苷及芦荟苷是被研究较多的蒽醌苷。有研究表明,蒽醌类成分经肠道菌群发挥泻下作用[85]。
番泻苷在肠内有2条代谢途径,一是β-D-葡萄糖苷酶将番泻苷水解成番泻苷元,然后通过还原反应降解生成泻下活性最强的大黄酸蒽酮;二是番泻苷首先被还原成8-葡糖基-大黄酸蒽酮,再被β-D-葡萄糖苷酶水解生成大黄酸蒽酮[9]。
Bifidobacteriumdentium和BifidobacteriumSEN具有脱糖基的能力,但不能完成还原反应;而Eubacteriumrectale、Eubacteriumlimosum、Peptostreptococcusintermedius、Clostridiumperfringens和Lactobacillusxylosus可将番泻苷还原成8-葡糖基-大黄酸蒽酮,但无法继续去糖基;Clostridiumsphenoides、Bifidobacteriumadolescentis、Bifidobacteriumpseudocatenulatum和Bifidobacteriumanimalissubsp.lactis同时具有糖苷水解酶和还原酶活性,因此可高效地将番泻苷代谢为大黄酸酯[40]。
2.6 肠道微生物对木脂素苷的代谢
木脂素是除异黄酮外的另一种植物雌激素,连翘中的木脂素类化合物连翘苷经人肠道菌代谢生成苷元连翘脂素、连翘脂素的脱甲基产物Lantibetin、Lantibetin的单键断裂产物和肠内脂[86]。而连翘苷在大鼠肠道菌群的代谢下主要发生去糖基化、去羟基化和氧化反应,代谢24 h后仅检测到代谢产物1,3,4,6-tetrahydro-1-(3,4-dimethoxyphenyl)-4-(3-methoxyphenyl) furo [3,4-c] furan[83]。
牛蒡苷在小鼠及人肠道菌群作用下首先脱去C-4位的葡萄糖基生成牛蒡苷元,小鼠肠道菌群可继续通过去甲基生成3′-去甲基-牛蒡苷元,去羟基生成3′-去甲基-4′-去羟基牛蒡苷元,牛蒡苷元在人肠道中的代谢产物更为丰富,除上述2种产物外,还生成3′,3′′-去甲基-4′-去羟基牛蒡苷元、3′,3′′,4′′-去甲基-4′-去羟基牛蒡苷元和肠内酯等代谢产物[87]。从人粪便中分离的Eubacteriumsp.ARC-2、Blautiasp.AUH-JLD56、Eggerthellasp.AUH-JLD49s可有效转化牛蒡苷元[88,89]。
3 总结与展望
苷类化合物多作为“前药”,其肠内代谢产物常表现出多样的药理活性。一直以来,肠道微生物对苷类化合物的代谢是药物研究的焦点,技术的发展为研究提供了有力工具,液质联用技术可检测苷类化合物的肠内代谢产物,微生物培养技术和高通量测序技术可用以探究苷类化合物与肠道微生物的相互作用,有助于建立“苷—菌—酶—代谢物”的关系网。然而,相较于数量庞大的肠道微生物及代谢酶,我们对负责苷类化合物代谢的特定微生物菌株、基因及酶知之甚少。另外,现有研究多关注正常机体的肠道微生物对苷的代谢,而疾病机体肠道中所产生的特征代谢产物更能反映苷类化合物发挥疗效的物质基础,因此通过高通量测序技术与微生物培养技术相结合、体内代谢与体外孵育相结合的方法,比较正常机体与疾病机体、不同疾病机体间的肠道特异菌及其代谢苷类化合物产生的特异性产物,更有利于挖掘特异性的药效成分,进而解释疗效机理。在此基础上筛选高效代谢菌株/酶,利用微生物/酶转化技术对苷类化合物进行体外转化,可为新药的研究与开发提供基础。

