植物内生真菌Fusarium guttiforme次生代谢产物研究
李慧媛,岳婧怡,王举涛,2*,蔡百祥*
1安徽中医药大学药学院;2安徽省中药研究与开发重点实验室,合肥 230012;3芜湖职业技术学院,芜湖 241006
内生真菌指一类生活在健康植物组织体内但不引起植物感染病害的微生物,其具有独特的生物学特性,与宿主植物互生互利,且产生多种重要的次生代谢产物,可用于制药、农业,以及具有一系列生物活性的食品工业[1-3]。
镰刀菌属(Fusarium)是一类广泛分布于土壤和植物体内的丝状真菌,近年来,诸多学者对镰刀菌属真菌次生代谢产物进行研究,发现其不仅能产生伏马毒素(fumonis)、单端孢霉烯族毒素(trichothecenes)和玉米赤霉烯酮(zearalenones)三类主要真菌毒素,还能产生萜类、酰胺、醌类和聚酮类等具有广泛的显著的生物活性的次生代谢产物[4-9]。调研相关文献,发现植物内生菌Fusariumguttiforme次生代谢产物的研究较少,为进一步丰富Fusariumguttiforme代谢产物的化学成分,同时考虑固体发酵对其次生代谢产物的影响,本文利用多种色谱分离方法和现代波谱技术,对植物内生真菌Fusariumguttiforme大米发酵次生代谢产物进行化学成分研究,并同时对所获得的化合物进行体外抗炎活性筛选,旨在发现结构新颖和活性较好的先导分子,以期丰富镰刀属内生真菌次生代谢产物。
1 材料与方法
1.1 仪器和材料
AV-500 MHz型核磁共振谱仪(Bruker公司,德国);UPLC-IT-TOF 质谱(Shimadzu Crop公司,日本);LC-3000半制备型HPLC(北京同恒创新科技有限公司,中国);Waters Xbridge C18(250 mm ×20mm,5 μmol/L)色谱柱(Waters公司,美国);ODS C18(45~60 μmol/L)(日本京都YMC株式会社,日本);Sephadex LH-20凝胶(GE公司,瑞士);柱层析硅胶200~300目(青岛海洋化工厂,中国);HSGF254 薄层层析硅胶板(烟台江有硅胶开发有限公司,中国)。
1.2 菌种来源
内生真菌Fusariumguttiforme(GenBank accession No.KC464629.1)来源于安徽中医药大学天然药化教研室,4 ℃保存。
1.3 菌种的发酵提取与分离
将保存在斜面试管中的待发酵菌株接种到灭菌后的PDA培养基(马铃薯浸粉3 g/L、葡萄糖20 g/L、琼脂14.0 g/L)上,于28 ℃恒温培养箱中培养活化5~7天,用灭菌后的5 mm打孔器打孔取其菌饼,将菌饼置于灭菌后的大米固体培养基(100 g大米和110 mL蒸馏水置于1 L的锥形瓶中,121 ℃高压灭菌20 min)中,于28 ℃恒温发酵25天。25天后停止发酵,在每个锥形瓶中加入500 mL乙酸乙酯进行提取,连续减压回流3次后得到待分离浸膏。
该乙酸乙酯部位(20 g)经硅胶柱色谱(200~300目),依次以石油醚-丙酮系统梯度洗脱(100∶0→0∶1,V/V)和二氯甲烷-甲醇系统洗脱(1∶1,V/V),共得到9个组分(A~I)。Fr.B(0.5 g)经Sephadex LH-20柱(MeOH,100%)处理并通过半制备型HPLC(MeOH-H2O,50∶50 V/V)分离得到化合物7(10 mg)。Fr.D(5 g)经MCI(MeOH-H2O,1∶1→0:1,V/V),RP-C18柱(MeOH-H2O,30∶70→100∶00,V/V)洗脱得到S1~S3三个亚组分。S2(0.6 g)经Sephadex LH-20柱(CHCl3-MeOH,1∶1,V/V和MeOH)洗脱,并采用pre-HPLC(MeCN-H2O,60∶40 V/V)得到化合物2(5 mg)、3(8 mg)。Fr.E7(6 g)经Sephadex LH-2柱(MeOH,100%)洗脱,并通过pre-HPLC(MeOH-H2O,60∶40 V/V)纯化,得到化合物1(6 mg)和5(11 mg)。Fr.F(3g)经ODS柱(MeOH-H2O,10∶90→100∶0,V/V)梯度洗脱,得到四个亚组分SF1~SF4。SF2(0.2 g)通过pre-HPLC(MeCN-H2O,60∶40 V/V)纯化,得到化合物4(5 mg)和化合物6(4 mg)。
1.4 化合物NO抑制活性的测试
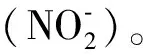
NO生成抑制率 = (OD非药物处理组-OD样品组)/
OD非药物处理组× 100%
2 结果
2.1 结构鉴定


表1 化合物1的1H和13C NMR数据(500和125 MHz,CDCl3)

图1 化合物1~7的结构Fig.1 Structures of compounds 1-7

图2 化合物1的关键1H-1H COSY (-) 和 HMBC (→) 相关性Fig.2 The key 1H-1H COSY (-) and HMBC (→) correlations of compound 1
化合物2白色粉末;分子式为C8H7NO2。1H NMR(400 MHz,(CD3)2CO)δ:9.26(1H,br s,1-OH),8.05(1H,d,J= 13.5 Hz,H-7),7.85(1H,d,J= 13.5 Hz,H-8),7.72(2H,d,J= 8.0 Hz,H-3,5),6.98(2H,d,J= 8.0 Hz,H-2,6);13C NMR(125 MHz,(CD3)2CO);δ:162.2(C-1),117.1(C-2,C-6),132.7(C-3,C-5),122.7(C-4),140.0(C-7),135.9(C-8)。上述数据与文献[10]报道基本一致,因此确定化合物2为(Z)-1-hydroxy-4-(2-nitroethenyl)-benzene。
化合物3无色粉末;易溶于甲醇,分子式C7H6O2为。ESI-MS:121 [M-H]-;1H NMR(400 MHz,CD3OD)δ:9.85(1H,s,CHO),7.81(2H,d,J= 8.4 Hz,H-2,6),7.01(2H,d,J= 8.4 Hz,H-3,5);13C NMR(125 MHz,CD3OD)δ:129.8(C-1),132.6(C-2,6),116.0(C-3,5),161.7(C-4),191.4(C-7)。上述数据与文献[11]报道基本一致,因此确定化合物3为对羟基苯甲醛。
化合物4白色针状结晶;分子式为C29H43O。1H NMR(500 MHz,CDCl3)δ:6.59(1H,d,J= 9.5 Hz,H-6),6.02(1H,d,J= 9.5 Hz,H-7),5.73(1H,br s,H-4),5.25(1H,dd,J= 16.5,6.7 Hz,H-23),5.18(1H,dd,J= 16.5,6.3 Hz,H-22),2.54(1H,m,H-2α),2.48(1H,m,H-2β),2.02(1H,m,H-1α),1.82(1H,m,H-1β),1.05(3H,d,J= 6.0Hz,H-21),0.96(3H,s,H-19),0.94(3H,s,H-18),0.92(3H,d,J= 7.0 Hz,H-27),0.86(3H,d,J= 7.0 Hz,H-26),0.83(3H,t,J= 6.2 Hz,H-29);13C NMR(125 MHz,CDCl3)δ:35.6(C-1),19.0(C-2),199.6(C-3),123.0(C-4),164.4(C-5),124.4(C-6),134.0(C-7),124.5(C-8),44.3(C-9),36.8(C-10),25.4(C-11),34.1(C-12),44.0(C-13),156.1(C-14),34.1(C-15),27.7(C-16),55.7(C-17),16.6(C-18),18.9(C-19),39.3(C-20),21.2(C-21),132.5(C-22),135.0(C-23),42.8(C-24),33.1(C-25),19.6(C-26),20.0(C-27),29.7(C-28),17.6(C-29)。上述数据与文献[12]报道基本一致,因此确定化合物4为stigmasta-4,6,8(14),22-tetraen-3-one。
化合物5无色晶体;分子式为C29H46O2。ESI-MS:427 [M+H]+;1H NMR(400 MHz,CDCl3)δ:6.17(1H,s,H-4),2.53(1H,m,H-2α),2.46(1H,m,H-2β),2.14(1H,dd,J= 5.0,2.8 Hz,H-1β),1.91(1H,dd,J= 9.9,5.7 Hz,H-1α),1.17(3H,s,H-19),0.93(3H,d,J= 6.4 Hz,H-21),0.85(3H,t,J= 7.5 Hz,H-29),0.84(3H,d,J= 7.1 Hz,H-26),0.81(3H,d,J= 6.8 Hz,H-27),0.72(3H,s,H-18);13C NMR(150 MHz,CDCl3)δ:35.5(C-1),33.9(C-2),199.5(C-3),125.4(C-4),161.1(C-5),202.4(C-6),46.8(C-7),34.2(C-8),51.0(C-9),39.8(C-10),20.9(C-11),39.1(C-12),42.5(C-13),55.8(C-14),23.9(C-15),28.0(C-16),56.5(C-17),11.9(C-18),17.5(C-19),36.0(C-20),18.7(C-21),33.8(C-22),26.0(C-23),45.8(C-24),29.1(C-25),19.8(C-26),18.9(C-27),23.0(C-28),11.8(C-29)。上述数据与文献[13]报道基本一致,因此确定化合物5为stigmast-4-ene-3,6-dione。
化合物6无色针状结晶;分子式为C28H43O。1H NMR(500 MHz,CDCl3),δ:5.57(1H,dd,J= 6.6,2.5 Hz,H-6),5.38(1H,m,H-7),5.21(1H,dd,J= 15.9,6.6 Hz,H-23),5.18(1H,dd,J= 15.9,6.6 Hz,H-22),1.03(3H,d,J= 6.6 Hz,H-21),0.94(3H,s,H-19),0.91(3H,d,J= 7.2 Hz,H-28),0.84(3H,d,J= 6.4 Hz,H-27),0.82(3H,d,J= 6.4 Hz,H-26),0.63(3H,s,H-18);13C NMR(125 MHz,CDCl3),δ:38.4(C-1),32.0(C-2),70.5(C-3),40.8(C-4),139.8(C-5),119.6(C-6),116.3(C-7),141.4(C-8),46.3(C-9),37.0(C-10),21.1(C-11),39.1(C-12),42.8(C-13),54.6(C-14),23.0(C-15),28.3(C-16),55.7(C-17),12.1(C-18),16.3(C-19),40.4(C-20),21.1(C-21),135.6(C-22),132.0(C-23),42.3(C-24),33.1(C-25),20.0(C-26),19.7(C-27),17.6(C-28)。上述数据与文献[14]报道基本一致,因此确定化合物6为麦角甾醇。
化合物7白色粉末;分子式为C6H6O3。1H NMR(400 MHz,CD3OD),δ:9.43(1H,s,CHO),7.28(1H,d,J= 3.2 Hz,H-3),6.48(1H,d,J= 3.6 Hz,H-4),4.51(2H,s,H-6);13C NMR(100 MHz,CD3OD),179.5(C-1),153.8(C-2),124.8(C-3),110.9(C-4),163.2(C-5),57.6(C-6)。上述数据与文献[15]报道基本一致,因此确定化合物7为5-羟甲基糠醛。
2.2 生物活性
评估化合物1~7在LPS刺激的RAW 264.7细胞中抑制NO产生的能力。结果(见表2)显示化合物1和2表现出较弱的NO抑制活性,IC50值为48.1和46.6 μmol/L,阳性对照LNMMA(NG-单甲基-L-精氨酸盐酸盐)的IC50为38.2 μmol/L。
3 讨论
本研究从植物内生菌F.guttiforme大米发酵物的乙酸乙酯部位分离鉴定了7个化合物,其中化合物1为一种新型的含过氧键的二聚苯衍生物,化合物2~7分别为苯衍生物、酚酸类、甾体类化合物、麦角甾醇及糠醛类化合物,均首次从该真菌中分离得到,极大地丰富了镰刀菌属次生代谢产物结构的多样性。同时,二聚体或多聚体衍生物大多具有较强的药理活性和稳定性,其中对二聚体类衍生物研究偏多,Paik等[16]报道了一系列含有苯环结构的二聚体衍生物,其中邻苯二甲酸酯二聚体对人子宫颈癌具有很好的选择性和杀伤性,对正常宫颈细胞没有细胞毒性作用。烷基、酯基、醚键等连接的青蒿素二聚体往往比单核化合物具有更高体内外抗疟疾的活性、更低的毒副作用和稳定的理化性质[17,18]。此外,已有报道表明苯环衍生物、酚类和甾体类化合物等具有抗炎、抗氧化、抗肿瘤、抑菌等活性,因此本文对从F.guttiforme中分离所得到的化合物1~7抗炎活性进行体外初步评估,结果表明化合物1和2表现出一定的NO生成抑制活性,IC50值为48.1和46.6 μmol/L,初步阐明了镰刀菌F.guttiforme的活性物质基础,为后续药理实验的开展提供参考,同时亦可为镰刀菌相关研究提供一定科学价值。
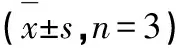
表2 化合物1~7在RAW 246.7细胞中抑制NO产生的IC50值

