微小RNA-455-3p下调TRIM27对鼻咽癌细胞增殖、凋亡的影响
黄香春,谭雪萍,廖天志
作者单位:恩施土家族苗族自治州中心医院,a耳鼻喉科,b中西医结合肿瘤科,湖北 恩施 445000
鼻咽癌(nasopharyngeal carcinoma,NPC)是发生在鼻咽黏膜上皮的一种恶性肿瘤,其发病率居耳鼻咽喉恶性肿瘤之首[1-3]。鼻咽癌容易发生转移及复发,其预后较差。因此,早期诊断和治疗具有重要意义。miRNA为长度在19~25个核苷酸的内源性稳定的短链非编码RNA,其在人类多种疾病中均具有重要的调控作用,尤其是癌症[4-5]。miR-455-3p 在多种癌症的发生发展中均具有调控作用,但其在鼻咽癌中的作用研究甚少。含有三联基序的27(tripartite motif 27,TRIM27)属于三结构域(TRIM)蛋白家族,其含有由RING 指,B 盒锌指和卷曲螺旋结构域组成的三联基序[6-7]。它最初被鉴定为与转染期间排列的RET(rearranged during transfection,RET)原癌基因融合伴侣,其在多种肿瘤中均出现表达异常升高[8-10]。据报道,TRIM27 在舌鳞癌中可被miR-299-3p 靶向负调控而参与癌细胞的增殖、迁移和侵袭[11]。但TRIM27 与miR-455-3p 在鼻咽癌中的作用及机制尚未有研究。本研究自2020 年1—7 月探讨miR-455-3p对5-8F细胞增殖、凋亡的调控机制。
1 材料与方法
1.1 材料 人鼻咽癌细胞5-8F、CNE-1 和鼻咽上皮细胞NP69 均购自中国科学研究院细胞库;胎牛血清购自郑州九龙生物制品有限公司;四甲基偶氮唑盐比色法(MTT)购自上海威奥生物科技有限公司;LipofectamineTM2000 购自北京宜科思源科技有限公司;二辛可宁酸(BCA)蛋白定量试剂盒购自北京艾然生物科技有限公司;逆转录试剂盒购自Roche 公司;PVDF 膜购自日本中兴化成;ECL 发光液购自上海信帆生物科研所;双荧光素酶报告基因检测试剂盒购自北京百奥莱博公司。兔抗TRIM27 抗体(ab137638)和羊抗兔HRP 标记的IgG(ab205718)购于Abcam公司。
1.2 方法
1.2.1 细胞培养 5-8F、CNE-1 和NP69 的培养:使用DMEM 培养基(15%胎牛血清)进行常规培养、传代。
1.2.2 细胞转染与分组 正常培养的人鼻咽癌细胞5-8F、CNE-1、鼻咽上皮细胞NP69 分别标记为NP69 组、5-8F 组、CNE-1 组。将miR-NC、miR-455-3p mimics、pcDNA3.1、pcDNA3.1- TRIM27、si-NC、si-TRIM27、miR-455-3p mimics + pcDNA3.1、miR-455-3p mimics+pcDNA3.1-TRIM27用3倍量的脂质体来转染,将其转染至5-8F,转染6 h 后,弃去培养液,继续培养48 h,用实时荧光定量逆转录聚合酶链式反应(qRT-PCR)确认转染的效率如何。转染成功后分别标记为miR-NC 组、miR-455-3p 组、pcDNA3.1 组、pcDNA3.1-TRIM27组、si-NC 组、si-TRIM27组、miR-455-3p + pcDNA3.1 组、miR-455-3p + pcDNA3.1-TRIM27组,用于后续试验。
1.2.3 qRT-PCR 实验检测细胞中miR-455-3p、TRIM27 的mRNA 的表达 收集待检测的细胞,用RNA抽提试剂盒、反转录试剂盒提取总RNA并合成cDNA。最后用qRT-PCR 试剂盒检测其中miR-455-3p、TRIM27 的表达。以U6、甘油醛-3-磷酸脱氢酶(GAPDH)为内参,用2-ΔΔCt计算miR-455-3p、TRIM27的表达。引物信息(5'-3'):miR-455-3p 正向引物CTCAACTGGTGTCGTGGAGTCG, 反 向 引 物GCAATTCAGTTGAGCGATGTAG;TRIM27 正向引物AGCCCATGATGCTCGACTG,反向引物GGGCACGACACGTTAGTCA;GAPDH:正向引物TCC CTC AAG ATT GCT AGC AA,反向引物AGATCCACAACGGATACATT;U6 正向引物CTCGCTTCGGCAGCACA,反向引物AACGCTTCACGAATTTGCGT。
1.2.4 蛋白质印迹法(Western blotting)检测细胞中TRIM27 的蛋白表达 收集待检测的细胞,用蛋白裂解液在冰上充分裂解,提取总蛋白,用考马斯亮蓝对蛋白进行定量,然后在沸水中煮沸10 min,进行变性。取变性后的上清液进行蛋白的电泳上样。然后按照蛋白质印迹的常规操作流程进行电泳、转膜、一抗孵育、二抗孵育、显影曝光。我们在进行曝光时选用的是ECL 发光试剂盒。对图像的分析使用的是Quantity One 4.62 软件。结果以TRIM27 条带的灰度与GAPDH 条带的灰度之比表示TRIM27的蛋白表达。
1.2.5 四甲基偶氮唑盐比色法(MTT)检测细胞的增殖 收集待检测的细胞,取100 µL 的5×105浓度的细胞在96 空板上,再加入适量MTT 溶液(10∶1 的比例),培养4 h,再加入等量DMSO,使其充分溶解,调整酶标仪吸光值至490 nm 波长,在此波长下检测细胞的吸光度(A)。
1.2.6 Annexin V-FITC/PI 流式细胞术检测细胞的凋亡 收集待检测的细胞,用Annexin V-FITC/PI 凋亡检测试剂盒要求处理细胞,依次加入Annexin V-/FITC、PI,反应结束后立即上流式细胞仪检测分析凋亡情况。
1.2.7 生物信息学分析 采用在线靶基因预测库target scan(http://www.targetscan.org/)预测miR-455-3p的靶基因。
1.2.8 双荧光素酶报告基因检测实验检测miR-455-3p 与TRIM27 的结合力 将野生型序列(TRIM27-WT)和突变型序列(TRIM27-MUT)克隆至PUC-T载体,并纯化。同时将psiCHECK-2载体用同样的方法进行处理,再用点击法将TRIM27-WT、TRIM27-MUT 与psiCHECK-2 载体插入感受态细胞中,最后用LB培养基筛选优势菌株,并扩大,提取质粒DNA,待用。将psiCHECK2-TRIM27-WT、psi-CHECK2-TRIM27-MUT 分别与miR-NC、miR-455-3p共同转染到5-8F。按双荧光素酶报告基因检测试剂盒说明要求操作,将psiCHECK2-TRIM27-3'UTR WT 和psiCHECK2-TRIM27-3'UTR MUT 的表达作为对照,海肾荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值表示miR-455-3p 与TRIM27 在细胞中的结合能力。
1.3 统计学方法 实验中所有数据均采用Graph-Pad Prism 7.0 分析处理。计量资料用±s 表示,多时间点观测资料比较采用重复测量方差法分析,多组间比较采用单因素方差分析和SNK-q 检验,两组比较用独立样本t 检验,P<0.05 代表差异有统计学意义。
2 结果
2.1 miR-455-3p 在NP69、5-8F、CNE-1 中的表达结果显示,NP69 组、5-8F 组、CNE-1 组细胞中miR-455-3p mRNA 的表达分别为(1.37±0.06)、(0.42±0.02)、(0.96±0.05),F =314.35,P =0.001。与NP69组相比,5-8F组、CNE-1组细胞中miR-455-3p的表达均显著降低(P<0.05)。
2.2 miR-455-3p 过表达对5-8F、CNE-1 增殖和凋亡的影响 结果显示,与miR-NC 组相比,miR-455-3p 组5-8F、CNE-1 中miR-455-3p 的表达均显著升高[(1.58±0.11)和(0.53±0.04),(1.53±0.11)和(1.07±0.06)],24、48、72 h时,5-8F、CNE-1细胞的活性均显著降低[(0.41±0.02)和(0.76±0.03),(0.63±0.03)和(1.16±0.05),(1.25±0.05)和(1.86±0.11);(0.51±0.02)和(0.74±0.03),(0.73±0.03)和(1.08±0.05),(1.25±0.05)和(1.53±0.11)],细胞凋亡率均显著升高[(19.06±1.26)和(7.33±0.51),(12.06±1.03)和(7.91±0.66),P<0.05]。
2.3 miR-455-3p 靶向TRIM27 通过生物信息学分析预测显示,miR-455-3p 与TRIM27 的3’UTR 端含7 个互补的核苷酸序列GUCAGGU(图1)。与miR-NC 组相比,miR-455-3p 组WT-TRIM27 细胞荧光活性显著降低(表1);miR-NC、miR-455-3p、antimiR-NC、anti-miR-455-3p 组TRIM27 的蛋白表达量分别为(0.66±0.04)、(0.31±0.01)、(0.70±0.05)、(1.18±0.06),miR-455-3p 在细胞中的表达量与TRIM27 的表达量之间呈明显的负调控关系(F=196.65,P=0.001)。见图2。
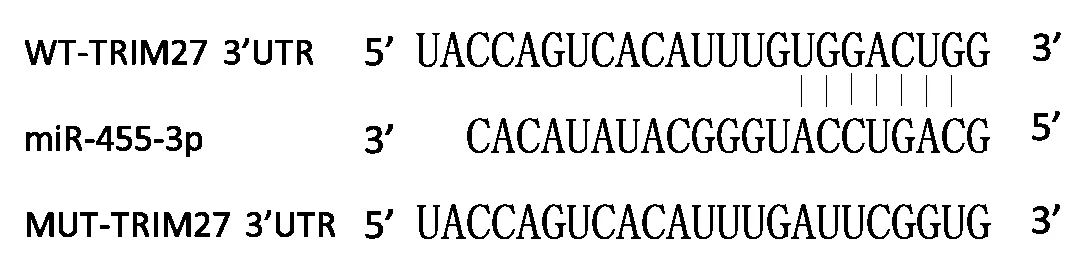
图1 TRIM27的3’UTR中含有miR-455-3p的互补核苷酸序列
表1 双荧光素酶报告实验/±s

表1 双荧光素酶报告实验/±s
组别miR-NC miR-455-3p t值P值重复次数33 WT-TRIM27 1.06±0.06 0.34±0.01 20.50 0.000 MUT-TRIM27 1.03±0.04 0.96±0.03 2.43 0.072

图2 蛋白质印迹法检测miR-455-3p对TRIM27表达的影响
2.4 抑制TRIM27 表达对鼻咽癌细胞系5-8F 增殖凋亡的影响 结果如图3;表2,3 所示,与pcDNA3.1组相比,pcDNA3.1-TRIM27 组5-8F 细胞中TRIM27的mRNA 和蛋白表达均显著升高,与si-NC 组相比,si-TRIM27 组5-8F 细胞中TRIM27 的mRNA 和蛋白表达明显下调,在24、48、72 h 时,细胞的活性明显下调,凋亡率明显上调[(20.88±1.32)%比(8.03±0.41)%,t=16.10,P=0.001];不同组间、不同时间点间、组间×时间交互作用下的细胞活力(OD490 nm)均差异有统计学意义(P<0.05)。

图3 蛋白质印迹法检测TRIM27蛋白的表达
表2 TRIM27 mRNA和蛋白的表达比较/±s
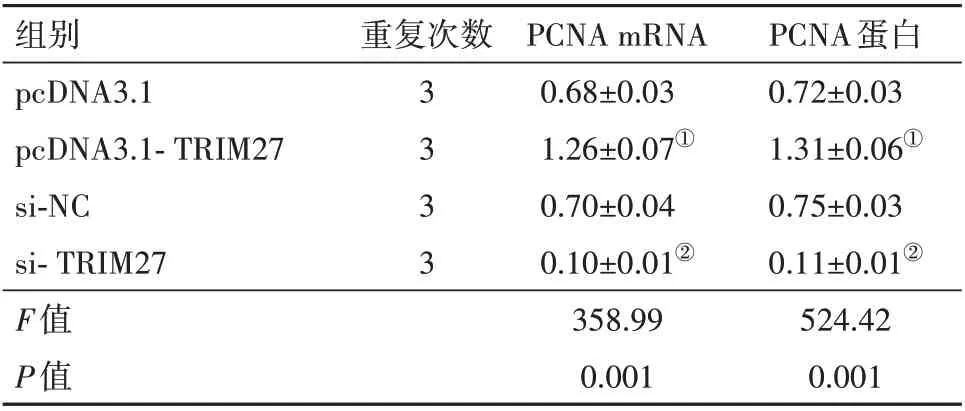
表2 TRIM27 mRNA和蛋白的表达比较/±s
注:①与pcDNA3.1组比较,P<0.05。②与si-NC组比较,P<0.05。
组别pcDNA3.1 pcDNA3.1-TRIM27 si-NC si-TRIM27 F值P值PCNA蛋白0.72±0.03 1.31±0.06①0.75±0.03 0.11±0.01②524.42 0.001重复次数3333 PCNA mRNA 0.68±0.03 1.26±0.07①0.70±0.04 0.10±0.01②358.99 0.001
表3 抑制TRIM27对细胞5-8F增殖、凋亡的影响/±s
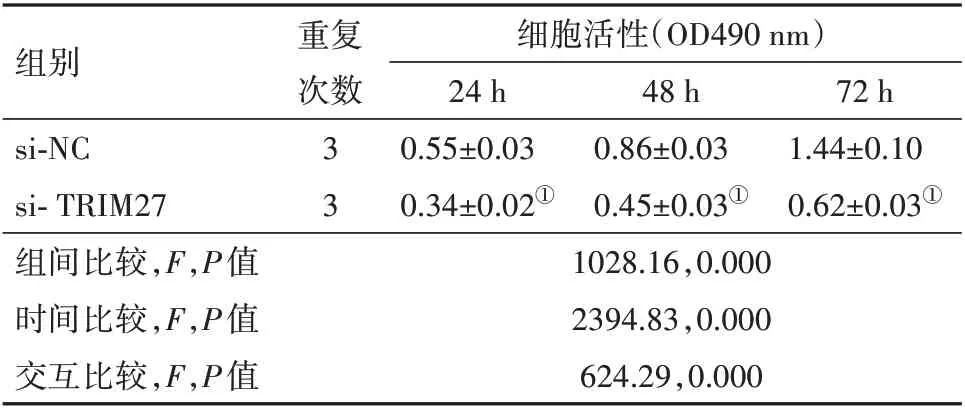
表3 抑制TRIM27对细胞5-8F增殖、凋亡的影响/±s
注:①与si-NC组比较,P<0.05。
组别si-NC si-TRIM27组间比较,F,P值时间比较,F,P值交互比较,F,P值重复次数细胞活性(OD490 nm)24 h 0.55±0.03 0.34±0.02①1028.16,0.000 2394.83,0.000 624.29,0.000 33 48 h 0.86±0.03 0.45±0.03①72 h 1.44±0.10 0.62±0.03①
2.5 过表达TRIM27 部分逆转了miR-455-3p 对5-8F 增殖和凋亡的影响 结果如表4 所示,不同组间、不同时间点间、组间×时间交互作用下的细胞活力(OD490 nm)均差异有统计学意义(P<0.05);与miR-NC 组相比,miR-455-3p 组5-8F 细胞在24、48、72 h 的细胞活性明显降低,细胞凋亡率明显升高[(19.06±1.26)%比(7.33±0.51)%];与miR-455-3p +pcDNA3.1 组相比,miR-455-3p + pcDNA3.1-TRIM27组5-8F 细胞24、48、72 h 的活性显著上调,凋亡率明显降低[(11.13±1.01)%比(19.51±1.18)%,P<0.05]。
表4 过表达TRIM27能够逆转miR-455-3p对细胞5-8F增殖的作用/±s

表4 过表达TRIM27能够逆转miR-455-3p对细胞5-8F增殖的作用/±s
注:①与miR-NC 组比较,P<0.05。②与miR-455-3p+pcDNA3.1组比较,P<0.05。
组别miR-NC miR-455-3p miR-455-3p+pcDNA3.1 miR-455-3p+pcDNA3.1-TRIM27组间比较,F,P值时间比较,F,P值交互比较,F,P值重复次数3333细胞活性(OD490 nm)24 h 0.76±0.03 0.41±0.02①48 h 1.16±0.05 0.63±0.03①72 h 1.86±0.11 1.25±0.05①0.43±0.02 0.66±0.04 1.28±0.06 0.62±0.03②0.91±0.06②1.55±0.12②2502.82,0.000 3437.33,0.000 15.84,0.000
3 讨论
miRNA 在癌症中的研究已成为研究的热点,其通过对靶基因转录和翻译的阻遏而发挥癌基因或抑癌基因的作用[12-14]。miRNA 对肿瘤的调控网络十分复杂,其除了调控靶基因外,还可通过各种信号通路调控肿瘤的进展[15-16]。miR-455-3p 可通过靶向HOXB5 抑制非小细胞肺癌细胞的增殖、迁移和侵袭[17],还可通过Wnt/β-连环蛋白和TGF-β 信号通路减弱食管鳞癌的化疗敏感性[18],又可抑制胰腺癌细胞的增殖和耐药能力[19]。花永虹等[20]在鼻咽癌的研究中通过miRNA 基因芯片技术检测发现,miR-455-3p 的表达水平显著降低,令人遗憾的是,并未进行深入的对鼻咽癌细胞表型变化的研究。本研究通过qRT-PCR法检测了人鼻咽癌细胞5-8F、CNE-1和鼻咽上皮细胞NP69中miR-455-3p的表达发现,miR-455-3p 在鼻咽癌细胞中的表达水平明显降低,这是首次在鼻咽癌细胞中确定miR-455-3p 的低表达,与其在鼻咽癌组织中的低表达相呼应;进一步研究,发现过表达miR-455-3p 可抑制鼻咽癌细胞的增殖、促进凋亡,这是国内外首次发现miR-455-3p对鼻咽癌体外研究的细胞表型变化结果,为miR-455-3p 在鼻咽癌中的进一步研究提供依据,也为miR-455-3p 在鼻咽癌中的体外研究奠定理论基础;深入研究,证实了miR-455-3p 可靶向负调控TRIM27 的表达,我们推测miR-455-3p 对鼻咽癌细胞的功能可能与TRIM27具有一定的相关性。
TRIM27 在各种肿瘤细胞中高表达,TRIM27 的过表达有助于各种肿瘤的发展进展及耐药性[21-22]。Ma的研究报道TRIM27在卵巢浆液性癌细胞中高表达,并且TRIM27 表达的下调在体外和体内均抑制卵巢癌细胞的增殖[23]。最近,Jiang 等[24]在卵巢癌的研究中发现,TRIM27 在卵巢癌细胞和异种移植卵巢癌裸鼠中高表达,抑制TRIM27 可抑制癌细胞和裸鼠成瘤的进一步恶化,产生这种作用与TRIM27正向的miR-383-5p 的靶向调控相关。孟易禹等[25]在鼻咽癌的研究中报道,TRIM27 的表达水平明显的升高,下调TRIM27 可抑制鼻咽癌细胞的增殖、迁移和侵袭,提示TRIM27 在鼻咽癌中具有潜在的应用价值。本研究检测了人鼻咽癌细胞5-8F、CNE-1和鼻咽上皮细胞NP69 中TRIM27 的表达发现,TRIM27 在鼻咽癌中的表达明显升高,且敲减TRIM27 可抑制鼻咽癌细胞的增殖,这均与孟易禹的研究结果相一致,也再次验证了TRIM27 在鼻咽癌中的体外调控功能;除此之外,还发现敲减TRIM27 可促进鼻咽癌细胞的凋亡,这是首次发现TRIM27 对鼻咽癌细胞的凋亡调控作用,为探索TRIM27 在鼻咽癌细胞中的功能提供充分的理论依据;深入研究发现,过表达TRIM27 可逆转miR-455-3p对鼻咽癌细胞增殖和凋亡的调控,说明不仅miR-455-3p可靶向调控TRIM27,相反,TRIM27也可逆向调控miR-455-3p 的表达和功能。这些结果为鼻咽癌的基因治疗和靶向治疗提供了更充分的实验理论依据。
总之,miR-455-3p 抑制鼻咽癌细胞增殖并促进凋亡,其机制与靶向TRIM27 有关,为鼻咽癌的治疗提供新靶点。

