激活素A、转化生长因子β1表达与急性呼吸窘迫综合征短期预后的相关性
缑剑,闫海燕,嘉婷
作者单位:咸阳市第一人民医院,a呼吸与危重症医学科,b呼吸内科,陝西 咸阳 712000
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是重症病人临床常见呼吸系统危重疾病,主要临床表现为急性呼吸衰竭、常规氧疗难以纠正的低氧血症、口唇及指端紫绀,发生率约占ICU 病人的10%,死亡率高,发病机制尚不明确[1-2],改善ARDS 病人预后状况一直是重症医学领域研究热点。急性生理学及慢性健康状况评分Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)对临床危重症严重程度有良好评估价值,同时也是预后预测的重要依据。激活素A(activin-A,ACTA)、转化生长因子β1(transforming growth factor β1,TGF-β1)均是TGF-β 超家族的成员,ACTA 是一种多效应生长因子,在机体生理、病理中发挥重要调控作用,与发育、炎症反应、组织重构等密切相关[3];TGF-β1 在肺纤维化病理改变过程中发挥关键作用,ARDS 病情早期即有胶原纤维组织增生变化,TGF-β1 持续上调加速纤维化进程[4-5]。ACTA 在ARDS 病人中的表达水平及与预后关系的报道较少,本研究就此展开。
1 资料与方法
1.1 一般资料 选取咸阳市第一人民医院2018 年1 月至2019 年12 月收治的169 例ARDS 病人为研究对象,年龄范围为24~73 岁。纳入标准:(1)符合2012 年公布的柏林ARDS 诊断标准[6];(2)发病时间≤24 h;(3)年龄范围为18~80 岁;(4)病因明确;(5)血流动力学稳定;(6)临床资料完整。排除标准:(1)急性肺栓塞者;(2)既往有慢性阻塞性肺疾病者;(3)合并自身免疫性疾病者;(4)恶性肿瘤病人;(5)诊断后48 h 内死亡者;(6)合并肝、肾严重功能不全者;(7)合并急性心肌缺血、严重心律失常者;(8)妊娠、哺乳期女性;(9)随访失访者。根据28 d生存状况将ARDS病人分为两组:存活组(98例)、死亡组(71 例)。本研究符合《世界医学协会赫尔辛基宣言》相关要求,所有研究对象均知情同意。
1.2 方法 研究对象均于入住ICU 24 h 内采集5 mL 空腹静脉血,3 000 r/min 离心15 min 分离血清,将血清保存于-70 ℃冰箱中。
采用酶联免疫吸附法(enzyme linked immunaosorbont assay,ELISA)检测血清ACTA、TGF-β1 表达水平,试剂盒均购于武汉博士德生物工程公司,试验操作严格遵循试剂盒说明书进行,分别以血清ACTA、TGF-β1 表达水平平均数838.78 ng/L、18.49µg/L 分为高低水平,ACTA 低水平病人85 例,ACTA高水平病人84例,TGF-β1低水平病人98例,TGF-β1高水平病人71例。
采用普朗PL2100 血气电解质分析仪进行血气分析,计算氧合指数(oxygenation index,PaO2/FiO2),PaO2/FiO2>200~300 mmHg 为轻度,>100~200 mmHg为中度,≤100 mmHg为重度[6]。
研究对象均行APACHE Ⅱ评分,APACHE Ⅱ评分系统最高分为71分,由年龄、急性生理参数、慢性健康状况三部分构成,分值越高,提示病情越严重,依据APACHE Ⅱ评分平均数(19分)区分高、低。
1.3 统计学方法 采用SPSS 17.0 统计学软件处理数据。计量资料以±s 表示,组间比较采用t检验;计数资料以例(%)表示,采用χ2检验;采用Spearman分析血清ACTA、TGF-β1表达水平与PaO2/FiO2、APACHE Ⅱ评分相关性;采用乘积极限法(Kaplan-Meier,K-M)进行生存分析,Log-rank 检验比较显著性;采用COX 回归模型分析影响ARDS 病人预后生存状况的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 存活组、死亡组基线资料比较 存活组、死亡组性别、年龄、BMI、吸烟史相比,均差异无统计学意义(P>0.05)。与存活组相比,死亡组PaO2/FiO2较低(P<0.05),APACHE Ⅱ评分较高(P<0.05),见表1。

表1 急性呼吸窘迫综合征169例存活组、死亡组基线资料比较
2.2 存活组、死亡组血清ACTA、TGF-β1 表达水平比较 与存活组相比,死亡组血清ACTA、TGF-β1表达水平均较高(P<0.05),见表2。
表2 急性呼吸窘迫综合征169例存活组、死亡组血清激活素A(ACTA)、转化生长因子β1(TGF-β1)表达水平比较/±s

表2 急性呼吸窘迫综合征169例存活组、死亡组血清激活素A(ACTA)、转化生长因子β1(TGF-β1)表达水平比较/±s
组别存活组死亡组t值P值例数98 71 ACTA/(pg/mL)745.12±123.28 968.05±143.10 10.84<0.001 TGF-β1/(µg/L)16.30±2.28 21.51±3.84 11.02<0.001
2.3 血清ACTA、TGF-β1 表达水平与PaO2/FiO2、APACHE Ⅱ评分相关性分析 Spearman 分析结果显示,ACTA、TGF-β1 表达水平与PaO2/FiO2均呈负相关(P<0.05),与APACHE Ⅱ评分均呈正相关(P<0.05),见表3。

表3 血清ACTA、TGF-β1表达水平与PaO2/FiO2、APACHE Ⅱ评分相关性分析
2.4 血清ACTA、TGF-β1 表达水平与ARDS 病人预后生存状况关系分析 169 例ARDS 病人在28 d随访期中71 例发生死亡,98 例存活,死亡率为42.01%。ACTA 低水平病人死亡率为28.24%,总生存期平均值为26.140 d[95%CI(25.94,26.34)],ACTA 高水平病人死亡率为55.95%,总生存期平均值为24.204 d[95CI(23.94,24.47)]。与ACTA 低水平病人相比,ACTA 高水平病人死亡率较高(χ2=13.32,P<0.001),总生存期较短(Log-rank 值为278.56,P<0.001),见图1。TGF-β1 低水平病人死亡率为31.63%,总生存期平均值为26.043 d[95%CI(25.85,26.23)],TGF-β1高水平病人死亡率为56.34%,总生存期平均值为23.993 d[95CI(23.70,24.28)]。与TGF-β1 低水平病人相比,TGF-β1 高水平病人死亡率较高(χ2=10.32,P=0.001),总生存期较短(Logrank值为236.096,P<0.001),见图2。

图1 ARDS病人血清ACTA水平与生存率的关系

图2 ARDS病人血清TGF-β1水平与生存率的关系
2.5 影响ARDS 病人预后生存状况的危险因素分析 以ARDS 病人预后生存状况作为因变量,以PaO2/FiO2、APACHE Ⅱ评分、ACTA、TGF-β1 作为自变量进行COX 回归分析。将PaO2/FiO2>100 mmHg、低APACHE Ⅱ评分、ACTA 低水平、TGF-β1 低水平均赋值为0,相应地将PaO2/FiO2≤100 mmHg、高APACHE Ⅱ评分、ACTA 高水平、TGF-β1 高水平均赋值为1。COX 单因素分析结果显示,PaO2/FiO2、APACHE Ⅱ评分、ACTA、TGF-β1 均是影响ARDS 病人预后生存状况的危险因素(P<0.05);COX 多因素分析结果显示,PaO2/FiO2≤100 mmHg、高APACHEⅡ评分、ACTA 高水平、TGF-β1高水平均是影响ARDS 病人预后生存状况的独立危险因素(P<0.05),见表4,表5。
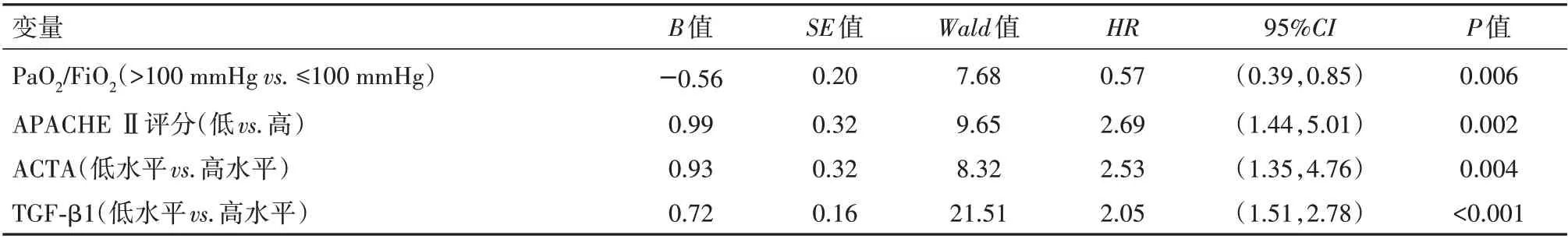
表4 影响ARDS病人预后生存状况的单因素COX分析结果

表5 影响ARDS病人预后生存状况的多因素COX分析结果
3 讨论
ARDS 是一种炎症性急性肺损伤,主要病理改变是肺血管通透性增加,同时肺组织通气减少,ARDS 病情危急,严重威胁病人生命安全,给病人及家庭造成沉重精神及经济负担[7]。近年来随着医疗技术的不断发展,ARDS 病人预后状况得到一定程度改善,但死亡率仍高达35%~46%,且大部分病人在发病2~3 周内即发生死亡[8-9],寻找可用于评估AR-DS 病情及预后状况的生物标志物具有重要临床意义。本研究发现,169例ARDS病人在28 d随访期中71 例发生死亡,98 例存活,死亡率为42.01%,与既往研究结果相近[10]。与存活组相比,死亡组PaO2/FiO2较低,APACHE Ⅱ评分较高,提示病情严重病人预后较差,及早发现及进行有效干预或可改善ARDS病人预后结局。
ACTA 是一种同型二聚体糖蛋白,在种属间具高度保守性,由性腺分泌产生,在几乎所有正常组织中均有分布,可诱导肿瘤坏死因子、一氧化氮、白细胞介素家族等炎症介质生成,在炎症反应、组织修复及免疫调节等生物学过程中发挥重要作用,可加重气道重塑及炎症反应[11-12]。研究发现,急性哮喘模型大鼠肺组织中ACTA 为高表达,参与哮喘的发生及演变[13]。抑制ACTA 可延缓辅助性T 细胞9分化进程,进而降低气道炎症反应及胶原蛋白沉积,可能具潜在治疗作用[3]。TGF-β1 主要由气道上皮细胞分泌产生,由112个氨基酸构成,基因定位于19q13 染色体上,含7 个外显子及6 个内含子[14]。研究发现,伴肺纤维化较未伴肺纤维化ARDS 病人血清TGF-β1 水平高,TGF-β1 对肺纤维化有一定诊断价值[8,15]。本研究发现,ACTA、TGF-β1 表达水平与PaO2/FiO2均呈负相关,与APACHE Ⅱ评分均呈正相关,提示ACTA、TGF-β1 可能参与ARDS 的病情演变,或可用于评估ARDS 病情严重程度,可能原因是呼吸道上皮细胞受到过敏原诱导时ACTA 表达上调,通过激活素-Smad 信号通路促进TGF-β1、ACTA等目的基因向细胞内传递,TGF-β1 又促进ACTA 表达进一步上调,形成正反馈环,最终对气道平滑肌细胞及成纤维细胞的增殖产生促进作用,增强气道炎症及气道重塑[3,13,16]。与存活组相比,死亡组血清ACTA、TGF-β1 表达水平均较高,提示ACTA、TGF-β 1可能与ARDS病人预后有关。进一步研究显示,与ACTA 低水平病人相比,ACTA 高水平病人死亡率较高,总生存期较短;与TGF-β1 低水平病人相比,TGF-β1 高水平病人死亡率较高,总生存期较短,提示高水平的ACTA、TGF-β1 对预后结局具预警作用,死亡风险较大。COX 多因素分析结果显示,PaO2/FiO2≤100 mmHg、高APACHE Ⅱ评分、ACTA 高水平、TGF-β1 高水平均是影响ARDS 病人预后生存状况的独立危险因素,可据此对ARDS 病人进行危险分层,高危病人应重点监护,以期降低死亡率。
综上,ARDS 病人血清ACTA、TGF-β1 表达水平与病情严重程度相关,是影响病人预后的独立危险因素,可能用于病情及短期预后评估。本研究也存在一定局限性,未进行ACTA、TGF-β1 表达水平动态监测,另外样本量较小,尚需后续进一步探究。

