姜黄素通过上调miR-124减轻脂多糖诱导的大鼠急性肺损伤
简宇,范婷,代凌云,赵春虎
作者单位:长江大学附属荆州医院急诊科,湖北 荆州 434000
急性肺损伤(acute lung injury,ALI)是常见危重症呼吸系统疾病,主要以低氧血症和进行性呼吸窘迫为临床特征,病死率高达30%~45%[1-2]。其病因多样、发病机制复杂,目前尚未完全阐明,但研究表明,炎症反应在ALI 发生发展中发挥重要作用[3]。姜黄素(curcumin,Cur)是广泛存在于姜黄、莪术、郁金等中药根茎中的一种酚性色素,具有抗炎、抗氧化、抗肿瘤等多种药理活性,已有研究证实,Cur 可有效减轻脂多糖(lipopolysaccharide,LPS)诱导及脓毒症相关ALI,在肺部疾病中具有良好的应用前景,但其具体作用机制尚不清楚[4-5]。微小RNA(microRNA,miRNA)是一类内源性非编码小RNA,可通过对其靶基因转录后调控发挥生物学功能,其中miR-124 是一个重要炎症相关miRNA[6],有研究报道,miR-124 可靶向抑制肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6,TRAF6)抑制下游核因子-κB(nuclear factor-κB,NFκB)发挥抗炎作用[7-8],但Cur 是否也通过该通路对ALI 大鼠发挥保护作用,尚未可知。因此本研究自2019 年9 月至2020 年5 月探究Cur 对LPS 诱导ALI大鼠的保护作用及对miR-124及其下游靶基因的表达影响,以期揭示其作用机制,为优化Cur临床应用提供进一步参考。
1 材料与方法
1.1 实验动物及细胞 8 周龄健康雄性清洁级SD大鼠,体质量范围为290~310 g,购自上海斯莱克实验动物有限责任公司,动物生产许可证号SCXK(沪)2017-0005,使用许可证号SYXK(沪)2017-0008。本研究符合动物伦理学标准。大鼠肺泡巨噬细胞NR8383来自ATCC细胞库。
1.2 主要试剂及仪器 Cur(货号HY-N0005,纯度96.31%)购自MCE 公司;LPS(货号L2630)购自Sigma-Aldrich 公司;胎牛血清(fetal bovine serum,FBS,货号10099141)购自美国Gibco公司;RNA 提取试剂盒(货号R0011)购自上海碧云天有限公司;Prime-Script ™RT reagent Kit(Perfect Real Time)(货号RR037A)、microRNA 定量试剂盒(货号638315)、TB Green®Premix Ex Taq™Ⅱ(Tli RNaseH Plus)(货号RR820A)购自TaKaRa 生物公司;脂质体转染试剂盒Lipofectamine2000Reagent(货号11668)购自美国Invitrogen 公司;miR-124 模拟物及其阴性对照(miR-124 mimic/NC)、miR-124抑制剂及其阴性对照(miR-124 inhibitor/inhibitor-NC)及miR-124、U6、TRAF6、GAPDH引物均由广州锐博生物科技有限公司提供;大鼠TNF-α ELISA 试剂盒(货号ab236712)、IL-6 ELISA 试剂盒(货号ab234570)、兔源一抗anti-TRAF6(货号ab40675)、anti-β-actin(ab8227)、二抗羊抗兔IgG(货号ab6721)均购自英国Abcam 公司;MODEL550 型酶标仪购自美国Bio-Rad 公司;Forma Steri-Cycle i160 二氧化碳培养箱购自美国Thermo Fisher 公司;ix75 荧光显微镜购自日本Olympus 公司等。
1.3 方法
1.3.1 细胞培养 NR8383 细胞常规复苏后采用含20%FBS、1%P/S Ham's F-12K 培养基置于37 ℃、5%二氧化碳培养箱中培养,待细胞汇合至80%~90%时,用0.05%胰蛋白酶消化处理以1∶3 比例进行传代。
1.3.2 双荧光素酶报告基因实验 构建与miR-124种子区结合的TRAF6 基因3’UTR 野生型(Pmir-GLO-TRAF6-Wt)和突变型(Pmir-GLO-TRAF6-Mut)双荧光报告载体。构建PmiR-GLO-TRAF6 野生型和突变型重组载体后,采用脂质体转染法将miRNA(miR-124 mimic 或NC)和重组载体(野生型或突变型)共转染入NR8383 细胞中,于二氧化碳培养箱继续培养。每组设立5 个复孔,48 h 后用PLB 裂解细胞,收集细胞裂解液,离心后取上清检测萤火虫荧光素信号和海肾荧光素信号,以海肾荧光素酶活性为对照,计算其相对活性。
1.3.3 ALI 大鼠模型建立及分组 SD 大鼠采用随机数字表法分为对照组(NC 组)、LPS 组、LPS+Cur组、LPS+Cur+inhibitor-NC 组、LPS+Cur+inhibitor 组,每组10 只。LPS 组腹腔注射LPS 10 mg/kg 制备ALI大鼠模型[9],LPS+Cur组在ALI模型制备30 min后尾静脉注射Cur 200 mg/kg,LPS+Cur+inhibitor-NC 组、LPS+Cur+inhibitor 组大鼠尾静脉分别注射miR-124 inhibitor-NC、miR-124 inhibitor 50 mg/kg 1 周后腹腔注射LPS 10 mg/kg,30 min 后尾静脉注射Cur 200 mg/kg,NC 组注射等量生理盐水30 min 后尾静脉注射等量生理盐水。24 h 后腹腔麻醉处死大鼠,分别采集心脏血及肺组织标本待检。
1.3.4 HE 染色观察肺组织病理学变化 取部分肺组织于4%多聚甲醛中固定,进行石蜡包埋,切片(4µm),苏木精-伊红(HE)染色,于光镜下观察肺组织病理学变化。
1.3.5 ELISA 检测血清TNF-α、IL-6 水平 常规分离血清,采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测各组大鼠血清TNF-α、IL-6水平,具体步骤严格按照试剂盒说明书进行。
1.3.6 RT-qPCR 检测肺组织miR-124、TRAF6 mRNA 表达水平 采用RNA 提取试剂盒提取肺组织总RNA,浓度及纯度检测合格后,反转录得到cDNA,置于-20 ℃保存备用。采用实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)扩增miR-124、TRAF6 mRNA 目的片段。RT-qPCR 采用20µL反应体系:TB Green Premix Ex Taq Ⅱ(2×)10 µL,ROX Reference Dye Ⅱ(50×)0.4µL,cDNA(50µg/L)2 µL,上下游引物(10 µmol/L)各0.8 µL,ddH2O 6.0µL。反应条件为:95 ℃30 s;95 ℃5 s,60 ℃34 s,40个循环。采用2-ΔΔCt法对肺组织miR-124、TRAF6 mRNA相对表达水平进行定量分析。
1.3.7 蛋白质印迹(Western blotting)检测肺组织TRAF6 蛋白表达 采用蛋白抽提试剂盒提取肺组织总蛋白,BCA 试剂盒检测蛋白浓度,置于-80 ℃保存备用。取40 µg 蛋白样品,进行6%SDS-PAGE 电泳后PVDF 膜转膜,室温封闭,添加一抗(anti-TRAF6,稀释比1∶5 000;anti-β-actin,稀释比1∶1 000)4℃孵育过夜,洗膜后,添加二抗IgG(稀释比1∶5 000)室温孵育1.5 h,洗膜,显色,曝片,拍照,观察并分析蛋白条带灰度值。
1.4 统计学方法 采用SPSS 25.0 软件进行统计学分析。计量资料以±s 表示,两组比较采用t检验,多组数据比较采用单因素方差分析,进一步任意两两比较采用SNK-q 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 miR-124 可靶向TRAF6 基因表达 通过TargetScan、miRanda、miRTarBase 在线生物信息学软件预测TRAF6 基因3 'UTR 区可能包含miR-124 的互补序列(图1),提示TRAF6 可能是miR-124 的作用靶点。双荧光素酶报告实验结果显示,共转染miR-124 mimic 和Pmir-GLO-TRAF6 野生型重组质粒NR8383细胞的荧光素酶活性显著降低(P<0.05),而共转染miR-124 mimic 和Pmir-GLO-TRAF6 突变型重组质粒、转染miR-124 NC 和Pmir-GLO-TRAF6 野生及突变型重组质粒的NR8383 细胞的荧光素酶活性差异无统计学意义(P>0.05)(图2),提示miR-124可通过靶向TRAF6 3 ' UTR 区负调控其表达,二者存在直接靶向关系。

图1 TargetScan预测TRAF6 3'UTR中与miR-124结合序列
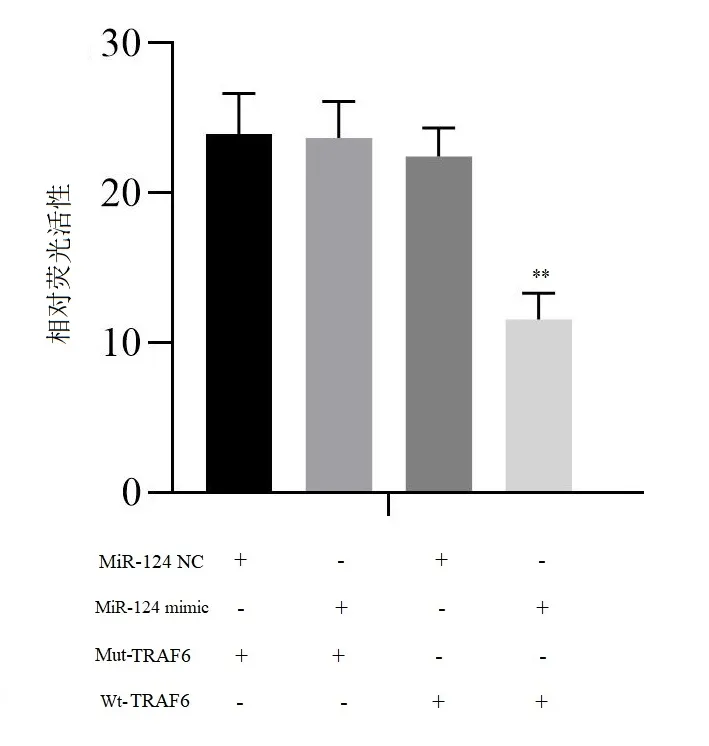
图2 NR8383细胞的相对荧光素酶活性
2.2 各组大鼠肺组织病理学变化 NC 组大鼠肺组织结构清晰,肺泡结构完整,无明显异常改变;LPS组、LPS+Cur+inhibitor 组大鼠肺组织结构破坏严重,肺间质增厚,大量炎性细胞浸润,弥漫性充血、渗出,肺泡萎缩;LPS+Cur 组、LPS+Cur+inhibitor-NC 组大鼠肺组织损伤减轻,见图3。
2.3 各组大鼠血清TNF-α、IL-6表达水平变化 与NC组比较,LPS组大鼠血清TNF-α、IL-6表达水平显著增加(P<0.05);与LPS 组比较,LPS+Cur 组大鼠血清TNF-α、IL-6 表达水平显著降低(P<0.05);与LPS+Cur+inhibitor-NC组比较,LPS+Cur+inhibitor组大鼠血清TNF-α、IL-6 表达水平显著增加(P<0.05),见表1。
表1 各组大鼠血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)表达水平变化/(ng/L,±s)

表1 各组大鼠血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)表达水平变化/(ng/L,±s)
注:①与NC 组比较,P<0.05。②与LPS 组比较,P<0.05。③与LPS+Cur+inhibitor-NC组比较,P<0.05。
IL-6 5.49±1.06 32.74±2.27①21.44±2.12①②21.65±2.18①②28.97±2.29①②③262.99<0.001组别NC组LPS组LPS+Cur组LPS+Cur+inhibitor-NC组LPS+Cur+inhibitor组F值P值鼠数10 10 10 10 10 TNF-α 6.14±1.21 45.28±4.85①29.26±2.72①②29.87±2.59①②34.59±3.02①②③212.52<0.001
2.4 各组大鼠肺组织miR-124、TRAF6 mRNA 相对表达水平比较 与NC 组比较,LPS组大鼠肺组织miR-124 表达水平显著降低、TRAF6 mRNA 表达水平显著增加(P<0.05);与LPS 组比较,LPS+Cur 组大鼠肺组织miR-124 表达水平显著增加、TRAF6 mRNA表达水平显著降低(P<0.05);与LPS+Cur+inhibitor-NC 组比较,LPS+Cur+inhibitor 组大鼠肺组织miR-124 表达水平显著降低、TRAF6 mRNA 表达水平显著增加(P<0.05),见表2。
2.5 各组大鼠肺组织TRAF6 蛋白表达量比较 与NC组比较,LPS组大鼠肺组织TRAF6蛋白表达量显著增加(P<0.05);与LPS 组比较,LPS+Cur 组大鼠肺组织TRAF6蛋白表达量显著降低(P<0.05);与LPS+Cur+inhibitor-NC 组比较,LPS Cur+inhibitor 组大鼠肺组织TRAF6 蛋白表达量显著增加(P<0.05),见图4,表2。

图4 蛋白质印迹法检测各组大鼠肺组织TRAF6蛋白表达
表2 各组大鼠肺组织微小RNA-124(miR-124)与肿瘤坏死因子受体相关因子6(TRAF6)相对表达水平比较/±s
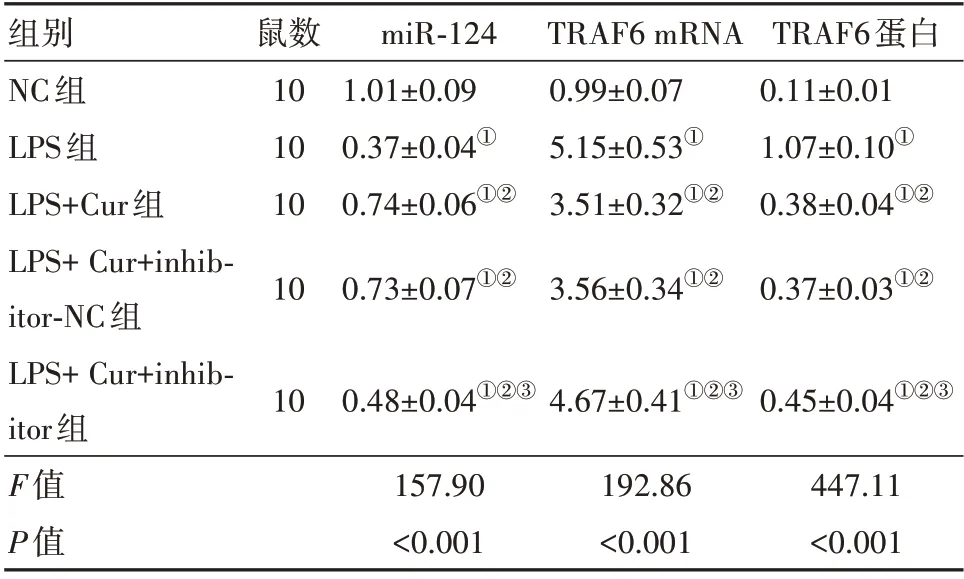
表2 各组大鼠肺组织微小RNA-124(miR-124)与肿瘤坏死因子受体相关因子6(TRAF6)相对表达水平比较/±s
注:①与NC 组比较,P<0.05。②与LPS 组比较,P<0.05。③与LPS+Cur+inhibitor-NC组比较,P<0.05。
组别NC组LPS组LPS+Cur组LPS+Cur+inhibitor-NC组LPS+Cur+inhibitor组F值P值鼠数10 10 10 10 miR-124 1.01±0.09 0.37±0.04①0.74±0.06①②0.73±0.07①②TRAF6 mRNA 0.99±0.07 5.15±0.53①3.51±0.32①②3.56±0.34①②TRAF6蛋白0.11±0.01 1.07±0.10①0.38±0.04①②0.37±0.03①②10 0.48±0.04①②③4.67±0.41①②③0.45±0.04①②③447.11<0.001 157.90<0.001 192.86<0.001
3 讨论
ALI 是外伤、感染、脓毒症等一系列刺激因素引起的复杂呼吸系统疾病,发病机制复杂,主要以肺内炎症反应失控导致的严重低氧血症、弥漫性肺损伤、肺水肿等为主要病理特征,伴随一系列基因表达失调等,但尚未完全明确[10]。目前临床尚缺乏ALI特效疗法,因此积极探究新型治疗方案,并深入研究其作用机制具有重要意义。肺泡巨噬细胞介导的固有免疫在ALI发生发展中发挥重要作用,LPS是革兰阴性菌细胞壁主要成分,是内毒素和重要群特异性抗原,LPS 感染机体刺激肺组织可活化肺泡巨噬细胞膜上Toll 样受体(TLRs),继而通过激活NF-κB诱导炎症级联反应,导致ALI发生[11-12]。本研究显示,LPS组大鼠肺组织出现严重损伤,肺间质增厚,大量炎性细胞浸润,弥漫性充血、渗出,肺泡萎缩,且血清促炎因子TNF-α、IL-6 表达水平显著增加,提示LPS 诱导ALI 模型成功。而Cur 可减轻ALI大鼠肺组织病理变化及TNF-α、IL-6 炎性因子分泌。Cur 是一种具有抗炎、抗氧化、抗血脂、抗肿瘤等多种功能的膳食多酚,研究表明,Cur 可通过上调线粒体融合蛋白2减轻脓毒症小鼠ALI[13],还可通过抑制NF-κB信号通路减轻流感病毒感染引起的巨噬细胞活化和肺部炎症[14],且对LPS 诱导的ALI 有显著治疗作用[15],提示Cur 可减轻LPS 诱导的大鼠ALI,减轻肺组织炎症反应。
MiRNAs 在进化过程中高度保守,主要通过识别靶基因3'UTR 区抑制蛋白翻译或促进靶基因降解,在炎症调控反应中发挥重要作用。研究显示,MiR-124 在多种细胞中特异表达,是一种影响炎症通路的重要miRNA,与多种炎症性疾病密切相关[16-17],miR-124 靶基因众多,本研究通过在线软件预测及文献检索发现,miR-124 可靶向抑制TRAF6表达发挥抗狼疮性肾炎[18]、ALI 肺泡巨噬细胞炎症[19]等作用,本研究经双荧光素酶报告基因实验结果显示,与其他对照组比较,共转染miR-124 mimic和Pmir-GLO-TRAF6 野生型重组质粒NR8383 细胞的荧光素酶活性显著降低,提示TRAF6 是miR-124的直接作用靶点。TRAF6 是TLR4 信号通路中关键蛋白,TRAF6 激活可进而引起TNF-α、IL-1β、IL-6 等促炎因子免疫应答,引发炎症级联反应,与肺损伤成正相关[20]。本研究结果显示,与NC 组比较,LPS组大鼠肺组织miR-124 表达水平显著降低,TRAF6 mRNA 及蛋白表达水平显著增加,而Cur 处理可显著增加miR-124 表达,抑制TRAF6 mRNA 及蛋白表达,提示Cur 可能通过促进miR-124 表达抑制TRAF6 表达,减轻LPS 诱导的ALI 大鼠肺组织炎症反应,发挥治疗作用。为进一步验证上述结果,本研究在LPS+Cur 基础上转染miR-124 inhibitor,结果显示,与转染miR-124 inhibitor-NC 对照比较,转染miR-124 inhibitor 可显著降低Cur 治疗效果,进一步验证Cur 可通过miR-124/TRAF6 轴发挥作用,但可能不是唯一途径,具体相关通路有待进一步深入研究。
综上所述,Cur 可通过上调miR-124 靶向抑制TRAF6 减轻LPS 诱导的大鼠ALI 及炎症反应,发挥治疗作用。但是否存在其他信号通路参与,及具体作用机制有待进一步深入探究。
(本文图3见插图8-2)

