益气化瘀解毒方拆方对急性呼吸窘迫综合征大鼠的预防作用研究*
褚 岩 骆长永 邹 乔 陈一凡 孔煜荣 陈 瑜 李 雁△
(1.北京市朝阳区双桥医院,北京 100121;2.北京中医药大学东直门医院,北京 100700;3.北京中医药大学东方医院,北京 100078)
急性呼吸窘迫综合征(ARDS)属于一种临床危重症,病死率极高,临床表现以呼吸窘迫、进行性的低氧血症为主。ARDS的病死率极高,重症患者的病死率为40%以上,幸存者仍存在认知功能下降、持续骨骼肌肉无力和抑郁的风险[1]。目前本病尚无特效药物,以支持肺保护性机械通气治疗为主。随着中医药研究的进展,中药单药、成药、自拟方等对ARDS体现出确切疗效[2]。益气化瘀解毒方是杜怀棠教授治疗ARDS的经验方,该方由黄芪、黄芩、金银花、三七、赤芍、炒枳实、葶苈子和桑白皮组成。前期我们通过多次动物实验研究对该方进行药效学评价,结果均证明益气化瘀解毒方能有效减轻ARDS大鼠模型的肺损伤,其机制可能与调节免疫、炎症等通路相关[3-6]。为进一步探索该方中不同治法对ARDS大鼠模型的炎症抑制作用,本研究对益气化瘀解毒方进行拆分,构建ARDS大鼠模型,探讨不同拆方组合对ARDS大鼠模型TLR4-NLRP3通路及炎性因子的影响,旨在探索益气化瘀解毒方中发挥主要炎症抑制作用的最佳药物组合,为科学简化处方、中药新药研发提供依据。
1 资料与方法
1.1 实验动物 大鼠购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2019-0008,雄性SD大鼠30只,SPF级,体质量(180±10)g。动物饲养于中医内科学教育部重点实验室中心屏障动物房,温度22~24℃,湿度50%~70%。本动物实验通过北京中医药大学东直门医院实验动物福利与伦理委员会审批通过(审批号:19-54)。
1.2 试药与仪器 益气化瘀解毒方拆方——益气解毒:黄芪30 g,黄芩10 g,金银花15 g。益气化瘀解毒方拆方——益气化瘀:黄芪30 g,三七10 g,赤芍15 g。益气化瘀解毒方拆方——益气逐饮组:黄芪30 g,葶苈子15 g,桑白皮15 g,炒枳实15 g。药材由中国中医科学院中药研究所提供,并制作成中药浓缩浸膏。大肠杆菌内毒素脂多糖(L6511,Sigma公司)、大鼠Toll样受体4(TLR4)、NLRP3、白细胞介素-1β(IL-1β)、白细胞介素-18(IL-18)ELISA试剂盒(MB-1762A/MB-6880A/MB-1588B/MB-1735B,江苏酶标生物科技有限公司)、药物天平(HCTP1110,上海精密仪器仪表有限公司)。
1.3 分组及给药 将30只SD大鼠随机分为5组,即空白对照组、模型组、益气解毒组、益气化瘀组、益气逐饮组,每组6只,分别称量并记录。空白对照组、模型组大鼠予1 mL/100(g·d)蒸馏水灌胃,益气解毒组、益气化瘀组、益气逐饮组分别予对应其治法的1 mL/(100 g·d)中药液灌胃,按12.2 g/(kg·d)(剂量换算方法:按照成人按体质量60 kg计算,以大鼠与成人6倍系数换算所得,给药剂量为生药剂量)予中药溶液灌胃给药。各组连续灌胃7 d。
1.4 模型制备 第7日灌胃后6 h造模,造模方法采用一次尾静脉注射脂多糖诱导全身炎症反应所致ARDS模型[4]。给予模型组、益气解毒组、益气化瘀组、益气逐饮组大鼠脂多糖溶液(2 mg/kg)一次性经尾静脉注射,对照组相应给予0.9%氯化钠注射液(2 mg/kg)尾静脉注射。
1.5 标本采集及检测 1)肺组织病理:造模16 h后,腹腔注射3%戊巴比妥钠(0.1 mL/100 g)进行麻醉,取大鼠右下肺,制成病理切片后进行HE染色,在光学显微镜下观察组织学形态,包括:肺泡间隔变化情况,局部炎症细胞浸润程度,肺毛细血管充血、水肿情况等。2)酶联免疫法(ELISA)检测TLR4-NLRP3通路及炎性因子相关蛋白:IL-1β、IL-18采取腹主动脉血,TLR4、NLRP3采取肺泡灌洗液及肺组织匀浆,采集的样本进行ELISA检测,操作步骤参考试剂盒说明完成。
1.6 统计学处理 数据统计分析应用Graphpad Prism7软件完成。本实验结果均为计量资料,采用()进行描述性展示,采用单因素方差分析整体进行差异性检验,两两组间比较时先进行方差齐性检验(Levene法),方差齐则釆用LSD-t检验,方差不齐则釆用Dunnetts-t检验。P<0.05被认为具有显著统计学差异。
2 结果
2.1 各组大鼠肺组织病理学观察 空白对照组大鼠的肺泡结构完整,肺泡腔内未见组织液,肺间质无水肿,肺组织中见少量炎性细胞浸润。模型组大鼠的肺泡及肺间质水肿,肺泡壁增厚,大多数肺泡腔缩小变形,部分肺泡塌陷,伴随有炎性细胞大量浸润,细支气管腔和肺泡腔内可见分泌物,偶见红细胞。各拆方组大鼠的肺泡及间质水肿较模型组有所改善,肺泡结构较为完整,肺泡腔塌陷较少,出血、渗出减少,见图1。
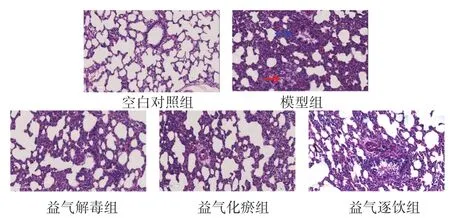
图1 各组大鼠肺组织病理情况(HE染色,200倍)
2.2 各组大鼠肺匀浆中TLR4、NLRP3表达水平比较 见表1。与空白对照组相比,模型组肺匀浆中TLR4表达水平显著升高(P<0.01);与模型组相比,益气解毒组、益气化瘀组、益气逐饮组肺匀浆中TLR4表达水平均显著降低(P<0.05或P<0.01)。与空白对照组相比,模型组肺匀浆中NLRP3表达水平显著升高(P<0.05);与模型组相比,益气化瘀组肺匀浆中NLRP3表达水平显著降低(P<0.05),益气解毒组、益气逐饮组肺匀浆中NLRP3表达平均水平有所降低,但差异无统计学意义(P>0.05)。
表1 各组大鼠肺匀浆中TLR4、NLRP3表达水平比较(ng/mL,±s)
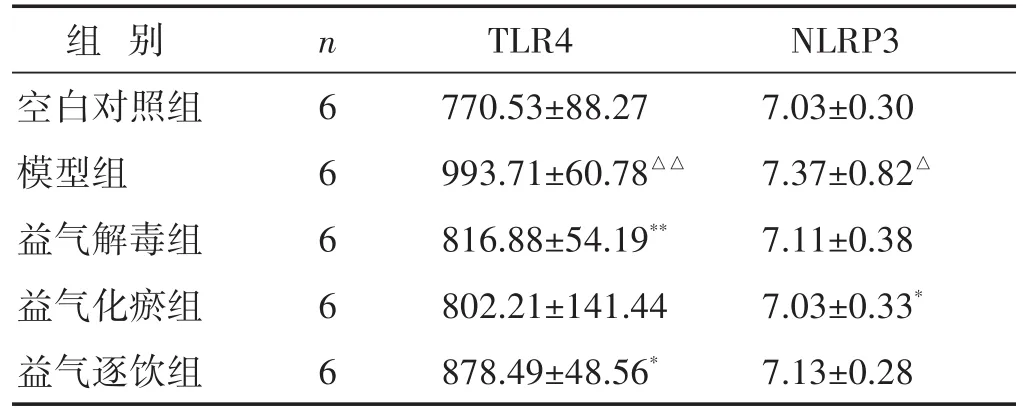
表1 各组大鼠肺匀浆中TLR4、NLRP3表达水平比较(ng/mL,±s)
注:与模型组比较,*P<0.05,**P<0.01;与空白对照组比较,△P<0.05,△△P<0.01。下同。
组别空白对照组模型组益气解毒组益气化瘀组益气逐饮组n 6 6 6 6 6 TLR4 770.53±88.27 993.71±60.78△△816.88±54.19**802.21±141.44 878.49±48.56*NLRP3 7.03±0.30 7.37±0.82△7.11±0.38 7.03±0.33*7.13±0.28
2.3 各组大鼠肺泡灌洗液中TLR4、NLRP3表达水平比较 见表2。与空白对照组相比,模型组肺泡灌洗液中TLR4表达水平显著升高(P<0.01);与模型组相比,益气解毒组、益气化瘀组、益气逐饮组肺泡灌洗液中TLR4表达水平有不同程度地降低,但差异无统计学意义(P>0.05)。与空白对照组相比,模型组肺泡灌洗液中NLRP3表达水平显著升高(P<0.01);与模型组相比,益气解毒组、益气化瘀组、益气逐饮组肺泡灌洗液中NLRP3表达水平均显著降低(P<0.01)。
表2 各组大鼠肺泡灌洗液中TLR4、NLRP3表达水平比较(±s)
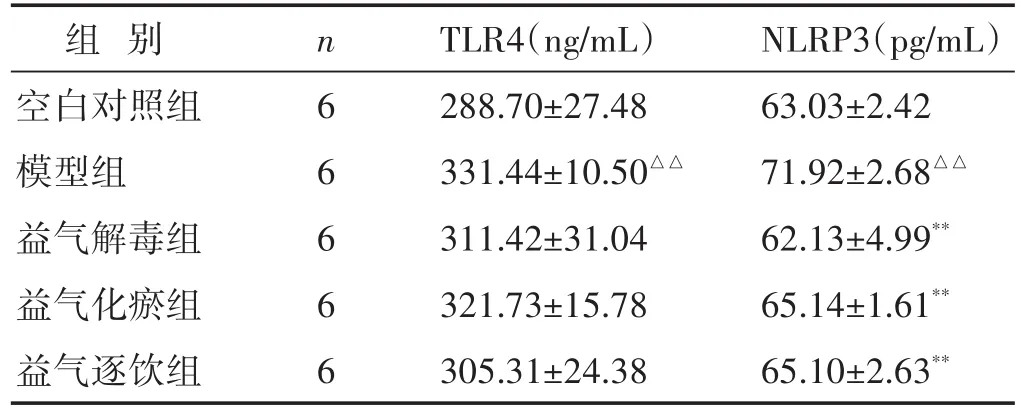
表2 各组大鼠肺泡灌洗液中TLR4、NLRP3表达水平比较(±s)
组别空白对照组模型组益气解毒组益气化瘀组益气逐饮组n 6 6 6 6 6 TLR4(ng/mL)288.70±27.48 331.44±10.50△△311.42±31.04 321.73±15.78 305.31±24.38 NLRP3(pg/mL)63.03±2.42 71.92±2.68△△62.13±4.99**65.14±1.61**65.10±2.63**
2.4 各组大鼠血清IL-1β、IL-18水平比较 见表3。与空白对照组相比,模型组血清IL-1β水平显著升高(P<0.01);与模型组相比,益气解毒组、益气化瘀组、益气逐饮组血清IL-1β表达水平显著降低(P<0.05或P<0.01)。与空白对照组相比,模型组IL-18水平显著升高(P<0.01);与模型组相比,益气解毒组、益气化瘀组、益气逐饮组IL-18水平显著降低(P<0.05或P<0.01)。
表3 各组大鼠血清中IL-1β、IL-18表达水平比较(pg/mL,±s)

表3 各组大鼠血清中IL-1β、IL-18表达水平比较(pg/mL,±s)
组别n IL-1βIL-18空白对照组模型组益气解毒组益气化瘀组益气逐饮组6 6 6 6 6 114.43±18.14 154.65±29.55△△109.49±23.96**87.83±19.82**118.90±27.77*170.01±11.06 197.38±24.23△△165.95±10.26**173.72±17.79*176.40±15.21*
3 讨论
近年来,ARDS的发病率呈上升趋势[7]。ARDS的发病机制非常复杂,炎症反应贯穿始终,炎症反应失控是ARDS的关键病理环节[8]。研究表明,TLR4-NLRP3通路在ARDS的过度炎症反应中发挥重要作用,微生物产物或细胞损伤相关的内源性分子能通过与TLR4结合,激活先天免疫系统[9]。如细菌内毒素脂多糖可激活TLR4受体,并通过核转录因子-κB途径来上调NLRP3炎症小体的表达[10],进一步促进下游IL-1β和IL-18的成熟和释放[11],进而引起急性肺损伤导致ARDS。
根据ARDS呼吸困难、喘促气急等临床表现,可将其归属为中医“暴喘”“肺衰”等范畴。本病与“虚”“瘀”“毒”“饮”密切相关,主要病机为感受外来邪气或遭受外伤,肺失宣降,水液代谢异常,饮邪停肺;肺宣降失司,气机逆乱,还可致气血运行不畅,气滞血瘀,外邪与饮邪、瘀血阻肺,久而化热,邪热壅滞肺内,耗伤气阴,瘀滞愈重,瘀热、饮邪酿而为毒,毒邪阻结于肺,损伤肺络,致使肺气骤虚、衰败,进而影响全身脏腑功能,甚则危及生命[12]。因此,“瘀饮化毒,肺气衰败”是ARDS的核心病机所在,而本病的治法应以“解毒、化瘀、逐饮、大补肺气”为主。
本研究将益气化瘀解毒汤拆分为益气解毒方、益气化瘀方和益气逐饮方,3方中均重用黄芪以大补肺气,挽骤衰之本。研究表明,黄芪可通过降低细胞间黏附分子-1及血管细胞间黏附分子-1表达水平,从而减轻肺损伤[13]。此外,针对“毒”“瘀”“饮”病理因素,不同拆方配以“解毒”“化瘀”“逐饮”治法。益气解毒方以黄芩、金银花清热解毒,研究证明,黄芩苷可抑制脂多糖诱导的急性肺损伤大鼠TLR4/JNK/ERK/NF-κB通路,发挥炎症抑制作用以减轻肺损伤[14]。金银花提取物可通过抑制IL-1、IL-6和TNF-α炎症介质和细胞因子,发挥保护ARDS大鼠模型肺组织的作用[15]。益气化瘀方以三七、赤芍活血化瘀,三七皂苷Rb1可降低ARDS模型大鼠炎症程度,通过改善肺组织线粒体结构与功能发挥肺保护作用[16],赤芍可通过促进微循环,改善组织血流灌注,提高ARDS动物模型的血液氧合功能[17]。益气逐饮方以葶苈子、桑白皮泻肺逐饮,有研究表明葶苈子具有改善ARDS患者心脏功能,减少血管外肺水的作用[18]。
本研究结果提示,各拆方均可降低ARDS大鼠模型炎性因子IL-1β和IL-18的表达水平,其机制可能是通过抑制TLR4的表达进而减少NLRP3的产生来发挥炎症抑制作用,其中益气解毒组对于TLR4-NLRP3通路的抑制作用更为明显。大量炎症细胞活化及炎症介质的释放可视为中医的邪毒化火,本研究证实益气解毒方在各拆方组中抑制炎症通路及炎症因子表达的作用最为显著。此外,ARDS病理环节中毒与血瘀和饮邪密切相关,故化瘀、逐饮可损毒之源,益毒之解,本研究亦证实益气化瘀方、益气逐饮方确有一定抗炎作用。
综上所述,益气解毒化瘀方不同拆方均可抑制ARDS大鼠模型TLR4、NLRP3的表达,进一步降低IL-1β和IL-18的表达水平,改善肺组织病理学形态,减轻肺损伤,其中益气解毒方可能发挥主要作用。因此,TLR4-NLRP3通路可能是益气解毒化瘀方不同拆方发挥抗炎作用干预ARDS的重要机制之一。

