基于医院大数据平台的临床试验智能管理系统的构建与应用
张明辉
哈尔滨医科大学附属肿瘤医院
李响
哈尔滨医科大学附属肿瘤医院
孔德娟
哈尔滨医科大学附属肿瘤医院
刘玮璐*
哈尔滨医科大学附属肿瘤医院
随着国家鼓励药品创新相关政策的出台、行业研发能力的不断增强,新药研发数量呈快速增长的趋势。传统的临床试验属于人力密集型执行模式,这就带来了临床研究资源不足的问题,如研究机构和研究者工作量大,从业人员水平参差不齐,受试者入组困难、依从性不佳,整个临床试验周期长、质量保证压力大、成本增加等,而临床试验信息化和智能化的发展推动了临床研究模式的革新。
1 临床试验管理面临的挑战
1.1 机构面临的挑战
1.1.1 工作量大,人员不足
据国家药品监督管理局药品审评中心数据显示,2020年共登记临床试验2602 项,较2019年总体增长9.1%(2386 项),其中,国内申办者占比超过70%。且根据2020 中国临床试验机构大会现场调研统计结果表明,相关机构普遍面临工作量大、人员有限的问题,在有限的人力下(小于5 人的机构占比46%),机构需要承担大量的质量管理工作(64%工作由机构质控人员承担)。
1.1.2 CRC/CRA 办公场地不足
由于医院科室办公场地紧张,多数医院临床协调员或(和)临床监查员(CRC/CRA)没有固定办公场地,经常多个相关单位的CRC/CRA 挤在一起办公,常出现找地方占位置的情况。为能完成现场监查任务,部分CRA甚至凌晨或周末到机构抢工位。除此之外,为完成任务CRC 乱接电源,也带来了火灾隐患。
1.1.3 机构绩效量化困难、晋升慢
根据2020 中国临床试验机构大会现场调研统计结果显示,虽然大部分(58%)临床试验机构已经成为一级处室,承担医院所有临床试验的管理工作,但还有相当一部分(42%)医院对临床试验机构的支持度不足。此外,大约40%参与投票的机构人员反馈临床试验的管理相关工作晋升慢或没有明确的晋升通道。
1.2 研究者面临的挑战
1.2.1 投入临床试验精力不够
研究者作为临床试验的关键主体,其积极性和参与度会影响临床试验的质量。在现行医药卫生体制下,医疗、科研、教学“三合一”密不可分,临床医生除需承担繁重的医疗任务外,还需兼顾科研、教学等任务,可能导致其对临床试验项目进度和质量关注度有所欠缺[1]。
1.2.2 受试者招募能力
受试者招募是影响临床试验进度及成败的重要环节。85%~95%的临床试验延期是由于不能按计划招募到合格的受试者[2]。随着精准医学的不断发展,受试者的招募条件越来越严格,不仅包含常见的年龄、检验、诊断、药品、病理等基本条件,还包含很多如治疗方案、疗效、治疗时间间隔、基因、手术等其他条件。目前,常用的传统方式是在医院信息系统(hospital information system,HIS)、实验室信息系统(laboratory information system,LIS)等系统内查找潜在受试者,该法效率低且难以及时、精准定位受试者。
1.3 申办方面临的挑战
1.3.1 临床试验耗时长,成本高
药物研发周期长、费用高、成功率低。据相关文献报道,新药研发平均成本约为20 亿美元,其中临床试验费用占总投入的70%,平均周期为8年[3]。在国家鼓励自主创新药物的政策推动下,国内自主研发的创新药物越来越多,其中肿瘤药物研发最为活跃,2019年肿瘤临床试验项目474 项,占全部药物注册临床试验的21.8%[4],激烈的竞争会导致试验周期延长尤其试验入组部分。因此,提升临床试验效率,对于降低研发成本,加速研发进程,改善临床未满足状况都具有重要意义。
1.3.2 临床试验质量参差不齐
国家药品监管部门对于临床试验质量高度重视。2015年7月22日,《国家食品药品监督管理总局关于开展药物临床试验数据自查核查工作的公告》发布,本次药物临床试验自查涉及1622 个品种。其中,申请人提交自查资料的注册申请为1094 个,占 67%;主动撤回的注册申请317 个,占20%;申请减免临床试验等不需要提交的注册申请193 个,占12%。
根据药物临床试验数据核查阶段性报告(2015年7月~2018年4月)国家药品监督管理局食品药品审核查验中心共完成480 个药品注册申请的现场核查,涉及被核查机构1390 个。发现质量问题数量最多的类别依次为:不良事件漏报(占比13.12%),方案违背(占比11.99%),合并非禁用药漏记(占比9.53%)[5]。
2 临床试验管理信息化与智能化建设的必要性
2.1 互联网和人工智能(AI)的发展推动了临床研究模式的革新
美国公司Deep 6 使用AI 解析临床试验的入选和排除标准,并对参与美国德州医学中心的患者健康数据进行匹配,帮助研究人员更快地找到更多的临床试验受试者。斯密特心脏研究所的研究人员利用该公司软件在1 小时内找到16 名合适的受试者参与临床试验,而应用传统方法在6 个月内只找到了2 名合适的受试者[6]。2021年4月《自然》杂志刊登相关文章,探讨如何使用AI 分析真实世界数据,简化肿瘤临床试验入组标准,并得出用数据驱动的方法评估入组标准可以增加临床试验设计的包容性,同时保证受试者安全的结论[7]。
2.2 政策鼓励了生命科学和信息技术的融合创新
2021年5月《国务院办公厅关于全面加强药品监管能力建设的实施意见》印发,要求推进全生命周期数字化管理,加强政府部门和行业组织、企业、第三方平台等有关数据开发利用,研究探索基于大数据的关键共性技术与应用,推进监管和产业数字化升级。同时,新冠肺炎疫情也推动了行业变革。以患者为中心的临床试验智能化和远程化已成为新趋势。监管部门和行业组织等均发布鼓励药物临床试验研究和过程管理电子化的文件或标准,强调信息技术的支撑作用,鼓励疫情期间应用远程监查、电子化招募等创新技术开展临床试验[8-11]。
3 利用信息化和智能化手段的建设思路
为了更好地规范临床试验管理,提高管理质量和执行效率。本文提出基于医院大数据平台的临床试验信息化与智能化解决方案。通过一体化信息建设和智能化数据服务建设应对临床试验管理中遇到的一系列挑战。
3.1 一体化信息系统建设
目前,市面上大多数临床试验管理系统(clinical trial management system,CTMS)都是一个相对孤立的办公系统,无法贯穿临床试验全过程。因此,本文提出临床试验管理一体化信息系统建设思路,不仅使审批在线化,同时根据方案将访视流程、关键节点等信息预设到CTMS 并与HIS、GCP 药房、影像中心等系统进行无缝连接。这样既能保证临床试验的质量,也能极大减少研究者与机构管理者的重复工作,如图1所示。
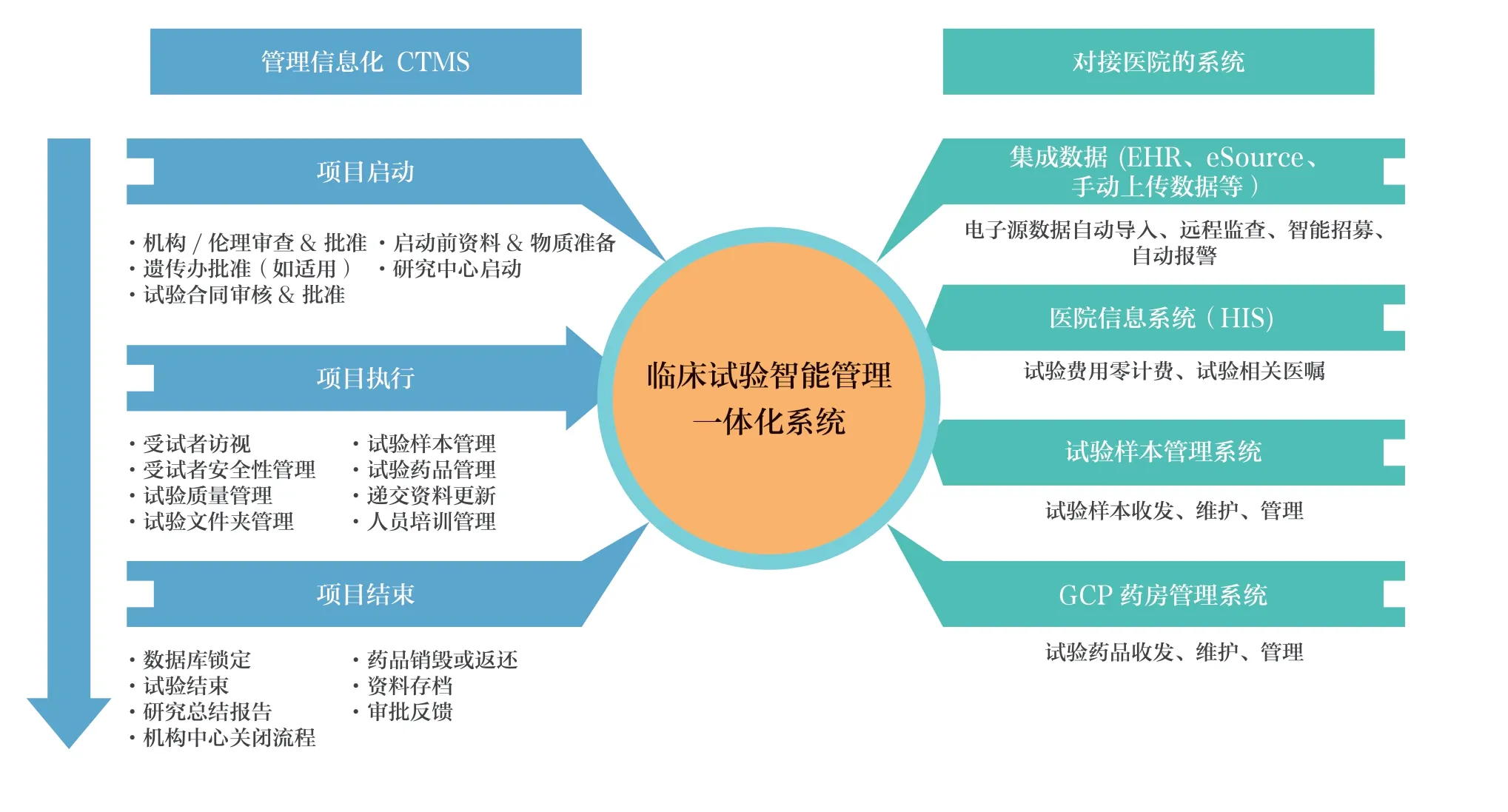
图1 临床试验智能管理一体化系统
3.1.1 审批流程在线化&任务驱动
CTMS 可实现全部业务流程、审批流程的在线化,与医院实际流程完全适配。在流程设计上提出利用立项、伦理、协议审核、遗传办等多线并行的方式,加速启动前期流程,实现项目快速启动。在执行中以任务流的方式驱动各流程环节中的角色功能,按重要程度进行优先级标注,引导机构快速完成主线工作,并设置提醒功能。这样研究者和机构工作人员在线上接受被分配的任务,由自己掌握上线操作时间,实现时间与精力更合理的分配。审批完成的节点若涉及附件,CTMS 也支持自动归档到电子档案库,减轻人工整理档案的工作量。CTMS 还可以及时了解试验进度、查看各个节点计划实际耗时和具体信息等,将之前分散在个人、不同部门的信息整合到一起,实现审核流程在线化。
3.1.2 移动端多角色场景适配
为了方便相关角色利用碎片时间办公,CTMS 可提供移动端多角色场景适配。无需登录电脑,研究者和机构工作人员可随时完成审查等工作。特别在伦理审查环节,伦理秘书通过CTMS 安排伦理会议、会议讨论内容,会议召开过程可通过手机、平板电脑等移动端进行,包括投票环节在内将伦理过程全部实现电子化与实时化,节约大量成本,减少了纸质文件递交。
3.1.3 全流程一体化无缝对接
CTMS 可无缝衔接医院各业务系统,融合临床研究与医生日常诊疗行为,便于临床试验的开展和信息记录,主要体现在以下2 个环节。
3.1.3.1 临床试验检查/检验医嘱开具
传统的临床试验相关检查检验,需要开具纸质申请并按照方案规定的项目进行检查。医技科室定期汇总实际发生检验检查数量提交财务统计,该过程中易出现误查、漏查等情况。此外,进行临床试验时需要受试者先垫付一部分费用,影响受试者的依从性和参与积极性。通过CTMS与HIS 系统进行对接,提前根据方案配置访视相关的检验检查项,医生直接在HIS 中选择预配置的检验检查,省略了上述的申请单开具与书写等过程,且受试者无需垫付费用,也不需要向机构和财务报批。CTMS 与HIS 系统的对接减少了方案违背,降低了CRC、研究者工作量,也可以减轻机构处理受试者报销的负担,如图2所示。

图2 临床试验检查检验一体化对接
3.1.3.2 临床试验药物医嘱开具
传统的临床试验药物管理主要为填写纸质表格、人工统计管理,其易出现差错或遗漏,甚至出现试验数据缺失等情况。依托CTMS 实现的GCP 药房管理系统,可实现贯穿药品的递送、接收、库存、发放、回收、销毁、退回等全流程闭环的信息化管理,特别是研究者可以在HIS 开具GCP 药品医嘱,医嘱信息直接传输到GCP 药房系统,可极大减轻CRC、研究者的工作量,如图3所示。

图3 临床试验药物全流程管理
3.1.4 临床试验全流程多维度量化闭环管理
传统机构管理中存在一个挑战即如何量化机构管理中的成果、问题以及进行针对性改进。多维度量化统计将临床试验管理过程中的各个环节电子化、数据化,最终通过整合成为临床试验管理数据库。多维度量化统计从临床试验不同角度对项目信息进行统计分析,有效实时监控项目进展,发现问题及时反馈并跟进,加强了临床试验的质量控制。此外,还可以根据需求自定义关注的指标纬度,进行组合分析,自定义绘图展现,多维度、多视角观察数据,如图4所示。
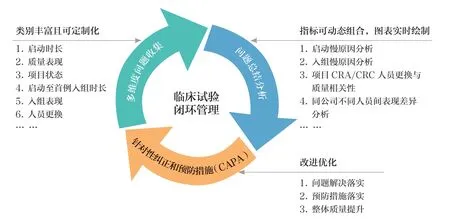
图4 机构的临床试验闭环管理
3.2 智能化服务建设
随着临床试验数量的快速增长,医院普遍面临资源有限的问题,利用大数据和人工智能技术,探索临床试验智能化是推动临床试验高效、高质量进行的有效手段。建议首先将医院分散的电子病例进行标准化、结构化、脱敏处理并集成作为临床试验数据。在此基础上开展远程监查、智能招募、电子源数据自动录入eSource 等一系列智能应用,为临床试验提质加速,如图5所示。

图5 临床试验智能化应用
3.2.1 远程监查
目前,申办方对监查工作投入很大,Eisenstein 等研究者报道监查已经占临床试验成本的20%~50%[6]。通过大数据与人工智能技术,将医院内部电子病例、患者院外数据等数据脱敏后上传到远程监查平台,可以为CRA提供安全可控的远程数据查看功能,确保在数据不出院且操作可留痕的前提下,协助完成临床试验监查工作,如图6所示。相比传统监查,远程监查具有更高质量、受试者更安全、更高效、更便捷、更低成本、更合规等优势,还可以解决医院办公条件受限等问题,提高临床试验的工作效率。

图6 远程监查执行方案
3.2.2 受试者智能招募
传统招募方法是研究人员通过翻阅病历查找符合条件的潜在受试者,给研究人员带来了大量的额外工作负担。智能招募可以协助研究团队和研究人员通过基于大数据算法深度挖掘存量及增量患者,定位疑似符合条件的潜在受试者并将符合条件的受试者入组,如图7所示。与传统招募方式相比,智能招募有数据挖掘更全面、更快等优势,可为临床试验其他环节节约大量时间成本。
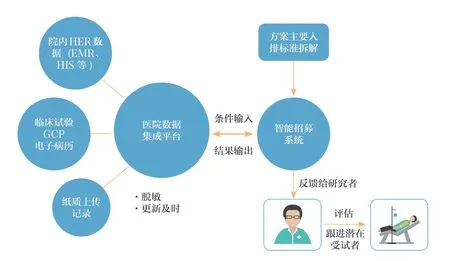
图7 受试者智能招募执行方案
3.2.3 eSource
利用计算机信息化平台和人工智能技术,基于临床试验项目电子源数据库,使电子病例中的数据形成统一标准并按照项目方案要求自动导入电子数据采集(Electronic Data Capture,EDC)系统。替代传统的人工录入,省去了人工比对的人力成本和时间成本,保证数据可溯源且数据质量符合ALCOA原则(attributable,legible,contemporaneous,original and accurate),提高了试验数据收集的效率和正确率,减少部分系统设计验证工作,提升了临床试验数据质量,从而缩短新药研发流程,如图8所示。相比传统人工录入的方式,eSource 自动录入优势包括数据录入工作量少、时效性大幅提升、CRA 监查工作量减少、数据采集质量高等。

图8 eSource 自动录入流程
4 结语
随着《“健康中国2030”规划纲要》的发布实施,全国各地陆续推出促进生物医药产业的相关政策,以患者为中心的临床研究数字化技术应用日益广泛,临床试验的信息化、智能化和远程化已成为必然趋势。未来研究人员将持续探索临床试验信息化与智能化的更多应用,发挥人工智能与大数据的技术优势,在研发策略支持、数据质量保障、临床研究协调、远程智能临床试验等多个领域探索。希望通过建立基于大数据平台的临床试验智能管理系统,能为临床试验、真实世界临床研究提供数字化智能化解决方案,缩短新药临床研究周期,不断促进我国临床试验产业快速发展。

