基于纳米金/羧基化碳纳米管的电化学传感器检测茶叶中多酚物质
王 芳,刘子超,王海宾,郄浩然,胡培毅,郭仕伟,郭建峰
(1.中北大学 化学工程与技术学院,太原 030051;2.山西省沙棘药茶联合创新研发基地,太原 030051)
茶叶作为饮品在我国有悠久的历史。茶多酚是茶叶中重要的滋味和功效物质,约占茶叶干重的14%~30%.茶多酚是多酚类物质的总称,主要包括儿茶素类化合物(如儿茶素、表儿茶素、表没食子酸儿茶素没食子酸酯(EGCG)等),黄酮类化合物(如芦丁、槲皮素等),以及酚酸类化合物等,其中儿茶素类化合物含量最高,其次为黄酮类化合物[1]。摄入茶多酚对人体健康有益,具有抗氧化、抗癌、降低血糖血压、抗病毒以及抗衰老等多种保健功能[2-5]。因此,茶多酚含量是评价茶叶品质的一个重要因素。
目前,用于茶多酚检测的方法主要有光谱分析法、色谱分析法和质谱分析法等[6-8]。分光光度法是常用方法之一,以没食子酸为标品,快速、简便地测出茶叶中总多酚含量,但是不能区分儿茶素类和黄酮类物质的量。液相及质谱方法可以准确检测出茶多酚物质的种类和含量,但是设备相对昂贵,前处理及检测过程通常较为复杂和费时。电化学检测方法是近年发展起来的一种检测方法,具有操作简单、所需设备成本较低、检测速度快、测量系统便携等诸多优点[9]。应用电化学方法检测茶多酚已有报道,MUGURUMA et al[10]以碳纳米管/羧甲基纤维素电极研究了绿茶中儿茶素的含量。谢耀聪等[11]以丝网印刷电极为传感器,以没食子酸为检测标准品,对茶叶中茶多酚进行测定,检测限为6.9×10-6mol/L.以上研究同分光光度法一样,主要检测多酚总量,不能对茶汤中的两类重要物质儿茶素类化合物和黄酮类化合物进行区分。

1 实验部分
1.1 仪器与试剂
电化学工作站CHI660E(上海辰华仪器公司);ZEISS MERLIN Compact型扫描电子显微镜(德国蔡司公司);超声波双频清洗机(宁波新芝生物科技股份有限公司);250 W红外干燥灯(深圳市光轩科技有限公司);实验采用标准的三电极体系:GCE(玻碳电极,直径 3 mm)及不同材料修饰的GCE为工作电极,铂电极为辅助电极,Ag/AgCl电极为参比电极。
槲皮素、没食子酸(GA)、芦丁,色谱纯,合肥博美生物科技有限公司;表儿茶素(EC)、表没食子酸儿茶素没食子酸酯(EGCG),色谱纯,上海安谱实验科技股份有限公司;羧基化碳纳米管,SWNTs-COOH,南京先丰纳米材料科技有限公司;氯金酸,分析纯,国药集团化学试剂有限公司;N,N-二甲基甲酰胺(DMF)、柠檬酸、柠檬酸钠、铁氰化钾、亚铁氰化钾、氯化钾均为分析纯,购自天津市科密欧化学试剂有限公司;茶叶为信阳尖峰茶(河南信阳)、正山小种(福建武夷山)及实验室自制沙棘叶茶(山西太原);实验用水为重蒸水。
1.2 纳米金/多壁碳纳米管修饰电极的制备
使用0.2~0.5 μm和0.02~0.05 μm规格的氧化铝粉依次对玻碳电极进行抛光打磨成镜面,用重蒸水和乙醇进行超声清洗,洗净后备用。取羧基化的碳纳米管分散在 N,N-二甲基甲酰胺(DMF)溶液中,超声30 min后形成1 mg/mL的均匀分散液。吸取7 μL的碳纳米管滴涂于玻碳电极上,置于红外干燥灯下干燥20 min后得到碳纳米管修饰电极(SWNTs-COOH/GCE).将SWNTs-COOH/GCE置于含1 mmol/L氯金酸(HAuCl4)的0.5 mol/L H2SO4溶液中,在-0.2~1.2 V的电位区间内进行循环伏安扫描,扫描速度为50 mV/s,扫描圈数为7圈,扫描完成后将电极使用乙醇和重蒸水洗净,将电极用氮气吹干后得到电极AuNPs/SWNTs-COOH/GCE,构建流程如图1所示。裸电极不修饰碳纳米管,直接电沉积纳米金制备AuNPs/GCE电极。

图1 纳米金/羧基化碳纳米管电极制备流程Fig.1 Nano-gold/carboxylated carbon nanotube electrode preparation process
1.3 茶叶样品预处理
称取0.2 g均匀磨碎的茶叶样品于50 mL离心管中,加入20 mL预热的70%乙醇溶液,70 ℃水浴加热30 min,3 500 r/min离心10 min,取上层清液,加入乙醇定容至25 mL,置于锥形瓶中于4 ℃下保存。
1.4 电化学测试
1.4.1修饰电极的电化学性能
采用循环伏安法(CV)和电化学阻抗谱(EIS)表征修饰电极的电化学性能。在含有0.10 mol/L KCl和5.0 mmol/L [Fe(CN)6]3-/4-溶液中进行测试,扫描范围为-0.2~0.8 V,扫描速度为0.1 V/s.
1.4.2样品电化学检测
采用三电极工作体系,以AuNPs/SWNTs-COOH/GCE修饰电极为工作电极,在含有多酚样品的0.1 mol/L pH 3.0的柠檬酸缓冲液中进行电化学测量,富集60 s后在电位范围为0~1 V范围内进行循环伏安扫描。在每次检测完样品后,将电极置于0.1 mol/L pH 3.0的柠檬酸缓冲液中使用CV扫描20圈除去电极表面残留。
2 结果与讨论
2.1 修饰电极形貌表征
采用扫描电镜(SEM)观测修饰前后电极表面的形貌变化,通过能谱仪测试修饰电极表面的元素分布,结果如图2所示。从SWNTs-COOH/GCE电极的SEM图(图2(a))可看出,SWNTs-COOH相互交织修饰在GCE表面,其管状结构增加传感器的比表面积,其修饰层主要含有C、O元素(图2(c)).电沉积纳米金后制备出AuNPs/SWNTs-COOH/GCE电极(图2(b)),从图中可以看出在碳纳米管的表面附着一层薄膜。在对应的能谱图2(d)中可以看出有Au元素的存在,表明在SWNTs-COOH/GCE电极上成功修饰了纳米金,制备出AuNPs/SWNTs-COOH/GCE电极。

图2 SWNTs-COOH/GCE及AuNPs/SWNTs-COOH/GCE的SEM图(a,b)及EDS图(c,d)Fig.2 SEM images (a,b) and EDS images (c,d) of SWNTs-COOH/GCE and AuNPs/SWNTs-COOH/GCE
2.2 修饰电极的电化学行为表征
以循环伏安法对修饰电极进行电化学表征,结果如图3(a)所示,可知,SWNTs-COOH/GCE和AuNPs/GCE的氧化峰电流值较裸电极氧化峰电流分别约高出20.4 μA和6.6 μA,分别为裸电极电流的148.6%和116.4%,表明SWNTs-COOH、AuNPs的修饰提高了裸电极的电化学性能。AuNPs/SWNTs-COOH复合材料修饰的电极与裸电极相比氧化峰电流高出约65.2 μA,为裸电极电流的253.5%,因修饰的两种复合材料协同作用显著提高了电极的导电性能。
电化学阻抗谱(EIS)可以表征电极的表面特性,进而考察电极在溶液中的电子传递效率,以研究电极修饰材料的导电性能。如图3(b)所示,对阻抗曲线进行了等效电路模型拟合。经计算,裸电极的电荷转移阻抗(Rct)为347.5 Ω.在裸电极上修饰AuNPs后Rct显著降低为101.3 Ω,主要是由于纳米金具有良好的导电性能,改善了电极的导电性;SWNTs-COOH/GCE电极较AuNPs/GCE电极具有更小的Rct(80.6 Ω),表明碳纳米管具有更好的电子传输能力;而AuNPs/SWNTs-COOH/GCE电极的Rct最小,为75.6 Ω,导电能力最好。究其原因,可能是纳米管具有较大的比表面积,协同纳米金极大地改善了其电化学性能,与CV研究结果一致。

a-GCE;b-AuNPs/GCE;c-SWNTs-COOH/GCE;d-AuNPs/SWNTs-COOH/GCE图3 不同修饰电极在含5.0 mmol/L[Fe(CN)6]3-/4-的0.1 mol/L KCl溶液中CV图(a)以及电化学阻抗谱(b)Fig.3 CV graph (a) and electrochemical impedance spectroscopy (b) of different modified electrodes in 0.1 mol/L KCl solution containing 5.0 mmol/L[Fe(CN)6]3-/4-
2.3 部分多酚类化合物在修饰电极上的氧化还原反应的表征
在AuNPs/SWNTs-COOH/GCE电极上使用CV法对部分多酚物质标品表儿茶素(EC)、没食子酸(GA)、表没食子酸儿茶素没食子酸酯(EGCG)、槲皮素和芦丁的氧化还原反应进行表征,其结构式如图4所示,电化学响应和峰值分配如图5所示。此外,还进行了多酚类化合物在电极上的电化学氧化途径研究,如图6所示。表儿茶素(EC)的CV图(图5(a))中,氧化峰Peak Ⅰ峰电位为(0.50±0.05)V,还原峰Peak Ⅱ峰电位为(0.44±0.01)V,为表儿茶素B环上邻苯二酚的羟基发生的氧化还原反应(图6(a)),且阴极电流与阳极电流之比为0.98,表明邻苯二酚的氧化还原反应是可逆的[10]。GA的CV图中(图5(b)),氧化峰Peak Ⅰ峰电位为(0.50±0.05)V,为苯环上的羟基氧化成醌基(图6(c)),在图中没有观察到还原峰,故GA苯环发生的反应为不可逆反应。EGCG的阳极扫描中(图5(c))观察到一个双氧化峰(Peak Ⅰ和Peak Ⅲ),氧化峰Peak Ⅲ峰电位为(0.41±0.01)V,为B环上的三酚氧化成醌基,氧化峰Peak Ⅰ峰电位为(0.50±0.01)V,为没食子酸酯上的三酚氧化到醌基[19](图6(b)、(c)).Ip1:Ip3为1.33,故Peak Ⅰ为主要响应峰。
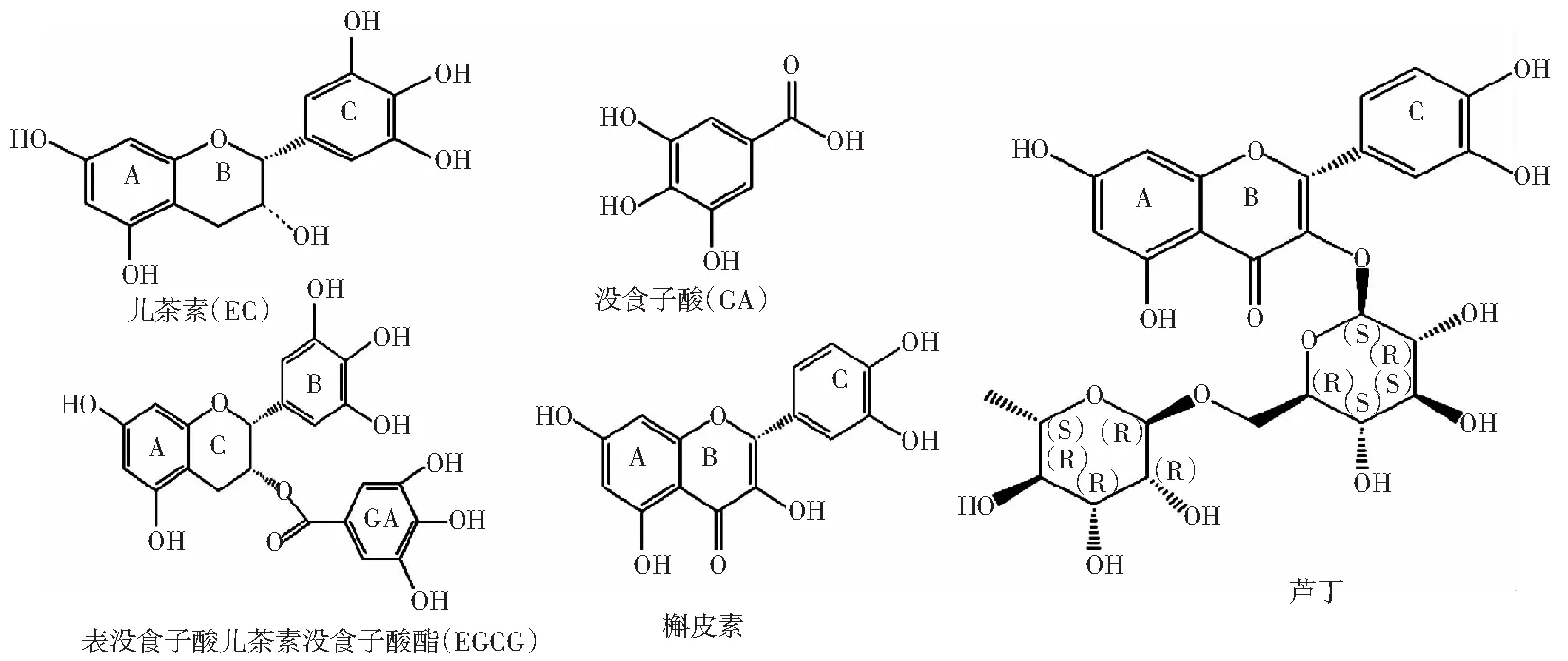
图4 表儿茶素、没食子酸、表没食子酸儿茶素没食子酸酯、槲皮素及芦丁结构式Fig.4 Structural formulas of epicatechin, gallic acid, epigallic acid catechin gallate, quercetin and rutin

The polyphenol concentration is 20 mmol/L in 0.1 mol/L pH 3 citrate buffer. The scanning speed is 50 mV/s图5 多酚在AuNPs/SWNTs-COOH/GCE电极上的CV反应Fig.5 CV reaction of polyphenols on AuNPs/SWNTs-COOH/GCE electrodes
在槲皮素(Q)的CV图(图5(d))中,在电位Ea=0.48 V的峰为B环上的邻苯二酚氧化为醌基(图6(a)),且观察不到还原峰,这表明槲皮素B环上发生的反应是不可逆的。在芦丁的CV图(图5(e))中,氧化峰Peak Ⅰ峰电位为(0.56±0.01)V,还原峰Peak Ⅱ峰电位为(0.54±0.01)V,为B环上的羟基发生的氧化还原反应(图6(a)),且阳极电流与阴极电流之比为0.98,表明芦丁发生的反应是可逆的。在槲皮素B环发生的氧化反应的电位在(0.48±0.01)V左右,而芦丁B环发生氧化反应的电位在(0.56±0.01)V左右,其原因可能是芦丁C环所连接糖苷键的影响,造成B环发生的反应电位发生偏移。

图6 电化学氧化途径Fig.6 Electrochemical oxidation pathway
2.4 多酚化合物在修饰电极上的吸附研究
在50~200 mV/s的范围内研究扫描速度对EGCG、槲皮素和芦丁的CV反应的影响,结果如图7(a-c)所示。EGCG、槲皮素与芦丁氧化峰电流与扫描速度的关系分别见公式(1)、公式(2)、公式(3):
Ip=152.260v+2.300,R2=0.991 .
(1)
Ip=78.344v+0.380,R2=0.995 .
(2)
Ip=76.212v+0.416,R2=0.990 .
(3)
EGCG、槲皮素与芦丁氧化峰电流与扫描速度成正比,说明EGCG、槲皮素与芦丁在修饰电极上的反应受吸附控制。因此,我们需要研究富集时间对氧化峰电流的影响。图7(d-f)显示,氧化峰电流值随着富集时间的增加而逐渐增大,EGCG和槲皮素在富集60 s后,氧化峰电流值趋于稳定;芦丁在40 s以后电流值趋于稳定。综合考虑确定富集时间为60 s.
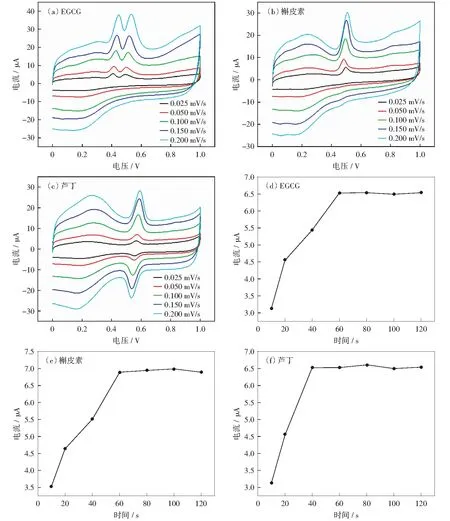
The reaction system is 0.1 mol/L pH 3 citric acid buffer. The polyphenol concentration is 20 μmol/L. The scanning speed is shown in the figure, and the scanning speed of the enrichment study is 50 mV/s图7 多酚在不同扫速下的CV曲线及在AuNPs/SWNTs-COOH/GCE电极上富集时间的研究Fig.7 CV curves of polyphenols at different scanning speeds and the study of the enrichment time of different polyphenols on AuNPs/SWNTs-COOH/GCE electrodes
2.5 单个多酚的电化学定量
在茶叶中EGCG是最丰富的儿茶素类化合物[20-21],黄酮醇类化合物以芦丁和槲皮素为主[22-23]。因此,本实验定量考察了EGCG、槲皮素、芦丁浓度与峰电流的响应关系,如图8所示。图8(a)、(b)分别为EGCG、槲皮素的浓度(c)与峰电流(Ip)的线性拟合,方程为式(4)、式(5),图8(c)为芦丁的浓度(c)与峰电流(Ip)的线性拟合,方程为式(6)及式(7):
Ip(μA)=0.252 3c(μmol/L)+0.435 3,
R2=0.991 .
(4)
Ip(μA)=0.226 8c(μmol/L)+0.830 7,
R2=0.992 .
(5)
Ip(μA)=0.618 0c(μmol/L)+0.378 8,R2=0.997
(浓度范围0.125 μmol/L~10 μmol/L) .
(6)
Ip(μA)=0.174 3c(μmol/L)+4.895 0,R2=0.997
(浓度范围10 μmol/L~60 μmol/L) .
(7)
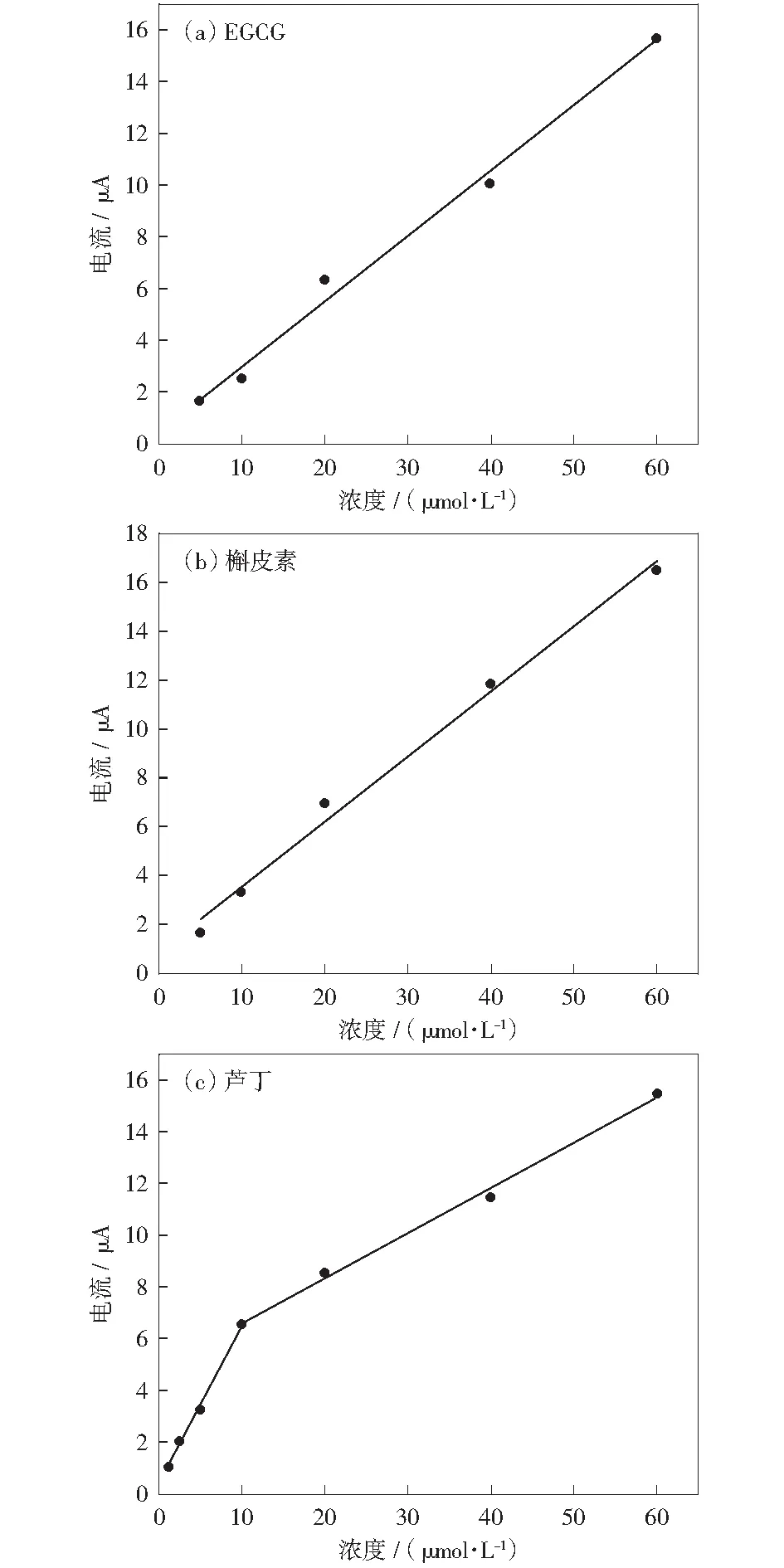
The polyphenol concentrations are 5, 10, 20, 40, and 60 μmol/L, respectively. The scanning speed is 50 mV/s. The reaction system is 0.1 mol/L pH 3 citrate buffer图8 不同多酚的标准曲线Fig.8 Standard curves of different polyphenols
2.6 混合溶液中的多酚定量
茶叶中包含EGCG、槲皮素、芦丁等多种物质,为了更好地检测茶叶中多酚的含量,实验以芦丁、槲皮素和EGCG的混合溶液作为多酚模拟体系进行CV分析。因为EGCG较高电位的氧化峰电位(Epa=0.500 V)与槲皮素的氧化峰电位(Epa=0.491 V)在混合溶液中进行CV检测时氧化峰发生重合,所以配制了不同浓度比例的EGCG和槲皮素溶液进行模拟,结果如图9所示。当c(EGCG)/c(槲皮素)的比值增大时,可观察到较低峰电位Peak Ⅲ(Epa=0.420 V)的电流值与较大峰电位Peak Ⅰ(Epa=0.500 V)的比值逐渐减小。研究了不同浓度比例的EGCG和槲皮素的峰电流与浓度的对应关系,如图10(a)所示,线性拟合方程见式(8):
Ip(μA)=0.263 2c(μmol/L)+0.891 1,
R2=0.982 .
(8)
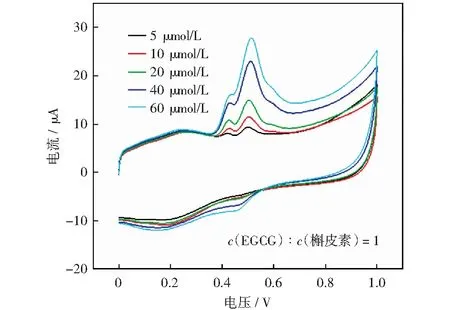
The scaning speed is 50 mV/s. The reaction system is 0.1 mol/L pH 3 citrate buffer图9 不同比例的EGCG和槲皮素的混合溶液在AuNPs/SWNTs-COOH/GCE电极上的CVFig.9 CV of mixed solutions of EGCG and quercetin in different proportions on AuNPs/SWNTs-COOH/GCE electrodes
这条线接近于含量为100%的EGCG或者槲皮素溶液,这表明峰电位在+0.49~0.50V范围的氧化峰电流可以量化总儿茶素。进行了c(EGCG)∶c(槲皮素)∶c(芦丁)浓度比分别为1∶1∶1、2∶2∶1、1∶1∶4的CV测试(芦丁含量分别为5 μmol/L、5 μmol/L、20 μmol/L),结果如图10(b)所示。图中除了EGCG与槲皮素共同的Peak Ⅰ以及EGCG特征性的Peak Ⅲ,还出现了芦丁的特征峰Peak Ⅳ(Epa=0.56 V).三种物质的混合溶液中芦丁氧化峰电位Peak Ⅳ与单独芦丁的溶液相比RSD为0.6%,氧化峰电流RSD为2.6%,所以在混合溶液中芦丁的氧化峰电位和电流基本不受EGCG和槲皮素的影响。故混合溶液中总黄酮的含量为槲皮素和芦丁之和。
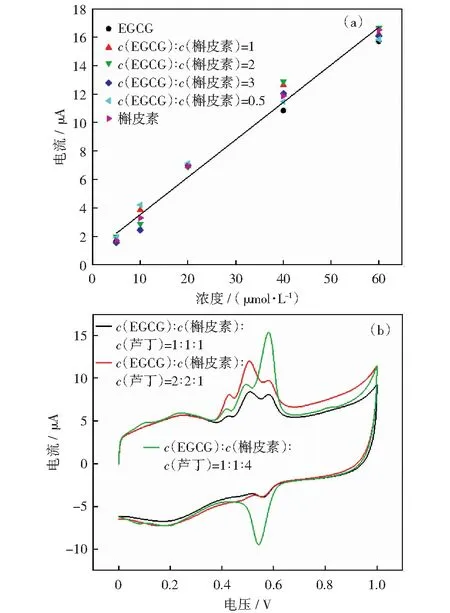
图10 不同比例的EGCG和槲皮素的CV氧化电流值与浓度的关系(a)和不同c(EGCG)∶c(槲皮素)∶c(芦丁)的混合溶液CV图(b)Fig.10 The relationship between the CV oxidation current value and concentration of EGCG and quercetin in different proportions (a) and the CV diagram of the mixed solution of c(EGCG)∶c(quercetin)∶c(rutin) in different proportions (b)
综上所述,混合溶液中多酚含量等于EGCG与芦丁之和。EGCG的CV图与槲皮素和槲皮素与芦丁的CV图有很大区别,当c(EGCG)∶c(槲皮素)∶c(芦丁)的比例改变时,CV图也会发生相应的改变。因此,CV图可大致估计c(EGCG)∶c(槲皮素)∶c(芦丁)的比例。
2.7 茶叶样品中茶多酚的测定
在实际应用中,根据公式(8)得出总儿茶素含量,式(6)和式(7)得出芦丁含量,茶多酚含量为两者之和。将修饰电极应用到不同茶叶样品进行CV测试,如图11所示。样品中总儿茶素含量、芦丁含量及总多酚含量如表1所示,其结果与福林法检测结果相比RSD在2.16%~3.11%之间。在图11中样品a没有观测到Epa=+0.42 V左右的氧化峰,故推测沙棘茶样品中几乎不含有EGCG,其样品经液质检测EGCG含量为0%,结果证实了我们的推测。
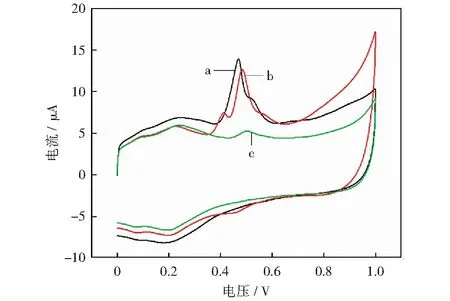
a-沙棘茶;b-毛峰茶;c-正山小种图11 不同茶叶样品多酚CV图Fig.11 Polyphenol CV diagram of different tea samples

表1 不同检测方法检测茶叶样品中多酚含量Table 1 Different detection methods to detect the content of polyphenols in tea samples
在最佳实验条件下,加标回收实验结果如表2所示,加入标品为EGCG,加标回收率为96.6%~101.17%。因此,本方法可用于茶叶中多酚的检测。
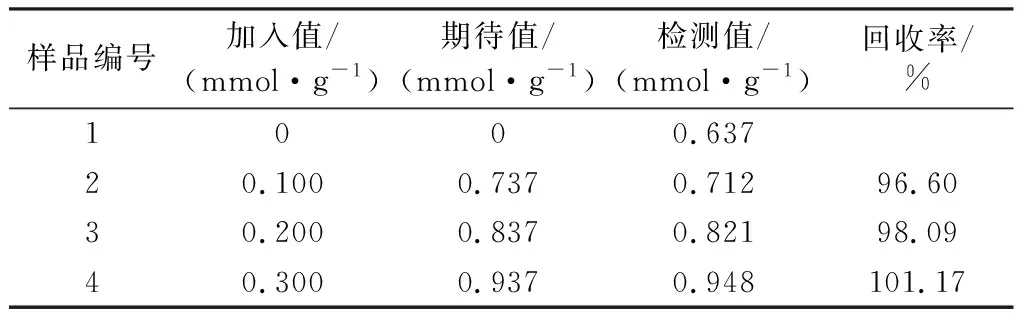
表2 沙棘茶中茶多酚加标回收率的测定Table 2 Determination of the recovery rate of tea polyphenols in seabuckthorn tea
2.8 稳定性重复性及抗干扰能力分析
在最佳的实验条件下,将AuNPs/SWNTs-COOH/GCE电极置于20 μmol/L EGCG溶液中平行测定10次,RSD为2.5%;将5根相同条件下制备的AuNPs/SWNTs-COOH/GCE电极置于20 μmol/L EGCG溶液中进行检测,RSD为4.1%,表明所制备的传感器具有较好的重现性。将AuNPs/SWNTs-COOH/GCE电极保存在4 ℃下的缓冲溶液中14天后,测得的电流响应值是初始响应的95%,说明传感器稳定性较好。因茶叶中含有VC、葡萄糖等有机物,相同条件下,用本传感器对VC和葡萄糖进行表征,发现对VC的敏感性比对EGCG的小1个数量级,对葡萄糖几乎无响应。所以AuNPs/SWNTs-COOH/GCE电极有良好的抗干扰能力。
3 结论
基于纳米金和羧基化碳纳米管的纳米材料构建了检测茶多酚的电化学传感器,实现了快速准确检测茶多酚,回收率为96.6%~101.17%.本传感器操作简单方便,无需复杂的样品前处理或者浓缩等步骤。本法可以检测茶汤中多酚物质的总量,并可同时测定出其中的儿茶素类化合物和芦丁的含量,该方法有望应用到饮料和葡萄酒等方面的检测。

