高比容量Li2ZnTi3O8@C-N负极材料储锂性能研究
沈紫烨,王利娟
(辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001)
随着电动车的广泛使用,具有安全稳定、容量大和寿命长等优点的锂离子电池在新能源领域占据越来越重要的地位[1]。目前,商业化锂离子电池负极所用的碳材料存在明显缺点:在循环过程中C层容易剥落,造成很大的容量损失;嵌锂电位与金属锂析出电位相近,析锂形成的枝晶会刺穿隔膜,导致电池短路。在可替代碳负极的材料中,钛基材料因具有安全性高的优点而受到广泛关注。Li4Ti5O12理论比容量为175.0 mA·h/g,在充放电过程中不会发生严重的晶格畸变,但Li4Ti5O12低能量密度和工作电位过高的缺点限制了该材料的应用。
相比于Li4Ti5O12负极材料,Li2Zn Ti3O8有较高的理论比容量(227 mA·h/g),0.5 V左右的放电平台可以有效避免锂枝晶的产生。Z.S.Hong等[2]研究了晶体空间群为P4332的Li2ZnTi3O8锂离子电池负极材料,其结构为(Li0.5Zn0.5)tet[Li0.5Ti1.5]octO4,其中n(Li)/n(Ti)=1∶3,Li+和Ti4+位 于 八 面 体 位 置,Zn2+则位于四面体位置,在这种结构中形成的三维网络有利于Li+在充放电过程中脱嵌。但是,该材料存在两大缺点:①Ti4+阻碍电子转移,导致电子电导率低;②Li2Zn Ti3O8结构中部分位于四面体上的Zn2+阻碍四面体上的Li+迁移,导致离子电导率低。
研究者针对该材料存在的不足开展大量工作,以期通过颗粒尺寸、掺杂和包覆等改性方法得到性能更佳的Li2Zn Ti3O8复合材料。L.J.Wang等[3]发现使用颗粒度适中的Ti O2为原材料,可以获得形貌更规整以及电化学性能更佳的Li2ZnTi3O8负极材料。C.Chen等[4]将大离子半径的Ce4+掺杂进Li2Zn Ti3O8晶格中取代部分Ti4+,达到了提高材料自身离子扩散系数的目的。其中,Li2Zn Ti2.95Ce0.05O8的倍率性能远高于未掺杂Ce4+的材料,在10、15、20 C(约2.3、3.4、4.5 A/g)的倍率下放电比容量可达197.3、187.7、181.1 mA·h/g。H.Yang等[5]制备硅酸镁锂包覆的Li2Zn Ti3O8复合材料,并进行了性能测试。结果表明,部分Mg2+取代四面体位置上的Zn2+,有利于改善电导率;硅酸镁锂质量分数为1.5%的复合材料循环性能改善最为显著,将测试过倍率性能的电池在电流密度0.5 A/g下循环400次,放电比容量依然高达148.3 mA·h/g。
碳具有导电性良好、来源广泛和价格低廉的优点,在材料表面包覆C层是一种提高材料电导率的有效改性方法[6-9];在制备过程中C层可以抑制材料颗粒生长,从而获得较小的粒径,这有利于缩短Li+的迁移距离。近年来,人们发现C层中掺杂N元素能诱导石墨结构产生缺陷,从而有利于Li+在表面进行扩散。N与C具有相似的电负性,同时N原子半径更小,多携带一个电子可以增强C层和正电荷离子之间的相互作用,提高电化学性能。刘心仪[10]采用甲壳素为N源合成了N掺杂C包覆的Li2Zn Ti3O8复合材料,其倍率性能显著提高,在5 C的倍率下循环200次放电比容量为195.1 mA·h/g,在10 C的倍率下放电比容量为190.6 mA·h/g。H.Q.Tang等[11]以不同聚合度的壳聚糖为C源制备了N掺杂C包覆的Li2ZnTi3O8复合材料,其倍率和循环性能显著提高,在5.0 A/g电流密度下循环500次后放电比容量依然为144.0 mA·h/g。Z,H.Meng等[12]以氨基三乙酸为N源合成的Li2Zn Ti3O8@C-N材料锂离子扩散系数显著提高,该样品在1.0 A/g电流密度下循环200次后放电比容量为172.5 mA·h/g。
多巴胺(DA)分子式为C8H11NO2,在高温碳化时,其中的N元素可以掺杂在C骨架上,最终得到N掺杂C;多巴胺及其衍生物无毒无害,更符合人们使用环保型原材料的科学理念。基于以上优点,多巴胺常作为制备N掺杂C的原材料应用于各种电极材料的改性中。
但是,在过去的研究中人们大多集中于探索和提高Li2Zn Ti3O8材料的室温电化学性能,对低温性能研究较少。本研究以盐酸多巴胺为N、C源,采用固相法原位合成N掺杂的C包覆Li2Zn Ti3O8(LZTO)负极材料,碳化过程中部分Ti4+被还原为Ti3+,达到了包覆和掺杂共同改性的目的。
1 实验部分
1.1 试剂与仪器
试剂:碳酸锂(Li2CO3),分析纯,上海麦克林生化科技有限公司;金红石型纳米二氧化钛(nano-Ti O2),VK-T25,宣城晶瑞新材料有限公司;纳米氧化锌(nano-ZnO),VK-J30,宣城晶瑞新材料有限公司;盐酸多巴胺(C8H11NO2·HCl),分析纯,上海阿拉丁生化科技股份有限公司;无水乙醇(C2H5OH),分析纯,天津恒兴化学试剂制造有限公司;导电炭黑(Super P)、聚偏氟乙烯(P VDF),电池级,国药集团化学试剂有限公司;1-甲基-2-吡咯烷酮(NMP),分析纯,国药集团化学试剂有限公司。
仪器:ME104E分析天平,梅特勒-托利多集团股份有限公司;XGB04行星球磨机,长春海涵仪器有限公司;DZF6050鼓风干燥箱、DZF-6030A真空干燥箱,上海一恒科学仪器有限公司;OTF-1200X管式炉,合肥科晶材料技术有限公司;Super(1220/7507900)超级净化手套箱,上海米开罗那机电技术有限公司;CT-3008-5V10mA高性能电池测试系统,深圳新威新能源技术有限公司;CHI66E华辰电化学工作站,上海辰华仪器有限公司;SPL-150恒温箱,天津莱玻特瑞仪器设备有限公司;SDT Q600热重-热差分析仪(N2气氛,25~800℃,升温速率为10℃/min),德国耐驰公司;D8 Advance X射线粉末衍射仪(Cu靶,Kα射线,工作电压40 kV,工作电流40 mA),德国布鲁克公司;ESCALAB 250 X射线光电子能谱仪(Al靶,Kα射线,光电子能量为1 486.6 eV)、SU8010扫描电子显微镜,日本日立公司;JEM-2100F透射电子显微镜,日本电子株式会社。
1.2 实验过程
根据Li、Zn、Ti的化学计量比(2.0∶1.0∶3.0),按物质的量比为1.1∶1.0∶3.0称取Li2CO3、ZnO、Ti O2,多余的锂盐用于补偿热处理过程中锂的挥发。盐酸多巴胺的添加质量分别为目标产物质量的10%、15%和20%,以无水乙醇为分散剂,在行星球磨机内先以150 r/min的转速球磨2 h,再以400 r/min的转速球磨5 h;取出浆料并烘干,得到混合均匀的前驱体粉末。于Ar/H2混合气保护下以5℃/min的速率升温至700℃,煅烧3 h,自然冷却至室温后取出,经研磨得到Li2Zn Ti3O8@C-N复合材料,分别命名为LZTO@C-N-1、LZTO@C-N-2和LZTO@C-N-3。作为对照,未改性样品不加入盐酸多巴胺,其他条件均不变,并命名为P-LZTO。
1.3 电极的制备及电池的组装
用适量的NMP将质量比为1.00∶0.50∶0.85的导电炭黑、聚偏氟乙烯和活性物质的混合物调匀成浆状,均匀地涂覆在擦拭干净的铜集流体上,在60℃鼓风干燥箱中烘8 h,用冲片机冲成直径为12 mm、活性物质负载量大于2.0 mg的圆形电极片。最后将该圆形极片放入120℃真空干燥箱烘干5 h以上,得到工作电极。
半电池的组装在充满氩气的手套箱中进行,称取质量相同的极片作为工作电极,金属锂片作为半电池的对电极,隔膜为聚丙烯薄膜,1.0 mol/L Li PF6的碳酸乙烯酯(EC)-碳酸二甲酯(DMC)溶液(体积比为1∶1)为半电池的电解液,装配成型号为2025的纽扣电池。
1.4 电化学性能测试
在室温(25℃)和低温(0℃)的条件下,利用新威电池测试仪对组装的半电池进行循环性能和倍率性能测试,测试电势为0.02~3.00 V。用CHI660E电化学工作站在室温下进行循环伏安(CV)测试和交流阻抗测试(EIS)。CV测试条件:电势为0.02~3.00 V,扫描速率为0.5 mV/s;EIS测试条件:频率为0.01 Hz~100.00 k Hz,振幅为5 mV。
2 结果与讨论
2.1 样品的结构分析
2.1.1 XRD分析 P-LZTO和LZTO@C-N系列样品的XRD图谱见图1。由图1可见,4个样品的衍射峰均与标准卡片(JCPDS no.86-1512)相对应,表明所有样品都是立方尖晶石型,C包覆并未改变材料本身所具有的结构;从XRD图谱中未见C相关的衍射峰,说明残留的C是无定形或者C层非常薄[13-14];LZTO@C-N系列样品的衍射峰均弱于P-LZTO材料的衍射峰,原因是高温煅烧过程中包覆在颗粒外的C层导致结晶度下降,使衍射峰的强度降低。另外,发现LZTO@C-N系列样品中存在其他相,初步判断31.7°的杂质峰为Li ZnN,杂质的存在不利于电极材料的循环性能。
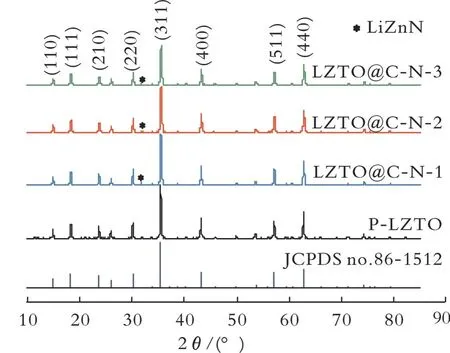
图1 P-LZTO和LZTO@C-N系列样品的XRD图谱Fig.1 XRD patterns of P-LZTO and LZTO@C-N samples
样品的晶胞参数如表1所示。由表1可知,随着盐酸多巴胺投入量的增加,包覆后的样品显示出更小的晶格参数(a)和晶胞体积(V),这归因于LZTO@C-N系列样品经过热处理形成的Ti3+。C热还原反应引起部分Ti4+转变为Ti3+,虽然Ti3+离子半径(0.067 nm)比Ti4+离子半径(0.061 nm)大,但为了保持电中性,LZTO会生成一些氧空位,从而产生的晶格缺陷或畸变引起晶胞参数变小[15]。具有还原性的Ar/H2混合气常用来制备含氧空位的LZTO,并且氧空位的浓度越高晶胞参数越小[16-17]。因此,在C热还原反应和Ar/H2混合气的共同作用下,晶胞参数随包覆量的增加逐渐减小[18]。
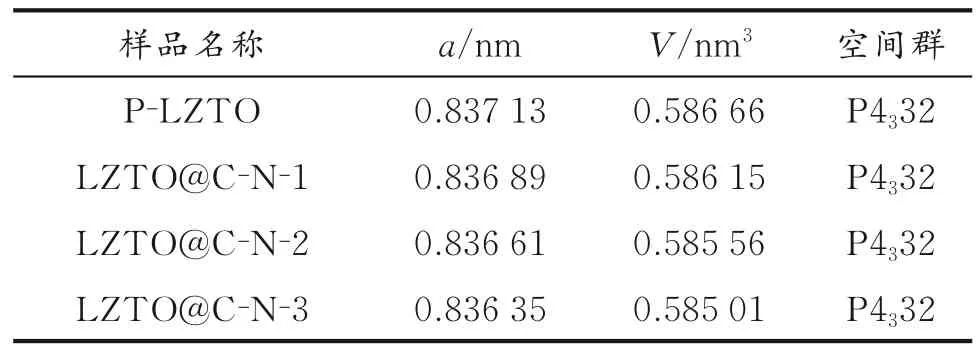
表1 P-LZTO和LZTO@C-N系列样品的晶胞参数Table 1 Lattice parameters of P-LZTO and LZTO@C-N samples
2.1.2 热重分析 为测定包覆在LZTO颗粒外的C质量分数,LZTO@C-N系列样品进行热重分析,结果见图2。由图2可见,在温度从室温升至250℃的过程中有1.00%~2.00%的质量损失,该质量损失可归因于LZTO@C-N系列样品吸附的水分受热蒸发;在温度从300℃升至500℃时,出现明显的质量损失,对应C层在空气中氧化;温度高于600℃时,即使继续升温也没有质量损失,表明LZTO结构较为稳定。由热重分析结果可得,LZTO@C-N-1、LZTO@C-N-2和LZTO@C-N-3的C质量分数分别为4.05%、5.79%、7.52%。
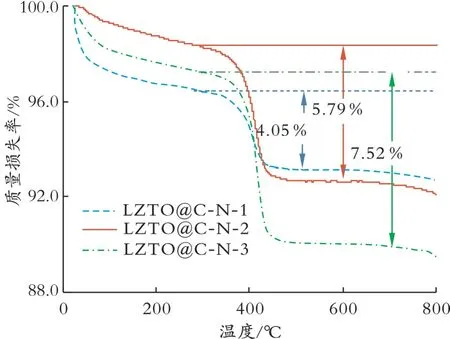
图2 LZTO@C-N系列样品的TG图谱Fig.2 TG curves of the LZTO@C-N samples
2.1.3 XPS分析 图3为LZTO@C-N系列样品的XPS图谱。由图3(a)可以看出,包覆后的样品中含有Li、Zn、Ti、O、C和N元素。由图3(b)可以看出,LZTO@-C-N系列样品的C 1s高分辨图谱中C主要以位于284.7 e V的C−C和位于284.3 e V处的C=C的形式存在,C=C的存在可以进一步提高材料的导电性;C还会以C−N(285.2 eV)、C≡N(286.0 eV)和C=N(287.4 eV)的形式存在,说明N元素已掺杂在C层中。由于N元素的电负性大于C元素,C≡N和O=C−O形成的导电网络有利于提高电子电导率[19-20]。C≡N可以使石墨结构出现缺陷,有利于Li+在表面进行扩散。
由图3(c)可以看出,N主要以位于398.1 e V的吡啶−N、位于399.8 e V的吡咯−N、位于400.8 e V的石墨−N和401.9 eV的季铵−N的形式存在[21],还以位于396.0 e V的金属−N和398.8 e V的C−N的形式存在[22-23]。大部分金属−N都在397.0 eV附近出现XPS峰[24-25],有可能是Ti−N和Zn−N,前者归属于LZTO中的Ti与N元素成键,后者则归属于Li Zn N杂质或LZTO中的Zn−N,这与XRD结果相吻合。具有电化学活性的吡啶−N和吡咯−N分别位于C结构网络中内部缺陷处和边缘处,使C骨架结构产生缺陷或空位,有利于Li+迁移;石墨−N有利于提高材料的导电性;适量的N−Ti也有利于电子的传输。
由图3(d)可以看出,LZTO中Ti4+的两个特征峰Ti4+2p3/2(459.3 eV)和Ti4+2p1/2(465.3 e V)。N元素与LZTO材料中的Ti和O元素形成N−Ti−O(459.1 e V),可以降低界面活性,增强包覆层稳定性[26]。由图3(d)还可以看出,存在Ti3+2p3/2(457.8 eV)、Ti3+2p1/2(463.7 eV)的特征峰,说明在C热还原和Ar/H2混合气的共同作用下,部分Ti4+被还原成Ti3+,Ti4+和Ti3+的共同存在有利于提高材料的电子电导性。

图3 LZTO@C-N系列样品的XPS图谱Fig.3 XPS spectra of LZTO@C-N samples
2.1.4 形貌分析 图4为P-LZTO和LZTO@CN系列样品的SEM和TEM。

图4 P-LZTO和LZTO@C-N系列样品的SEM和TEM图Fig.4 SEM and TEM images of P-LZTO and LZTO@C-N samples
由SEM图可以观察到,LZTO粒子被表面粗糙的C层包裹,包覆前后的样品均为无规则颗粒状。由TEM图可以看出,LZTO@C-N-1样品有部分粒子表面未被包覆,可能是因为C质量分数较低导致包覆不均匀;LZTO@C-N-2样品有较为均匀的C层,其厚度为15~18 nm,C层均匀地包覆有利于电化学性能的提高;LZTO@C-N-3样品可能因为C质量分数较高,C层厚度在20 nm以上,过厚的C层会影响比容量。
2.2 样品的电化学性能分析
2.2.1 室温(25℃)电化学性能 图5是P-LZTO和LZTO@C-N系列样品在0.2 A/g时的首次充放电曲线。
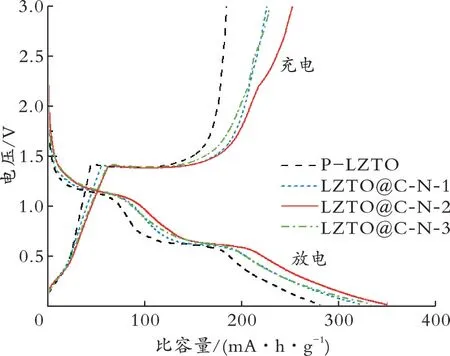
图5 P-LZTO和LZTO@C-N系列样品首次充放电曲线Fig.5 Initial discharge-charge curves of P-LZTO and LZTO@C-N samples
由 图5可 知,P-LZTO、LZTO@C-N-1、LZTO@C-N-2和LZTO@C-N-3样品的首次充放电比 容 量 分 别 为279.6、322.7、348.6、332.7 mA·h/g。C的引入提高了LZTO@C-N系列样品的放电比容量,其中LZTO@C-N-2的比容量最大,这可能是由于包覆的C层提供了较多的活性位点,Li+不仅嵌入LZTO内部,还能在C层中脱嵌。LZTO@C-N-3样品C质量分数最高,但C层过厚会阻碍锂离子的脱嵌,造成比容量损失;过多LiZnN的存在也可能导致放电比容量降低,因此该样品的首次放电比容量低于LZTO@C-N-2。各样品的不可逆容量损失较大,这与固体电解质界面层(SEI)的形成有关。
图6为P-LZTO和LZTO@C-N系列样品的循环性能曲线。
由图6(a)可知,LZTO@C-N-2首次放电比容量可达276.4 mA·h/g,循环300次之后可逆比容量为193.8 mA·h/g,远高于P-LZTO(157.4 mA·h/g)、LZTO@C-N-1(151.5 mA·h/g)、LZTO@C-N-3(133.5 mA·h/g)。相对于第二次放电比容量,PLZTO、LZTO@C-N-1、LZTO@C-N-2和LZTO@C-N-3样品的容量保持率分别为84.78%、67.15%、79.26%、55.77%,包覆后的样品容量保持率降低,这可能是因为N掺杂C包覆有利于提高材料的循环性能,但循环寿命短的Li Zn N严重影响LZTO@C-N的循环稳定性[12]。
由 图6(b)可 知,P-LZTO、LZTO@C-N-1、LZTO@C-N-2和LZTO@C-N-3样品的首次放电比容量分别为226.4、240.8、271.5、250.1 mA·h/g;充放电循环500次后,容量保持率分别为64.15%、36.51%、61.24%和23.53%(相对于第二次放电比容量)。LZTO@C-N-2的比容量较高,而容量保持率较低,这与电流密度0.5 A/g时的循环测试结果相同。电流密度为0.5、1.0 A/g时LZTO@C-N-2均具有最佳的循环性能,这可能是适量的N掺杂C能够最大限度地提高材料的循环性能。
表2为C包覆改性后的LZTO材料循环后的比容量对比。由表2可以看出,LZTO@C-N-2循环后的放电比容量依然高出文献报道的部分改性材料。
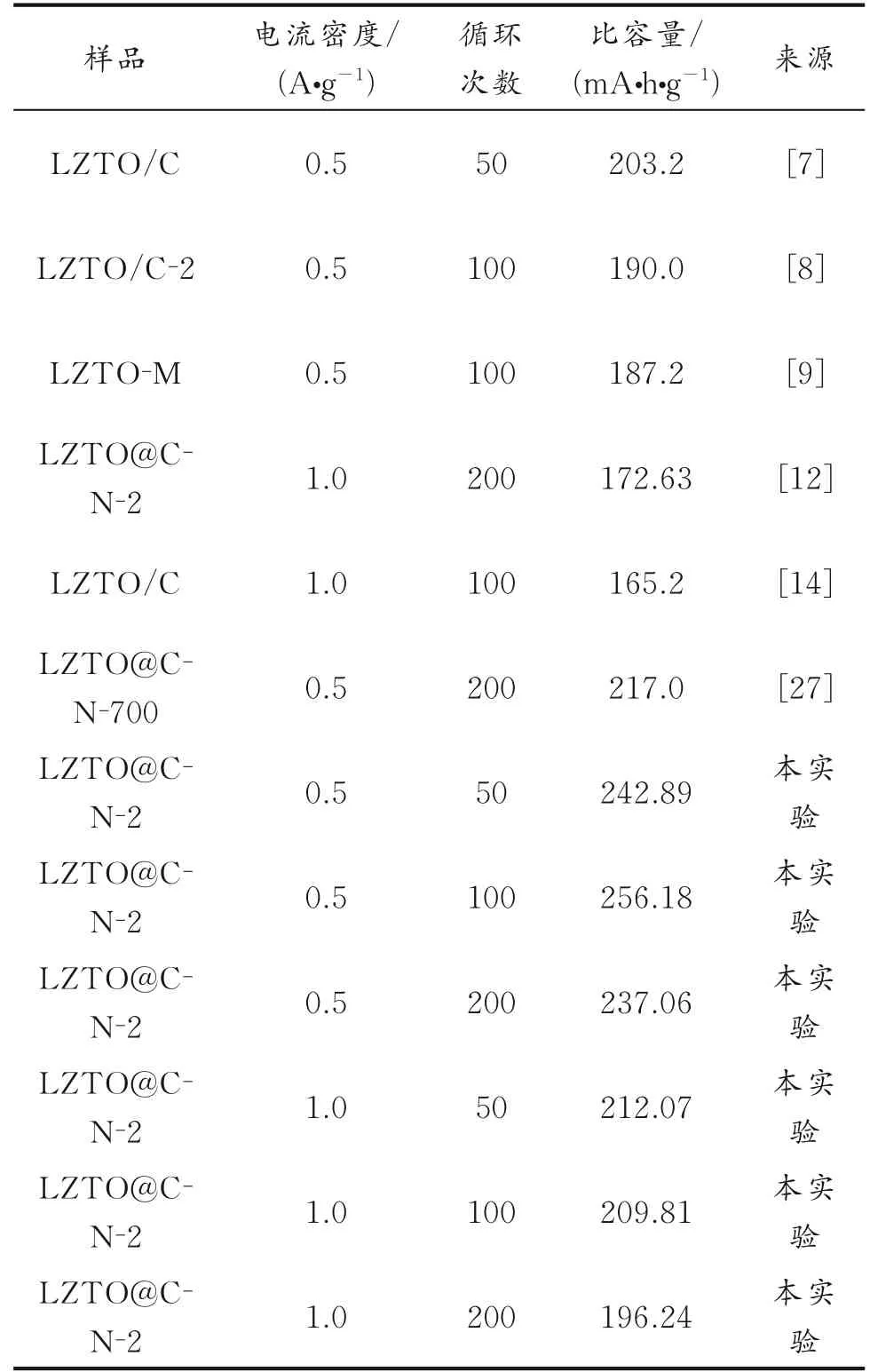
表2 C包覆改性后的LZTO材料循环后的比容量Table 2 Comparison of the specific capacities of carboncoated LZTO materials
图7为P-LZTO和LZTO@C-N系列样品的倍率性能曲线。由图7可见,LZTO@C-N-2具有最高的放电比容量。LZTO@C-N-3样品在高倍率时放电比容量比P-LZTO差,可能的原因是:(1)Ti3+和氧空位浓度过高,会使材料中产生过多晶格缺陷,从而导致放电比容量较差[18];(2)过厚的N掺杂C层不利于Li+的扩散;(3)由于LZTO@C-N-3晶胞参数过小,不利于Li+在晶格内脱嵌。电流密度为0.5、1.0、1.5、2.0、2.5、3.0 A/g时,LZTO@C-N-2放电 比 容 量 分 别 超 过240.0、220.0、210.0、200.0、190.0、180.0 mA·h/g,电 流 密 度 为0.5 A/g时,LZTO@C-N-2样品的放电比容量恢复为240.0 mA·h/g以上。这可归因于适量的N掺杂C提高了离子电导率,Ti3+的存在有利于电子转移,使材料的比容量得到恢复。
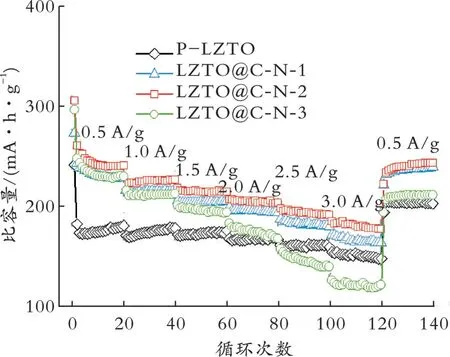
图7 P-LZTO和LZTO@C-N样品的倍率性能曲线Fig.7 Rate capability of P-LZTO and LZTO@C-N samples
表3为C包覆改性后LZTO材料高倍率下的比容量。由表3可见,LZTO@C-N-2样品在高倍率下的放电比容量也高于文献报道的部分改性材料。
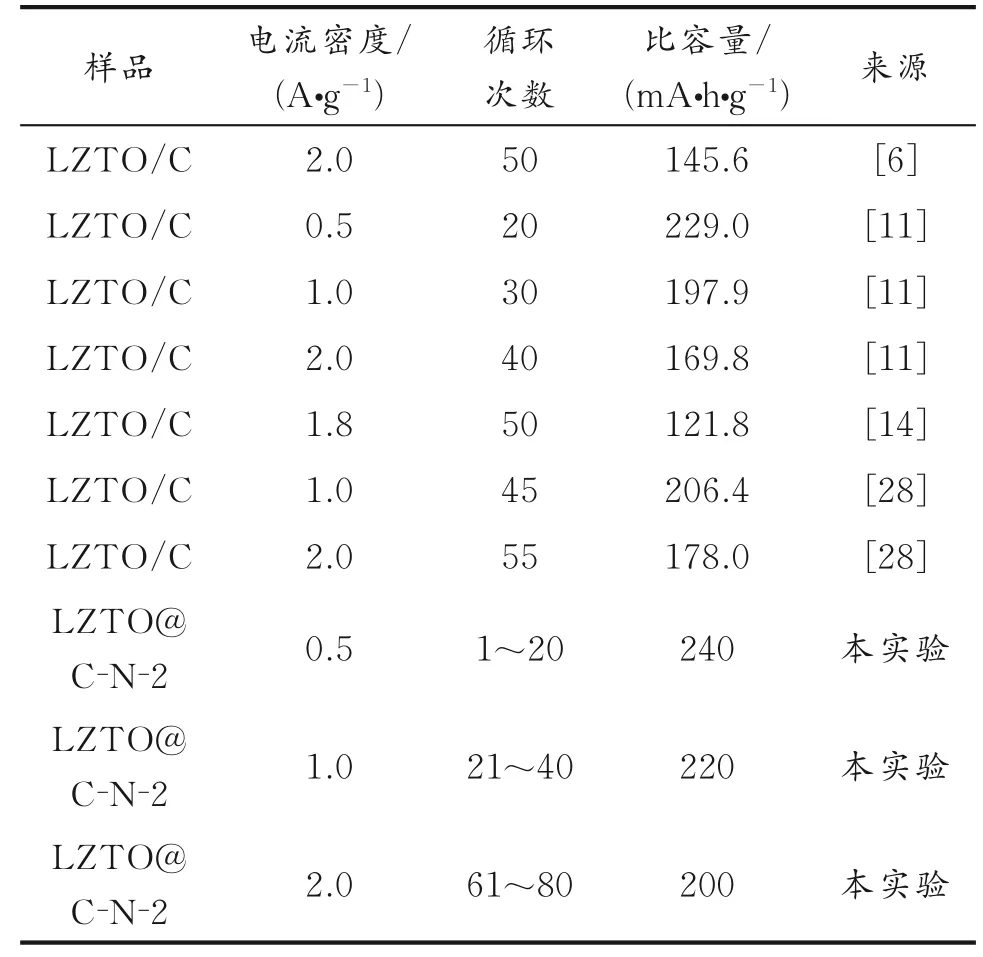
表3 C包覆改性后LZTO材料的倍率性能对比Table 3 Comparison of the rate capability for carboncoated LZTO materials
结合表2、3可以看出,LZTO@C-N-2样品相比于文献报道的改性的LZTO材料,在循环后和高倍率下表现出更高的放电比容量。结合物理表征分析原因,可归因于以下几点:(1)适量的N掺杂C包覆提高了材料的导电性;(2)与纯C包覆层相比,N掺杂使C骨架结构产生缺陷或空位,更利于Li+的迁移;(3)Ti的混合价态和N−Ti−O有利于改善LZTO材料的导电性;(4)上述三点影响因素之间良好的协同作用,使LZTO@C-N-2样品表现出较高的放电比容量。
图8为P-LZTO和LZTO@C-N-2的CV曲线。
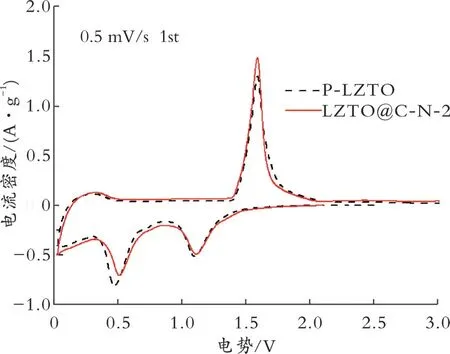
图8 P-LZTO和LZTO@C-N-2样品的CV曲线Fig.8 CV curves of P-LZTO and LZTO@C-N-2 samples
由图8可见,在1.00~1.70 V出现一对氧化还原峰,这对峰对应的是Ti4+/Ti3+的氧化还原电对[3];另外,在0.50 V处还有一个还原峰,对应嵌锂过程中Ti4+的多次还原反应[15],说明材料本身的电化学行为不因包覆C层而改变。由图8还可以看出,P-LZTO和LZTO@C-N-2样品的氧化还原峰电势分别为1.09、1.59 V和1.09、1.58 V,电势差值分别为0.49、0.48 V。电势差值越小表明电极极化越小,所以LZTO@C-N-2的电极极化最小,意味着该样品应该具有更好的可逆性和循环稳定性,但由于Li Zn N的存在对材料实际循环性能影响较大,因此容量保持率低于未改性样品。
图9为P-LZTO和LZTO@C-N-2样品的EIS曲线。
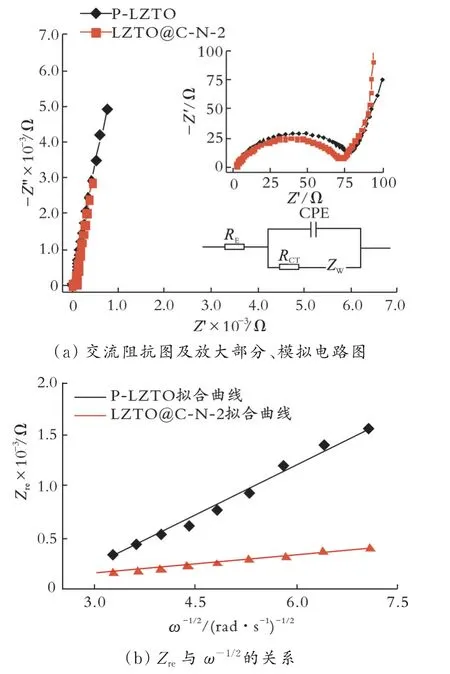
图9 P-LZTO和LZTO@C-N-2样品的EIS曲线及Z re与ω−1/2的关系图Fig.9 Electrochemical impedance spectroscopies and relationship between Z re andω-1/2 for P-LZTO and LZTO@C-N-2 samples
由图9(a)可以看出,P-LZTO和LZTO@C-N-2样品循环前的EIS图谱均由高频区的一个小截距、中频区的一个半圆和低频区的一条斜线所组成。中高频区放大和采用的等效电路如插图所示。其中,RE为电解液和电池各组件的接触电阻;RCT为电荷转移电阻,其值等于圆弧半径,电荷转移电阻的大小决定电化学反应的难易程度;ZW为Warburg扩散阻抗,代表Li+的扩散能力;CPE代表双层电容。
低频区Zre和ω-1/2之间的关系为:
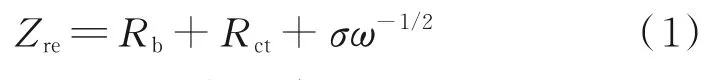
式中,ω为正弦交流电的角频率,rad/s;
P-LZTO和LZTO@C-N系列样品的离子扩散系数计算公式为:
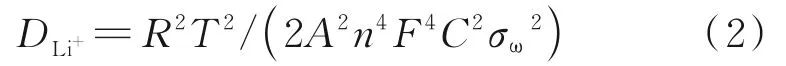
式中,R为气体常数,其值为8.314 J/(mol·K);T为室温,其值为298.5 K;A为电极表面积,其值为1.13 cm2;n为氧化还原电对在半反应中转移的电子数;F为法拉第常数,其值为96 485 C/mol;σ为Warburg因子;C为化合物中Li+的浓度,mol/L。
表4为P-LZTO和LZTO@C-N-2交流阻抗参数。由表4可见,改性后LZTO@C-N-2样品的电荷转移电阻减小,有利于电化学反应的进行[22];LZTO@C-N-2样品的扩散系数比P-LZTO高出两个数量级,说明适量的N掺杂C包覆和Ti3+自掺杂有利于离子的快速扩散,进而提高电池材料的放电比容量,与文献[22]报道相一致。
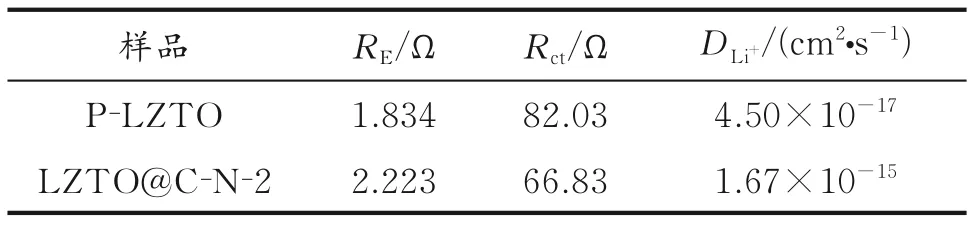
表4 P-LZTO和LZTO@C-N-2交流阻抗参数Table 4 Electrochemical impedance parameters for P-LZTO and LZTO@C-N-2 electrodes
2.2.2 低温(0℃)电化学性能 材料的低温电化学性能对负极的实际应用也至关重要。在0℃以下,Li+在电解液和电极中的扩散速度缓慢,严重影响电极材料在低温时的电化学性能。目前已有用离子掺杂改善LZTO材料的低温性能[29],而包覆改性材料的低温性能研究较少。因此,对室温下放电比容量最佳的LZTO@C-N-2样品进行了低温测试,结果见图10。
由图10(a)可知,在循环40次、电流密度为1.0 A/g时LZTO@C-N-2样品的放电比容量为178.3 mA·h/g,而P-LZTO的放电比容量只有141.9 mA·h/g;当循环70次、电流密度为0.4 A/g时,LZTO@C-N-2样品的放电比容量为202.3 mA·h/g,并且放电比容量保持稳定,比P-LZTO样品在相同条件下的比容量高出42.8 mA·h/g。由图10(b)可知,LZTO@C-N-2样品在0.2 A/g电流密度下的首次放电比容量为262.5 mA·h/g,循环300次后比容量为241.7 mA·h/g,容量保持率为104.13%(相对于第二次放电比容量);当电流密度为1.0 A/g时,经过300次循环后放电比容量为147.4 mA·h/g。可见,在低温下,LZTO@C-N-2具有优异的循环性能。
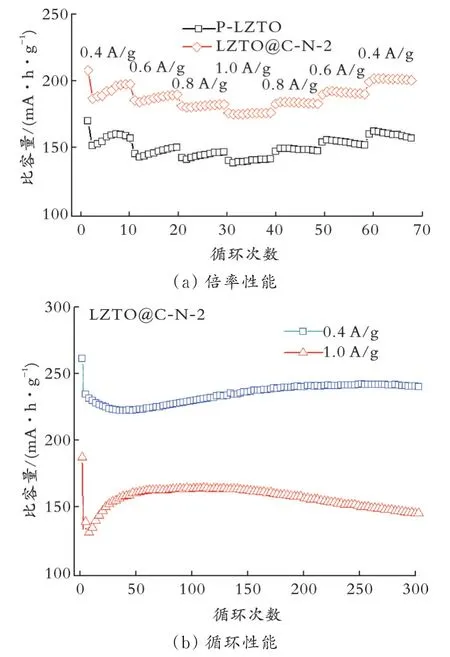
图10 P-LZTO和LZTO@C-N-2样品0℃性能曲线Fig.10 Performance curves of P-LZTO and LZTO@C-N-2 samples at 0℃
3 结 论
本实验结果表明,N掺杂C包覆和Ti3+自掺杂共同改性有利于提高材料的锂离子扩散系数和降低电荷转移电阻,从而提高LZTO负极材料在室温下的比容量,在电流密度为3.0 A/g时的放电比容量超过180.0 mA·h/g;LZTO@C-N-2样品在低温下也具有较高的比容量。说明这种包覆和Ti3+自掺杂同时存在的改性方式具有可行性,为后续的LZTO负极材料的研究提供了新思路。
但是,由于制备过程中生成了Li Zn N杂质,使材料循环稳定性恶化。在后续的研究中,将使用N2和其他N、C源来避免生成杂质,以期在提高放电比容量的基础上同时改善材料的倍率和循环性能。

