电针太冲穴及曲池穴拮抗应激性高血压前期大鼠胸主动脉外膜重构的机制研究
谢晓佳, 曹 锐, 刘清国, 黄 粤, 朱宏勋, 赵世同, 赵静怡
(1. 首都医科大学附属北京朝阳医院 中医科, 北京, 100020;2. 北京中医药大学针灸推拿学院, 北京, 100105)
随着现代社会生活节奏的加快,全球应激性高血压发病率逐年攀升,为将高血压防治阵线前移,美国预防、检测、评估与治疗高血压全国联合委员会第七次报告(JNC 7)提出了“高血压前期(收缩压120~139 mmHg, 舒张压80~89 mmHg)”的概念[1]。研究[2]表明,高血压前期发病呈年轻化的趋势,并且已经出现了心、脑、肾等靶器官的损害,而血管重构(VR)是导致靶器官损伤的病理基础,若能在前期阶段进行有效的干预,则能较大程度上逆转靶器官损伤进程。近年来研究[3]表明,血管外膜是血管病变的始动者,其病变顺序应该是“由外向内”。目前,血管外膜已成为治疗血管病变的新方向,“外膜炎症”是动脉硬化(AS)的始动环节,在AS发生早期即被激活,产生白细胞介素-6(IL-6)等炎性因子,并可促使血管外膜成纤维细胞(AF)被激活,刺激细胞外基质(ECM)合成增多,进而导致AS[4]。
转化生长因子β1(TGF-β1)可参与调节AF增殖、转化、迁移和ECM产生,是公认的影响AF最直接、最重要的细胞因子。Smads是TGF-β1信号通路下游的关键调节因子,可将其信号由膜外转至核内[5]。TGF-β1可通过Smads通路促进AF转化为肌成纤维细胞(MF)与ECM沉积,最终导致AS[6]。高血压前期属于中医治未病的典型,在这一阶段即运用针刺治疗方法具有独特的优势。本研究在针刺治未病理论的指导下,观察电针太冲、曲池穴对应激性高血压前期大鼠(SIPR)血压、血管外膜病理形态的影响,探讨电针降压及保护靶器官的具体机制,现报告如下。
1 材料与方法
1.1 实验动物与分组
将30只由北京维通利华公司提供的无特定病原体(SPF)级雄性Wistar大鼠饲养于北京呼吸疾病研究所动物房,大鼠体质量(220±30) g, 室温(20±1)℃,相对湿度50%,通风良好,定期紫外线消毒,清扫粪便,更换垫料。将30只大鼠随机分为模型组、电针组、空白组,每组10只。
1.2 造模方法
运用足底电击结合噪声刺激造模。采用MG-2型迷宫刺激器(上海继德教学实验器械厂)制备SIPR模型。模型组、电针组大鼠在每天上午、下午同一时间各接受1次持续2 h的电击足底结合噪声应激刺激。应激时将大鼠放入由细铜栅组成的90 cm×90 cm×50 cm的笼子底部,通过铜栅间断给予大鼠足底电脉冲电刺激(脉冲电压为40~80 V, 每2~25 s随机发生1次,每次持续50 ms), 迷宫刺激器上方的蜂鸣器同时发出噪声刺激,强度为80~100 db, 持续50 ms, 造模周期为14 d。
1.3 干预方式
将各组大鼠固定在特制鼠套中,露出四肢、尾部,固定20 min。选穴参照《实验针灸学》: 双侧太冲穴(后肢足背1、2趾骨凹陷处),直刺1 mm; 双侧曲池穴(肘关节外侧前方凹陷中),直刺4 mm。选用针具为中研太和牌一次性毫针(规格0.16 mm×7 mm), 电针组进针后连接LH202H型韩式电针仪,阳极接太冲,阴极接曲池穴,电流刺激强度为1 mA, 频率2 Hz, 留针20 min。电针组大鼠从接受造模的第1天起接受针刺干预,直到第14天造模结束,所有操作均由同一人于每天下午固定时间进行。
1.4 血压测定
在复合应激刺激开始的前l d以及复合应激刺激开始的第3、5、7、9、11、13、15天下午刺激结束后2 h以及电针治疗14 d结束后,分别用智能无创血压仪(BP-98A,德国制造)测量各组大鼠尾动脉的收缩压(连测3次,取均值),数值波动范围不超过±10 mmHg为宜。
1.5 动物取材
采用20%氨基甲酸乙酯腹腔注射进行全身麻醉,剂量为每100 g 1 mL, 将大鼠固定于手术架上,开胸腔,剪取胸主动脉0.5 cm, 立即置于冰上操作,剔除结缔组织,采用生理盐水清洗,置于-80 ℃冰箱中保存备用。
1.6 苏木素-伊红染色(HE染色)观察组织形态改变
取1.5步骤中的大鼠胸主动脉组织约1 cm, 置于4%多聚甲醛中固定后脱水,石蜡包埋切片,经二甲苯脱蜡乙醇水化, HE染色,梯度乙醇脱水,二甲苯透化,中性树胶封片固定,光镜下观察。
1.7 Masson染色观察组织胶原纤维改变
取1.6步骤中的切片,将切片脱蜡至水,苏木素染色,丽春红浸染,磷钼酸分化,苯胺蓝染色,1%冰醋酸分化,中性树胶固封,镜下观察。
1.8 逆转录-聚合酶链反应(RT-PCR)测定各组
大鼠主动脉组织TGF-β1、IL-6、Smad3、白细胞介素-10(IL-10)的mRNA表达
取1.5步骤中的大鼠胸主动脉组织约10 mg, 按照Trizol试剂(美国 GBCO公司)说明书提取主动脉组织总RNA, 采用核酸蛋白分析仪检测其浓度和纯度,取总RNA, 参照RT-PCR试剂盒(日本 Toyobo)说明书进行逆转录反应,取2 μL的逆转录产物,以TaqDAN 聚合酶进行PCR扩增反应,以β-action为内参,计算各样本TGF-β1、IL-6、Smad3、IL-10的mRNA条带光密度值与β-actionmRNA条带的比值。
1.9 Western blot法检测各组大鼠主动脉中
Smad7、α-平滑肌激动蛋白(α-SMA)、Ⅰ型和Ⅲ型胶原的蛋白表达水平
取1.5步骤中的大鼠胸主动脉组织约30 mg, 加入300 μL 蛋白裂解液中研磨,提取胸主动脉组织总蛋白,采用BCA定量法测定总蛋白浓度,按照试剂盒说明书制备分离胶与浓缩胶; 电泳结束后,转印至PVDF膜上,室温封闭60 min, 加入一抗Ⅰ型胶原 (1∶1 000)、Ⅲ型胶原 (1∶1 000)、Smad7 (1∶800)、α-SMA (1∶1 000) 4 ℃孵育过夜,室温下用TBST清洗膜3次,添加二抗 (1∶10 000), 室温孵育60 min, TBST洗膜,化学发光法进行曝光拍照保存,以β-actin蛋白为内参,采用Image J软件分析Smad7、α-SMA、Ⅰ型和Ⅲ型胶原条带的灰度值。
1.10 统计学方法
2 结 果
2.1 各组大鼠收缩压变化
3组大鼠针刺治疗前的收缩压比较,差异无统计学意义(P>0.05)。第3天时,与空白组比较,模型组大鼠收缩压升高到120 mmHg, 第14天时收缩压持续升高并始终保持在高血压前期状态(120~139 mmHg), 提示造模成功。与模型组比较,电针组第5、7、9、11、13、15天时收缩压下降,差异有统计学意义(P<0.05或P<0.01)。见表1。

mmHg
2.2 各组大鼠胸主动脉外膜HE染色的病理变化
空白组胸主动脉管壁无增厚,血管内膜均匀光滑,外膜厚度均一,外膜与中膜分界明显; 模型组胸主动脉管壁增厚,外膜厚度明显增加,细胞增生活跃,排列紊乱,有较多炎性细胞附着,有的出现剥脱甚至断裂,血管内皮欠光滑,不均匀,内膜上有少量炎症细胞附着,外膜与中膜分界不清晰; 电针组胸主动脉内膜较为光滑均匀,中层平滑肌细胞排列较规整,炎性细胞浸润减少,较空白组虽有外膜厚度增加、细胞轻度增生、排列欠整齐,但外膜与中膜分界较清晰,较模型组有明显改善。见图1(蓝色箭头处为增厚的血管外膜)。
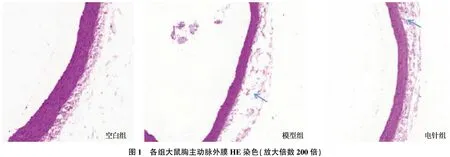
图1 各组大鼠胸主动脉外膜HE染色(放大倍数200倍)
2.3 各组大鼠胸主动脉Masson染色的病理变化
空白组胸主动脉细胞排列整齐,血管内膜、中膜、外膜细胞间质散在有少量蓝色胶原纤维; 模型组胸主动脉细胞排列紊乱,血管内膜、中膜、外膜均可见大量蓝色胶原蛋白沉积,以外膜较为明显; 电针组胶原沉积程度减轻。见图2(黑色箭头处为胶原蛋白沉积)。
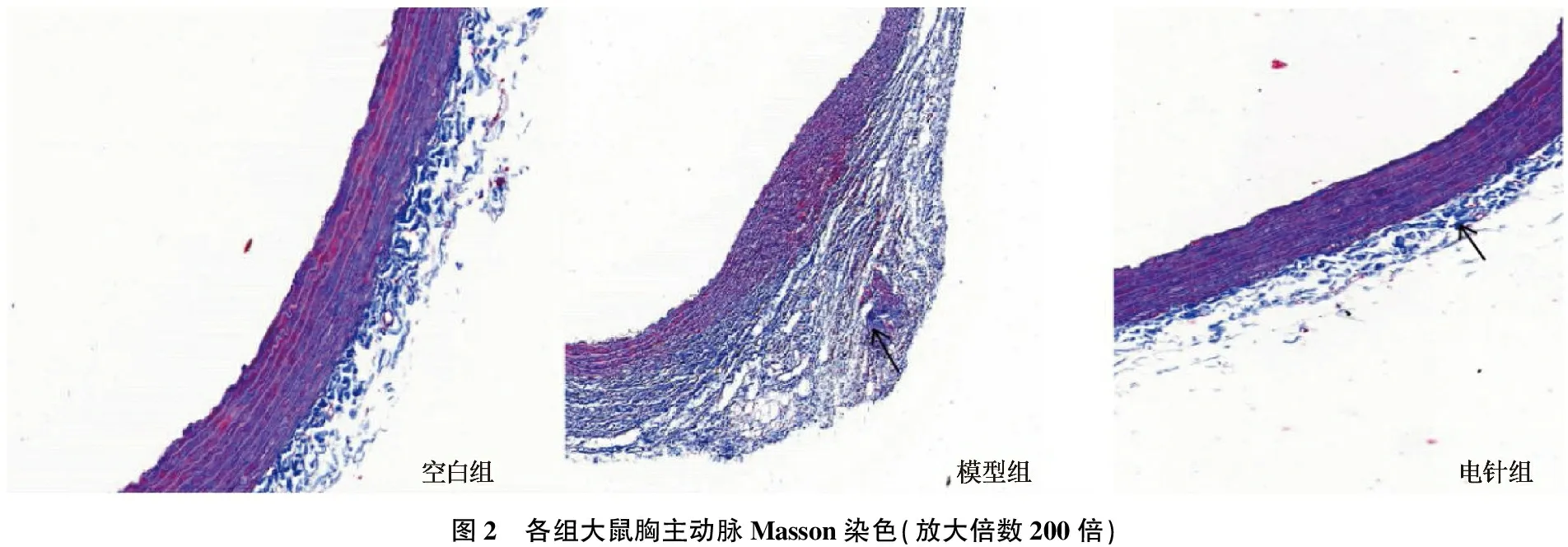
图2 各组大鼠胸主动脉Masson染色(放大倍数200倍)
2.4 各组大鼠胸主动脉组织TGF-β1、IL-6、Smad3、IL-10的mRNA表达
与空白组比较,模型组大鼠TGF-β1、Smad3、IL-6、IL-10的mRNA表达量均增加,差异有统计学意义(P<0.05或P<0.01); 与模型组比较,电针组大鼠TGF-β1、Smad3、IL-6的mRNA表达量均降低,IL-10mRNA增高,差异有统计学意义(P<0.05或P<0.01)。见表2。

表2 各组大鼠胸主动脉组织TGF-β1、IL-6、Smad3、IL-10的mRNA表达
2.5 各组大鼠胸主动脉组织Smad7、α-SMA、Ⅰ型及Ⅲ型胶原蛋白表达
与空白组比较,模型组大鼠Ⅰ型、Ⅲ型胶原蛋白以及α-SMA蛋白表达均增加, Smad7蛋白表达下降,差异有统计学意义(P<0.05或P<0.01); 与模型组比较,电针组Ⅰ型、Ⅲ型胶原蛋白、α-SMA蛋白表达降低, Smad7蛋白表达升高,差异有统计学意义(P<0.05或P<0.01)。见表3、图3。

表3 各组大鼠胸主动脉Smad7、α-SMA、Ⅰ型和Ⅲ型胶原的蛋白表达
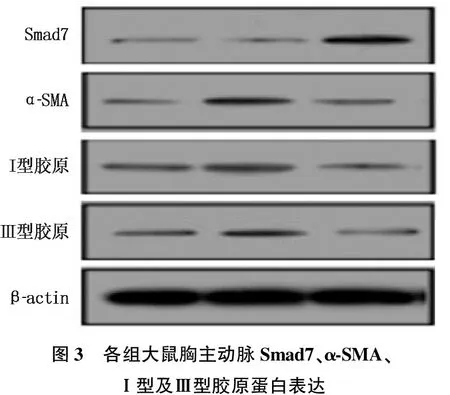
图3 各组大鼠胸主动脉Smad7、α-SMA、Ⅰ型及Ⅲ型胶原蛋白表达
3 讨 论
高血压前期属于中医学“眩晕” “头痛”“肝风”等范畴[7-8], 属本虚标实之证,基本病机为气血失调、气血上逆,故应采取清泄降逆、调和气血为基础的治疗原则。太冲穴归于少气多血之足厥阴经,为其输穴,又是肝的原穴,故太冲穴具有较好的平冲降逆功效。阳明经气血丰富,曲池穴为手阳明经之合,且大肠又为六腑之一,以通降为顺,五行亦属金,专克肝木,故曲池穴偏于清热调气和血,两穴相配可标本兼顾发挥平肝潜阳、柔肝熄风、调气降逆之效,是临床治疗高血压病常用且较好的穴位配伍[9-11]。本研究发现电针对于SIPR具有明显的降压效果,且短期效果较好,同时电针组主动脉损害较轻,说明电针对于SIPR主动脉具有一定的保护作用[12-14]。本研究应用足底电击结合噪声刺激的复合造模方法[15-16]制备SIPR大鼠模型,发现模型组大鼠均出现易激怒、互相撕咬打架、睛红充血、毛色发黄变涩、食欲下降、粪便干结等外观和行为变化,为近似高血压中医辨证肝阳上亢型模型[17-18]。根据模型组HE染色、Masson染色结果显示,在高血压前期阶段即可出现血管损伤,且外膜损伤出现早于内膜,损伤程度重于内膜[19-20]。
针对AS的发病机制,既往研究[3]多集中在血管内膜方面,近年来发现AS的本质是血管壁炎症反应,而外膜炎症是引起AS的始动因素。作为血管外膜主要细胞成分的AF在生理条件下处于静息状态,当受到缺氧、炎症和细胞因子等因素刺激时,会被激活并表型转化为MF,MF增殖、迁移能力增强,并分泌TGF-β1、TNF-α、IL-6、基质金属蛋白酶等多种细胞因子和Ⅰ型、Ⅲ型胶原蛋白等ECM, 推动AS的发生发展[4]。血管外膜的早期活化增殖及炎症反应在AS中发挥了关键作用,血管外膜有可能成为治疗血管重构的新靶点。研究[21]表明SHR大鼠血管外膜AF上炎症介质表达上调,可进一步增强大鼠血管外膜AF的迁移能力和炎症级联反应,加快AS进程。IL-6是由血管外膜AF所产生,可以促进外膜AF的增殖和ECM中胶原的合成,导致AS[22]。IL-10是由单核巨噬细胞分泌的一种抗炎细胞因子,已被证明可以抑制AF的增殖和Ⅰ型、Ⅲ型胶原的表达[23]。本研究表明,电针能降低IL-6mRNA并升高IL-10mRNA水平,提示电针太冲、曲池穴可改善SIPR血管外膜重构,其机制可能与通过抑制IL-6mRNA和升高IL-10mRNA表达从而减轻血管外膜炎症反应有关。
AF是血管外膜的主要细胞成分,在生理条件下, AF处于静息状态。当受到炎症、缺氧和细胞因子的刺激时,其会被激活并转化为MF, 研究[24]表明AF的增殖与胶原纤维等ECM的增加是AS的重要机制,TGF-β1参与其中,并且是公认的影响AF生物功能最直接、最重要的细胞因子。TGF-β1可使AF表型发生改变而成为MF,其中α-SMA作为AF活化的主要标记物,亦是探讨血管老化的重要检测指标,可以用来衡量AS的程度[25]。目前TGF-β1的信号转导通路已基本阐明。近年来研究[5]表明, TGF-β1及其介导的Smads信号转导通路在血管外膜重构机制中发挥重要作用。TGF-β1可以招募其下游效应转录因子Smad2、Smad3、Smad4, 并将其磷酸化形成Smads复合物,能将信号从膜外转导至核内,上调与ECM合成相关的基因表达,导致胶原等沉积,并能促进AF向MF转化,最终导致血管外膜重构。Smad7是抑制性信号蛋白,是TGF-β信号通路关键负调控因子,能与Smad2、Smad3竞争性地结合TGF-β1受体并阻断其激活,进而抑制AS。本研究模型组大鼠胸主动脉TGF-β1mRNA和Smad3mRNA表达量均明显增加,而电针组均明显下降,且电针能有效抑制SIPR胸主动脉α-SMA以及Ⅰ型、Ⅲ型胶原蛋白表达,增加Smad7蛋白表达[26], 表明电针改善SIPR血管外膜重构机制可能与参与调控TGF-β1/Smads信号通路有关。
综上所述,电针太冲、曲池穴对SIPR的血管外膜重构有良好的改善作用,电针发挥作用机制可能与参与调控TGF-β1/Smads信号转导通路和抑制血管外膜炎症反应相关。

