田基黄水提物通过线粒体凋亡通路诱导肝癌细胞凋亡
李晶 庄群川 蔡少丽
(1福建卫生职业技术学院,福建 福州 350101;2福建中医药大学;3福建师范大学南方生物医学研究中心)
肝细胞癌(HCC)是肝癌中最常见的病理类型,在全球癌症发病率中居第5位,其死亡率居第3位〔1〕。中国每年新发HCC病例约占全球的55%〔2〕。随着肿瘤细胞生物学和分子生物学技术的应用推广,中药资源以其高效低毒的特点日益引起中西方学者的关注,通过分子生物学技术阐明中药抑制肿瘤的相关作用机制已成为当前的研究热点〔3,4〕。中药田基黄,味甘、性凉,具有清热利湿、散瘀消肿和解毒等功效。已有研究证实,田基黄具有抑菌、抗病毒、止血、调节免疫功能、抑制癌细胞生长等多种药理功效〔5〕。其注射液在临床上用于治疗急慢性肝炎、阑尾炎、伤寒、副伤寒等。目前国内外对田基黄的研究主要是在对其有效化学成分分析和保肝作用方面,而田基黄抗肿瘤的机制尚不明确。研究表明,田基黄能有效抑制人肝癌细胞HepG2增殖,推测其与促进肝癌细胞的凋亡有关〔5〕。导致凋亡的途径主要是外源性死亡受体途径和内源性线粒体途径。细胞内源性凋亡往往涉及线粒体理化性质的改变、线粒体膜上蛋白B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)的变化等。本研究通过观察田基黄水提物对肝癌细胞HepG2凋亡的影响探讨其可能的作用机制。
1 材料和方法
1.1材料 田基黄水煎提取物的制备:中药田基黄购自福建同春药业股份有限公司(产地:福建,批号:080817),经福建中医药大学药学院中药鉴定教研室鉴定为金丝桃属植物地耳草的干燥全草。田基黄粉碎后烘干称重,取500 g,水煎煮3次后合并过滤,60℃恒温下旋转蒸发浓缩,浓缩为含生药2 g/ml的水煎液,置4℃冰箱保存备用,待试验前稀释成所需浓度使用。细胞株:人肝癌细胞株HepG2,购自中国科学院上海生化所细胞库。
1.2试剂与仪器 试剂:杜尔贝科改良伊格尔培养基(DMEM)高糖培养液、胰蛋白酶、胎牛血清(FBS)、磷酸盐缓冲液(PBS,0.01 mol/L,pH7.2)等购自Hyclone公司;细胞早期凋亡检测试剂盒购自BD公司;Trizol和线粒体膜电位检测试剂盒购自Invitrogen公司;逆转录试剂盒购自Fermentas公司。仪器:ELX800酶标仪(BioTek公司);二氧化碳培养箱(德国 Heraeus);超纯水装置(MILLI-Q 公司);Ⅺ70荧光倒置相差显微镜(日本 OLYMPUS);流式细胞仪(BD公司);凝胶成像系统(Bio-Rad公司)。
1.3细胞培养及处理 首先将人肝癌细胞HepG2放置于含有10% FBS的DMEM高糖培养基中,37℃、5% CO2、饱和湿度的细胞培养箱中培养24 h后分为4组,其中,对照(A)组未加田基黄水提物处理;其余3组分别加入浓度0.5 mg/ml(B组)、1.0 mg/ml(C组)、2.0 mg/ml(D组)的田基黄水提物处理24 h。每组均取传代数少于20代的对数生长期细胞用于观察和检测。
1.4细胞形态学观察 分别取4组干预处理24 h后的人肝癌细胞HepG2,在倒置显微镜下观察细胞形态变化。
1.5使用流式细胞术检测细胞早期凋亡率 经不同浓度田基黄水煎提取物作用24 h后,收集人肝癌细胞HepG2,按照试剂盒说明书操作,用流式细胞仪检测细胞早期凋亡情况。膜联蛋白V/碘化丙啶(Annexin V/PI)双染法将细胞分为4种属性,其中Ⅰ象限(即左上,Annexin V-/PI+)为坏死细胞;Ⅱ象限(即右上,Annexin V+/PI+)为晚期凋亡细胞;Ⅲ象限(即左下,Annexin V-/PI-)为正常细胞;Ⅳ象限(即右下,Annexin V+/PI-)为早期凋亡细胞。
1.6使用流式细胞术检测线粒体膜电位的改变情况 同上所述,收集不同浓度药物干预细胞,按照线粒体膜电位检测试剂盒的说明书操作,用流式细胞仪检测细胞内线粒体上膜电位势能的变化。用荧光探针(JC)-1染色,流式细胞仪通过JC-1荧光强度检测细胞线粒体膜电位(ΔΨm)的变化。
1.7逆转录-聚合酶链反应(RT-PCR)检测线粒体上相关基因Bax和Bcl-2 mRNA表达 按Trizol说明书提取总RNA,所得RNA用核酸分析仪计量RNA浓度并定量,模板量均取1 μg,采用Fermentas公司逆转录酶进行逆转录后,PCR扩增线粒体上相关基因,以 GAPDH为内参,采用RT-PCR法检测不同浓度处理24 h后人肝癌细胞HepG2 Bax和Bcl-2的mRNA表达水平,PCR产物经凝胶电泳鉴定。
1.8统计学分析 采用SPSS11.5软件进行方差分析、t检验。
2 结 果
2.1各组人肝癌细胞HepG2形态 A组人肝癌细胞HepG2生长良好,胞质均匀,核仁大而清晰,可见多层致密生长现象,细胞梭形可贴壁。而B、C、D组经不同浓度田基黄水提物干预24 h后,随着药物浓度越高,可见细胞形态逐渐改变,细胞数量逐渐减少,细胞生长越缓慢,折光性越差。部分或全部细胞变圆,伸展不良,细胞脱落、悬浮、贴壁疏松或死亡,见图1。提示田基黄水提物对人肝癌细胞HepG2增殖有明显抑制作用,且随着浓度增加,抑制作用更明显。
2.2流式细胞仪Annexin V/PI双染色检测细胞早期凋亡率 流式细胞术检测发现不同剂量田基黄水提物干预肝癌细胞后,细胞膜内侧的磷脂酰丝氨酸(PS)外翻,提示早期细胞凋亡,与A组〔(3.09±0.28)%〕比较,B、C、D组人肝癌细胞HepG2凋亡率〔(10.05±1.52)%、(17.30±0.93)%、(39.80±2.55)%、(39.80±2.55)%〕明显升高(P<0.05),且随着田基黄水提物处理浓度的增加,人肝癌细胞HepG2凋亡率逐渐升高,且呈剂量依赖性。
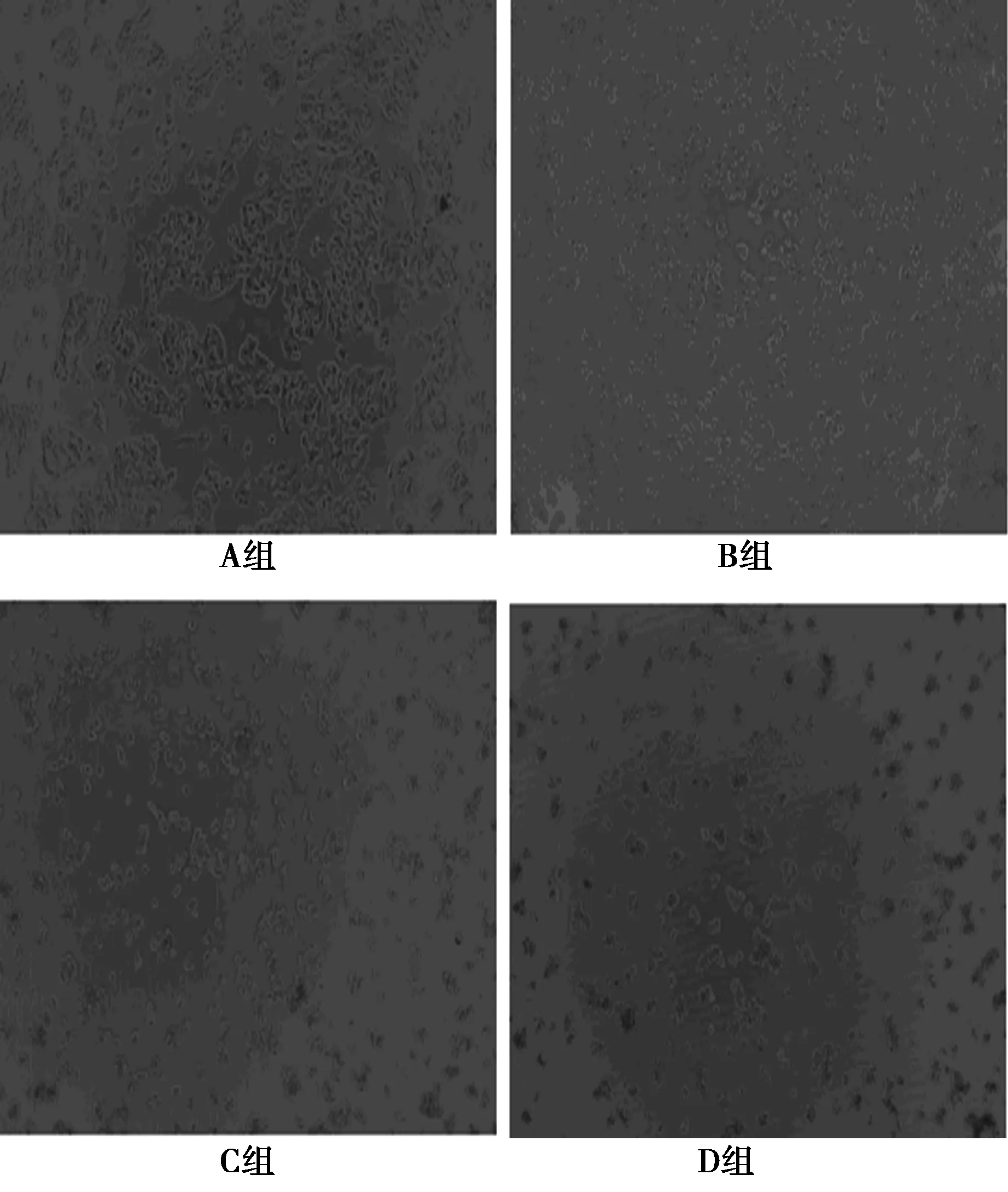
图1 各组人肝癌细胞HepG2形态(×100)
2.3流式细胞术检测线粒体膜电位的改变情况 与A组〔(4.5±0.6)%〕相比,B、C、D组膜电位改变率〔(31.0±1.8)%、(44.0±2.9)%、(52.0±3.3)%〕明显升高(P<0.05),提示人肝癌细胞HepG2 经不同浓度田基黄水提物作用后,红光强度均有减弱,且处理浓度越高,红光减弱程度越显著,说明线粒体膜电位下降越多。
2.4RT-PCR 检测线粒体上相关基因Bax和Bcl-2 mRNA水平变化 经过不同浓度田基黄水提物处理规定时间后,人肝癌细胞HepG2 Bax mRNA表达水平,与A组(568.4±12.9)相比,B、C、D组(856.3±10.8、2 523.9±18.2、4 236.6±12.3)明显上升(P<0.05),呈明显的剂量效应关系;人肝癌细胞HepG2 Bcl-2 mRNA表达水平,与A组(6 536.2±23.3)相比,B、C、D组(5 362.8±23.1、1 338.7±23.1、1 369.9±13.2)明显降低(P<0.05),呈明显的剂量效应关系。见图2。
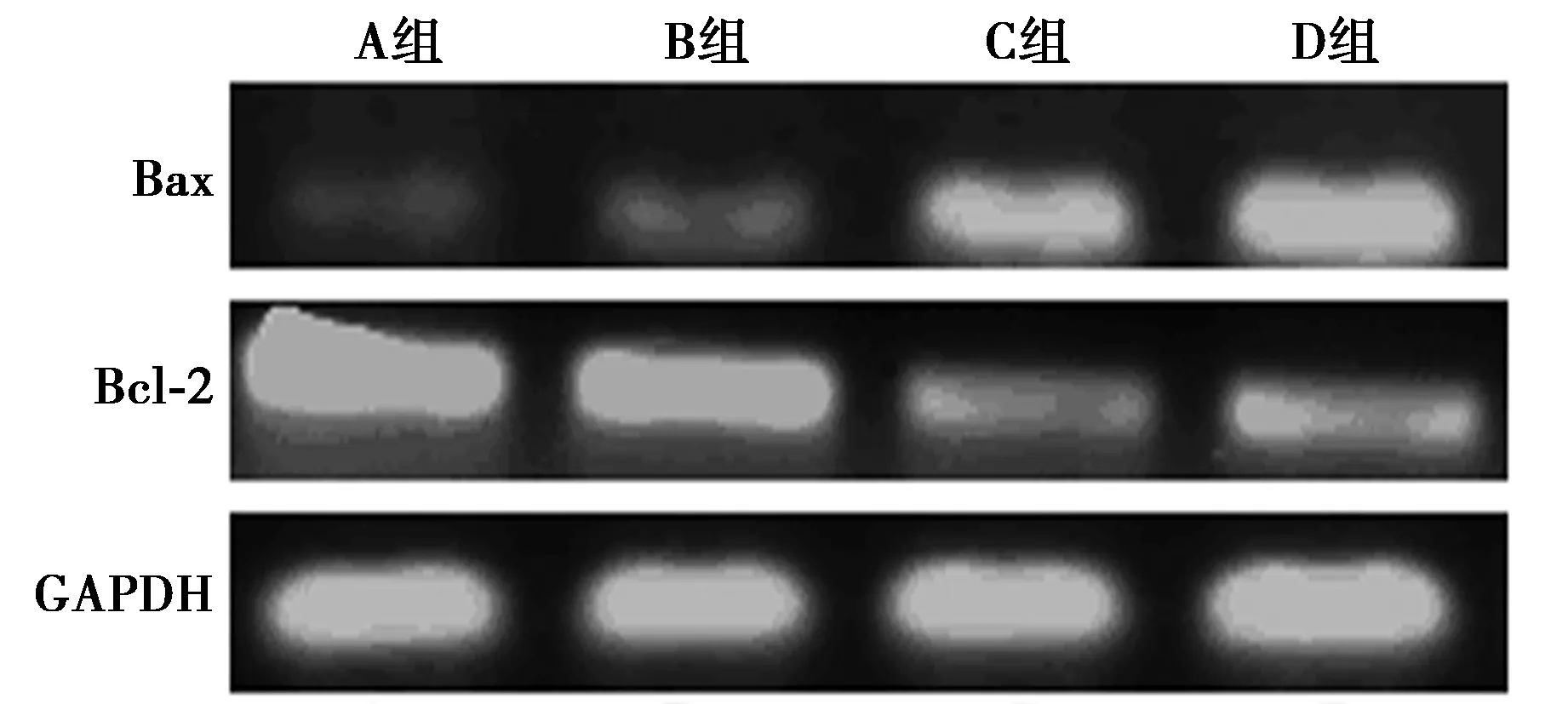
图2 各组人肝癌细胞HepG2 Bax和Bcl-2 mRNA表达
3 讨 论
细胞凋亡是由基因控制的机体细胞自发的程序性死亡过程。许多抗癌药物就是通过最终触发肿瘤细胞的凋亡通路从而抑制肿瘤生长〔6〕。本研究说明田基黄能够诱导HepG2细胞凋亡的发生。
已有研究表明线粒体与细胞凋亡关系密切,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转〔7,8〕。线粒体跨膜电位的破坏性下降发生在DNA 断裂等细胞核凋亡特征出现之前,被证实是细胞凋亡级联反应过程中最早发生的反应之一,故被称为细胞凋亡的“生死开关”。本研究表明田基黄可通过破坏线粒体跨膜电位从而诱导细胞凋亡的发生。线粒体凋亡通路的应力信号均集中于线粒体,并通过Bcl-2家族蛋白调控细胞凋亡〔9,10〕。家族成员中的Bcl-2为抗凋亡分子之一,而Bax则是促凋亡分子。如赵忠伟等〔11〕、Xu等〔12〕研究发现,上调线粒体凋亡通路中Bax表达,可促进HCC细胞凋亡,而抗凋亡分子Bcl-2上调可使 HCC 细胞拮抗线粒体通路介导的失巢凋亡,进而促进 HCC 发展〔13〕。本研究表明,田基黄可通过抑制Bcl-2 mRNA表达、促进Bax mRNA表达,诱导人肝癌细胞HepG2凋亡,发挥抑制肝癌细胞增殖作用。
综上,在田基黄的药物作用下,通过有效降低线粒体的膜电位,改变细胞膜的通透性,调控Bax和Bcl-2 mRNA表达,启动细胞凋亡级联反应〔14〕,诱导肝癌细胞凋亡,最终发挥抑制肝癌的功效〔15〕。

