miR-29a调控Wnt/β-catenin信号改善癫痫大鼠学习记忆能力并减少神经细胞凋亡的机制
吴琳 邱建维 黄灵芝
(浙江特殊教育职业学院,浙江 杭州 310023)
癫痫是病理生理学中极为常见的神经系统疾病,其发病原因复杂,部分癫痫患者不能有效控制,可发展为难治性典型,另外,癫痫的发作还能够诱导认知功能障碍、视物能力障碍及情绪障碍等一系列问题〔1〕。miRNA是一类具有广泛作用的非编码RNA,参与调控疾病、正常生理过程〔2〕。癫痫的发生与miRNA的异常表达具有密切关系,已有多种miRNA被证实可能参与癫痫进展〔3〕。有报道表明〔4,5〕,miR-29a在神经损伤中发挥保护作用。目前尚不清楚miR-29a在癫痫中的作用及机制。本研究旨在探讨miR-29a调控Wnt/β-catenin信号对癫痫大鼠学习记忆能力和神经细胞凋亡的作用机制。
1 材料与方法
1.1材料 SD大鼠,雌雄各半,6~8周龄,体重180~220 g,购自浙江省医学科学院,许可证号:SCXK(浙)2019-0002。原位末端标记(TUNEL)细胞凋亡检测试剂盒由碧云天生物技术研究所生产;兔抗c-Myc抗体由美国Cell Signaling Technology公司生产;丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒由北京索莱宝科技有限公司生产;兔抗β-catenin抗体由美国Santa Cruz Biotechnology公司生产;谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒由南京建成生物工程研究所有限公司生产;兔抗Bax抗体由美国GeneTex公司生产;miRNA cDNA第一链合成试剂盒、miRNA荧光定量检测试剂盒由赛尔瑞成(北京)生命科学技术有限公司生产;mimics control、miR-29a mimics由上海吉玛制药技术有限公司合成;兔抗B细胞淋巴瘤/白血病(Bcl)-2抗体由美国Abcam公司生产;硫酸阿托品、氯化锂、Wnt/β-catenin激活剂SB216763由上海阿拉丁生化科技股份有限公司生产;匹罗卡品(毛果芸香碱),规格:100mg,纯度≥98%,由北京沃凯生物科技有限公司生产。
1.2模型构建〔5〕大鼠经过适应性饲养后,按照氯化锂-匹罗卡品方法构建癫痫大鼠模型。步骤为:首先腹腔注射3 mmol/kg氯化锂,18 h后,继续腹腔注射1 mg/kg硫酸阿托品,30 min后,再次注射35 mg/kg匹罗卡品。然后按照Racine分级方法测定癫痫发作的级别,大鼠癫痫发作级别达到Ⅳ级后,视为造模成功。癫痫发作后,大鼠恢复状态良好时进行实验。Racine分级标准见文献〔5〕。
1.3实验分组处理 48只癫痫大鼠随机分成模型组、miR-NC组、miR-29a组、miR-29a+SB216763组,每组12只,选择12只正常大鼠作为对照组。miR-NC、miR-29a组分别在造模成功后大鼠状态良好时脑侧室注射10 μl mimics control(10 mg/kg)、miR-29a mimics(10 mg/kg)〔6〕,miR-29a+SB216763组在造模成功后在大鼠状态良好时脑侧室注射10 μl miR-29a mimics(10 mg/kg)和10 μl Wnt/β-catenin激活剂SB216763(0.1 g/μl)〔7〕,连续注射7 d。模型组和对照组大鼠注射等量的生理盐水。从第8天开始进行水迷宫训练,空间探索检测后,水合氯醛麻醉大鼠,取大鼠海马神经组织,用于实验指标检测。
1.4qRT-PCR方法检测miR-29a表达 取大鼠海马神经组织,添加Trizol试剂提取总RNA。以miRNA cDNA第一链合成试剂盒进行反转录,以miRNA荧光定量检测试剂盒对miR-29a表达进行半定量分析。内参设置为U6,计算方法为2-△△Ct法。引物序列〔8〕为miR-29a上游:TAGCACCATTTGAAATCAGTTT,下游:TGCGTGTCGTGGAGTC;U6上游:CTCGCTTCGGCAGCACATA,下游:GTGCAGGGTCCGAGGT。
1.5Western印迹检测β-catenin、c-Myc、Bcl-2相关X蛋白(Bax)、Bcl-2蛋白表达 取大鼠海马神经组织,按照每50 mg组织中添加100 μl的裂解液提取总蛋白。参照二喹啉甲酸(BCA)方法检测蛋白浓度,配制10%分离胶、5%浓缩胶,每个样品孔内添加30 μg蛋白,先以80 V电压电泳0.5 h,然后以100 V电压电泳2 h。100 V电压转膜80 min。聚偏氯乙烯(PVDF)膜置于5%脱脂奶粉内,室温、摇床孵育2 h。将PVDF膜放在稀释后的一抗、二抗内,在室温中结合2 h。β-catenin、Bax、Bcl-2一抗以1∶1 000稀释,c-Myc一抗以1∶800稀释。二抗以1∶2 000稀释。电化学发光(ECL)方法显色。以Image J分析条带的灰度值。GAPDH为参照,分析目的蛋白表达变化。
1.6水迷宫实验检测学习记忆能力 用Morris水迷宫实验检测大鼠学习记忆能力。圆形水池分成4个象限,分别为W、E、N、S,在每个象限选取一个固定的入水点。将白色平台固定于N象限中部位置,在水池中注水,水温为22℃,添加二氧化钛,充分搅拌,此时水池不透明。大鼠每天训练2次,训练4 d,大鼠头部面向池壁放入水中,当大鼠游到平台时,保持大鼠在平台上逗留30 s,如果120 s大鼠仍然没有找到平台,则由实验者将大鼠引导平台。第5天时,记录大鼠从入水到平台的时间,即逃避潜伏期。第6天时进行空间探索实验,将平台撤掉,记录大鼠在120 s内穿过平台位置的次数,记录大鼠在原平台所在象限停留时间。
1.7TUENL法检测细胞凋亡 取大鼠海马神经组织,经4%多聚甲醛固定后,用浓度梯度酒精脱水,二甲苯透明,浸蜡,包埋、切片,切片厚度为4 μm,在45℃的烘箱中烤干。二甲苯脱蜡,浓度梯度酒精水合,用0.1% Triton X-100通透,3%过氧化氢封闭,滴加TdT反应液,添加Streptavidin-HRP溶液,加上盖玻片,避光反应30 min。DAPI染色,封片,在激光共聚焦显微镜下观察细胞凋亡指数。凋亡指数=(凋亡数目÷细胞总数)×100%。
1.8SOD、MDA、GSH-Px检测 取大鼠海马神经组织,以SOD检测试剂盒(可见分光光度法)、MDA检测试剂盒(可见分光光度法)、GSH-Px检测试剂盒(比色法)测定SOD、MDA、GSH-Px含量,步骤完全根据试剂盒说明书操作。
1.9统计学分析 采用SPSS25.0软件行单因素方差分析。
2 结 果
2.1各组β-catenin、c-Myc、miR-29a表达比较 与对照组比较,模型组海马神经组织β-catenin、c-Myc蛋白表达量升高,miR-29a表达量降低,差异有统计学意义(P<0.05)。与miR-NC组比较,miR-29a组β-catenin、c-Myc蛋白表达量降低,miR-29a表达量升高,差异有统计学意义(P<0.05)。与miR-29a组比较,miR-29a+SB216763组β-catenin、c-Myc蛋白表达量显著升高(P<0.05)。 见图1,表1。
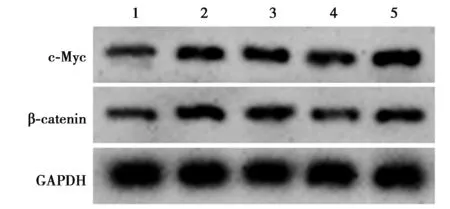
1~5:对照组、模型组、miR-NC组、miR-29a组、miR-29a+SB216763组;下图同图1 Western印迹方法检测大鼠海马神经组织中Wnt/β-catenin信号相关蛋白表达

表1 各组大鼠海马神经组织中β-catenin、c-Myc蛋白表达量和miR-29a表达量比较
2.2各组逃避潜伏期、穿越平台次数、平台家限停留时间比较 与对照组比较,模型组逃避潜伏期延长,穿越平台次数减少,平台象限停留时间缩短,差异有统计学意义(P<0.05)。与miR-NC组比较,miR-29a组逃避潜伏期缩短,穿越平台次数增多,平台象限停留时间延长,差异有统计学意义(P<0.05)。与miR-29a组比较,miR-29a+SB216763组逃避潜伏期延长,穿越平台次数减少,平台象限停留时间缩短,差异有统计学意义(P<0.05)。 见表2。

表2 各组逃避潜伏期、穿越平台次数、平台象限停留时间比较
2.3各组海马神经细胞凋亡指数比较 与对照组〔(10.12±1.25)%〕比较,模型组海马神经细胞凋亡指数〔(24.78±2.69)%〕显著升高(P<0.05);与miR-NC组〔(23.84±2.95)%〕比较,miR-29a组〔(15.02±1.64)%〕显著降低(P<0.05);与miR-29a组比较,miR-29a+SB216763组〔(20.17±1.53)%〕显著升高(P<0.05)。
2.4各组神经组织中Bax、Bcl-2蛋白表达比较 与对照组比较,模型组海马神经组织中Bax蛋白量升高,Bcl-2蛋白表达量降低,差异有统计学意义(P<0.05)。与miR-NC组比较,miR-29a组海马神经组织中Bax蛋白量降低,Bcl-2蛋白表达量升高,差异有统计学意义(P<0.05)。与miR-29a组比较,miR-29a+SB216763组海马神经组织中Bax蛋白量升高,Bcl-2蛋白表达量降低(P<0.05)。 见图2,表3。
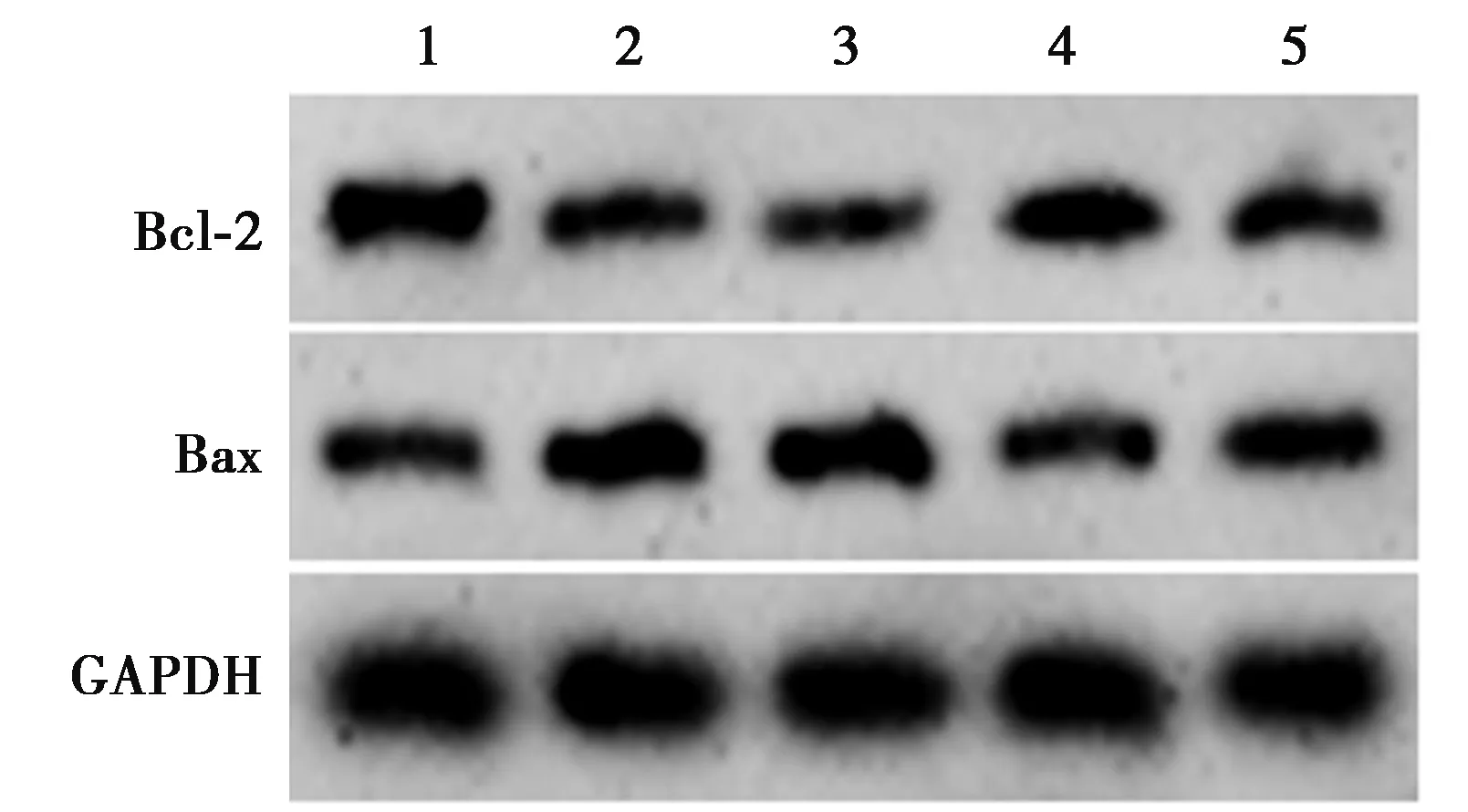
图2 Western印迹方法检测大鼠海马神经组织中Bax、Bcl-2蛋白表达

表3 各组大鼠海马神经组织中Bax、Bcl-2蛋白表达量比较
2.5各组海马神经组织中SOD、MDA、GSH-Px含量比较 与对照组比较,模型组海马神经组织中MDA含量升高,SOD、GSH-Px含量降低,差异有统计学意义(P<0.05)。与miR-NC组比较,miR-29a组海马神经组织MDA含量降低,SOD、GSH-Px含量升高,差异有统计学意义(P<0.05)。与miR-29a组比较,miR-29a+SB216763组海马神经组织MDA含量升高,SOD、GSH-Px含量降低,差异有统计学意义(P<0.05)。 见表4。

表4 各组海马神经组织中SOD、MDA、GSH-Px含量比较
3 讨 论
癫痫作为常见疾病,其发生机制十分复杂,包括神经细胞凋亡、氧化应激等〔9〕。很多癫痫患者表现为认知和学习记忆能力下降,与神经损伤密切相关〔10〕。癫痫病理条件下,神经组织中产生大量的氧自由基,这些氧自由基的积累与抗氧化酶SOD、GSH-Px活性降低有关,过量的氧自由基不仅可以诱导脂质发生过氧化,造成细胞损伤,还可以激活细胞凋亡途径,诱导细胞凋亡发生〔11,12〕。MDA是脂质发生过氧化后的产物,其含量升高标志细胞氧化应激水平增加〔13〕。Bax和Bcl-2均为Bcl-2蛋白家族成员,在细胞凋亡过程中发挥促进和抑制作用〔14〕。miRNA是近些年来分子生物学研究的热点领域,其在细胞分化、凋亡等过程中发挥作用,且还与很多疾病的发生有关〔15〕。miR-29a在神经损伤中发挥保护作用,miR-29a对缺氧诱导的新生鼠神经损伤有改善作用〔16〕,miR-29a还可促进神经细胞分化、延长轴突〔4〕。本研究结果说明miR-29a可促进癫痫大鼠学习记忆能力恢复,减少细胞凋亡和氧化应激,miR-29a在癫痫中发挥抑制功效。
本文还进一步研究了miR-29a的作用机制,发现过表达miR-29a能够降低癫痫大鼠海马神经组织中β-catenin、c-Myc蛋白表达量,miR-29a作用机制可能与Wnt/β-catenin信号有关。β-catenin是Wnt/β-catenin信号的关键蛋白,其表达增多后可诱导下游靶基因c-Myc的表达〔17〕。Wnt/β-catenin信号是经典的Wnt信号,其有多种生物学作用,与疾病的进展有关〔18〕。Wnt/β-catenin信号在癫痫中发挥促进作用,过度激活Wnt/β-catenin可增加癫痫发病风险〔19~21〕。本研究结果发现Wnt/β-catenin信号激活剂可部分逆转过表达miR-29a对癫痫大鼠学习记忆能力和神经细胞凋亡、氧化应激的作用,提示miR-29a能够通过调节Wnt/β-catenin信号影响癫痫大鼠学习记忆能力和神经细胞凋亡。
综上,miR-29a在癫痫中发挥抑制功效,其可通过抑制Wnt/β-catenin信号改善癫痫大鼠学习记忆能力,减少细胞凋亡,这为阐明癫痫分子发生机制奠定了基础。

