miR-210 介导CH25H 免疫信号通路调控骨关节炎软骨细胞增殖和凋亡新机制研究①
吴福顺 宋 瑶 张 雪 金京春 (延边大学附属医院免疫科,延边 133000)
骨关节炎(osteoarthritis,OA)是一种与年龄相关的退行性疾病,主要表现为软骨组织遭到破坏、滑膜炎症、骨赘形成等,同时伴有疼痛、短暂晨僵和骨擦音等临床症状,严重影响患者生活和工作[1]。目前研究表明骨关节形成由多因素导致,microRNAs(miRNAs)在多种疾病中均发挥重要生理调控作用,其在OA 发生发展过程中既有上调表达又有下调表达,最新一项研究已经证实miRNA-138-5p可促进软骨细胞增殖改善OA 炎症环境[2]。OA 同时由免疫信号调节失衡造成大量炎症因子分泌所导致[3]。miR-210已被证实有调控细胞增殖作用,但其是否通过调控免疫相关信号通路发挥抗炎促增殖作用鲜有报道。本研究旨在明确miR-210 对OA 软骨细胞增殖和凋亡调控的新机制。
1 材料与方法
1.1 材料 12 只10 周龄SD 雄性大鼠购自延边大学实验动物中心;0.25%胰酶(03-052-1A/B)购自Biological 公司;0.2%Ⅱ型胶原酶混合液(BJ-X0541)购自邦景公司;胎牛血清(F8318)、DMEM(D6429)购自Sigma公司;Weigert染液(JA1021)、番红O染液(JA1987)购自佳维斯公司;IL-6(ab233706)、MMP-3(ab285407)、CH25H(ab214295)、山 羊 抗 兔IgG(ab150077)、DAB(ab64238)购自Abcam 公司;TRIzol(15596026)、氯仿(10296028)购自Thermo公司。
1.2 方法
1.2.1 动物分组 12 只SD 大鼠随机分为sham 组和OA 组,每组6 只。所有大鼠均饲养于23 ℃、相对湿度55%、噪音85 分贝以下环境中,每12 h 通风换气1 次。每天加水2 次,每天更换1 次垫料,室内光线阴暗。所有大鼠均按照延边大学动物伦理委员会要求规范饲养和操作。
1.2.2 Hulth 法构建OA 大鼠模型 3%戊巴比妥(30 mg/kg)麻醉大鼠,后肢膝关节处采用Hulth 法造模[4]。具体步骤:OA组大鼠后肢两侧切开2 cm左右切口,剥离并切断交叉韧带和内侧副韧带,剥离整个半月板,不损伤膝关节软骨面,随后缝合消毒。sham 组大鼠仅进行皮肤切开术后立即缝合。术后均注射青霉素抗感染,连续注射3 d,分笼单独饲养。
1.2.3 分离原代软骨细胞 取大鼠后肢膝关节消毒,超净台内剪碎膝关节软骨,采用含0.25%胰酶和0.2%Ⅱ型胶原酶混合液玻璃皿内消化4 h。无菌滤网过滤,4 ℃、1 000 r/min 离心5 min,采用含10%胎牛血清的DMEM 培养液重悬,细胞培养箱内培养,观察细胞生长状态。
1.2.4 HE染色 取SD大鼠后肢关节脱钙处理,石蜡包埋,切片,脱蜡,苏木素染色10 min,0.7%盐酸乙醇分化5 s;去离子水洗片、氨水处理后水洗,伊红染色5 min,水洗,乙醇、二甲苯处理,烘干树脂封片。
1.2.5 番红O-固绿染色 取SD 大鼠后肢关节脱钙处理,石蜡包埋,切片后脱蜡。Weigert 染液染色5 min,酸性乙醇分化液分化15 s,洗片后固绿染液染色5 min,洗片,番红O染液染色2 min,洗片、乙醇脱水,二甲苯透明,树脂封片。
1.2.6 免疫荧光 将软骨细胞铺至含0.1%胶原涂层的玻璃盖玻片,待细胞密度达60%左右采用预冷的甲醇和丙酮混合液(1∶1)进行固定,1%TritonX-100/PBS 中透化,洗片擦干后加入IL-6 和MMP-3(1∶1 000)抗体4 ℃孵育过夜。次日4%多聚甲醛固定4 h,含15%蔗糖的PBS孵育4 h,去离子水清洗玻片,激光共聚焦扫描分析切片。
1.2.7 CCK-8检测细胞增殖 细胞按5 000个/孔接种至96孔板,设3个复孔。sh-miR-210、NC-miR-210、mimics-miR-210 Lipofectamine3000 转染软骨细胞成功后,分别在0 h、12 h、24 h、36 h 和48 h 时20µl/孔加入CCK-8反应液37 ℃孵育2 h,酶标仪测定450 nm处吸光度。
1.2.8 流式细胞术 按照1.2.7转染细胞。软骨细胞接种至6 孔板,细胞密度生长至60%左右收集细胞,加入5µl Annexin V-FITC 避光孵育10 min,再加入10µl碘化丙啶染液避光孵育15 min,流式细胞仪分析。
1.2.9 免疫组化 关节脱钙处理,石蜡切片脱蜡至水,修复抗原,阻断内源性过氧化物酶,血清封闭,加入CH25H一抗、二抗,DAB显色,细胞核复染,脱水,切片扫描仪扫描分析。
1.2.10 RT-PCR 采用TRIzol和氯仿用提取RNA,RNA 逆转录试剂盒将RNA 逆转录为性质稳定的cDNA,qRT-PCR仪检测目的基因相对表达,以β-actin为内参。反应条件:95 ℃预变性10 min,95 ℃退化10 s,60 ℃退火20 s,72 ℃延伸35 s。2-ΔΔCt法计算目的基因相对表达。引物序列见表1。

表1 PCR引物序列Tab.1 PCR primer sequences
1.2.11 Western blot 调整细胞密度为5×104个/ml,细胞汇合度达70%时收集细胞,冰上裂解30 min,4 ℃、8 000 g 离心吸取上清,提取总蛋白,蛋白定量后计算,加入上样缓冲液,100 ℃煮5 min,SDS-PACE凝胶电泳,电泳结束后将目的蛋白转至PVDF 膜,脱脂牛奶封闭,加入IL-6、MMP-13 和CH25H 一抗孵育过夜,次日加入二抗孵育,PBS 清洗,ECL 发光仪发光拍照。
1.3 统计学分析 数据应用SPSS20.0软件进计分析,计量资料以±s表示,组间比较采用t检验,多组间比较采用F检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-210 在OA 体内外模型中表达下调 HE染色结果显示,与sham 组相比,OA 组大鼠软骨细胞显著肥大且排列无序(图1A);番红O-固绿染色结果显示,OA 组大鼠软骨组织出现明显骨侵蚀(图1A)。免疫荧光鉴定软骨细胞标志物Ⅱ型胶原表达,结果显示,软骨细胞胞浆和胞膜处分布Ⅱ型胶原(P<0.05,图1B)。RT-PCR 结果显示,OA 组大鼠软骨组织和IL-1β 的刺激软骨细胞内miR-210 表达均显著降低(P<0.05,图1C、D)。体内外实验结果均提示miR-210与OA密切相关。

图1 大鼠软骨组织染色及miR-210表达Fig.1 Staining of cartilage and miR-210 expression of rats
2.2 miR-210 促进软骨细胞增殖 sh-miR-210、NC-miR-210 和mimics-miR-210 分别转染软骨细胞,RT-PCR 结果显示,sh-miR-210 显著降低软骨细胞miR-210 表达,mimics-miR-210 显著增加软骨细胞miR-210 表达(P<0.05,图2A);CCK-8 结果显示,软骨细胞增殖能力随着miR-210 表达沉默而降低,随着miR-210 过表达而增强(P<0.05,图2B);细胞凋亡趋势则与之相反(P<0.05,图2C)。
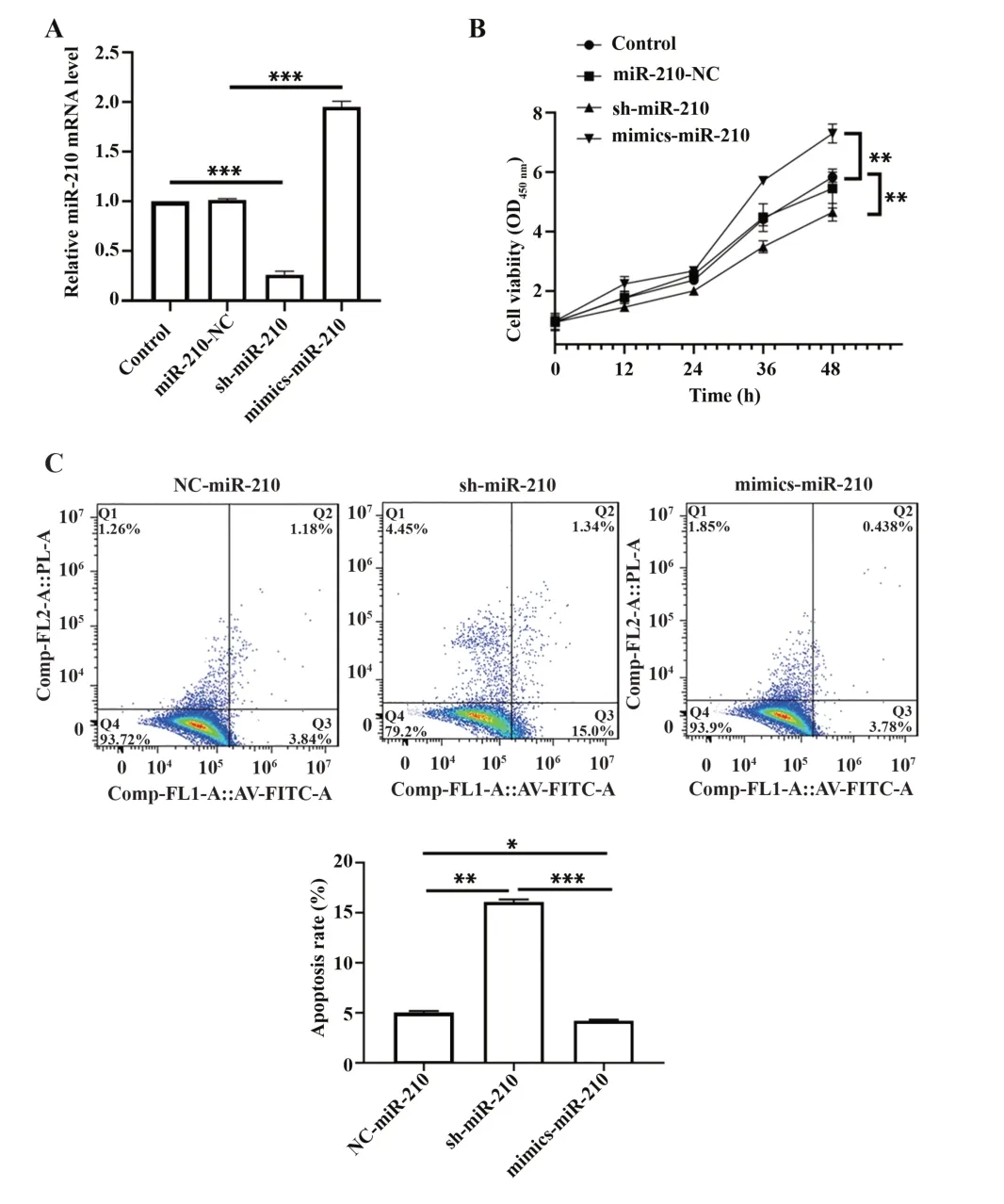
图2 miR-210对大鼠软骨细胞增殖的影响Fig.2 Effects of miR-210 on proliferation of chondrosto⁃cytes of rats
2.3 miR-210 抑制免疫细胞因子IL-6 和MMP-13 表达 免疫荧光结果显示,IL-6 和MMP-13 在IL-1β 刺激的软骨细胞内表达均显著增加,mimics-miR-210转染后可抑制软骨细胞IL-6 和MMP-13 表达,sh-miR-210 显著增加IL-6 和MMP-13 表达(P<0.05,图3A、B);RT-PCR 和Western blot 结果提示IL-6 和MMP-13 在OA 模型组软骨组织中显著增高(P<0.05,图3C、D)。提示miR-210 通过抑制细胞因子IL-6和MMP-13表达对OA软骨细胞发挥保护作用。
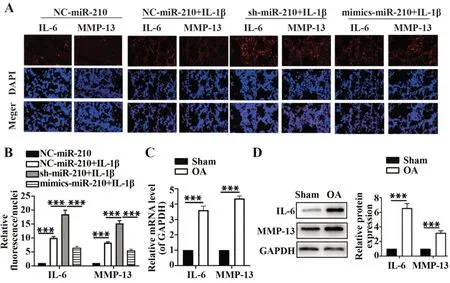
图3 miR-210对大鼠软骨细胞IL-6和MMP-13表达的影响Fig.3 Effects of miR-210 on IL-6 and MMP-13 expressions in chondrocyte of rats
2.4 miR-210 抑制软骨细胞CH25H 表达 CH25H可导致代谢紊乱参与OA 发生,Western blot 证实CH25H 在IL-1β 刺激的软骨细胞内表达显著增高(P<0.05,图4A);Western blot(图4A、B)和RT-PCR(图4C)结果显示,CH25H 表达随着miR-210 沉默而增加,随着miR-210 过表达而降低(P<0.05)。提示CH25H在OA发生过程中受miR-210调控。

图4 miR-210对大鼠软骨细胞CH25H蛋白表达的影响Fig.4 Effects of miR-210 on CH25H protein expression in chondrocyte of rats
2.5 CH25H 部分抵消miR-210 对软骨细胞的促增殖作用 为探索CH25H作用于miR-210的位置,采用IL-1β 刺激软骨细胞,随后共同转染mimics-miR-210和CH25H 过表达质粒,结果发现miR-210 对软骨细胞的促增殖作用被部分抵消(P<0.05,图5A);共同转染sh-miR-210和shRNA-CH25H质粒后,sh-miR-210抑制细胞增殖的作用可被shRNA-CH25H 部分恢复(P<0.05,图5B)。

图5 CH25H 可部分抵消miR-210 对大鼠软骨细胞增殖能力的影响Fig.5 CH25H partially counteracts effect of miR-210 on proliferation capacity of chondrocytes of rats
3 讨论
软骨细胞是软骨组织中维持关节软骨稳态的重要因素,研究证实软骨细胞大量凋亡和免疫因子异常表达是OA 发生的重要因素[5]。OA 是老年人常见的一类骨科疾病,同时好发于运动员等运动量大导致关节损伤的人群[6]。研究报道mRNA 在多种细胞调控过程中发挥重要作用,同时参与OA 发生发展,但其具体调控机制尚不明确[7]。mRNA 通过调控细胞增殖分化和凋亡等作用参与多种疾病发生发展,是治疗多种疾病的热门候选靶点[8]。大量研究证实,多种mRNA参与OA发生过程,如miR-31-5p在OA 患者外周血中表达显著增高,体外实验表明miR-31-5p 对软骨细胞增殖和分化起负调控作用,说明miR-31-5p 可促进OA 发生[9]。此外,miR-495通过抑制PI3K/AKT 信号通路促进软骨细胞凋亡和老化而发挥促OA 发生作用,同时miR-27a 在OA 中的表达与上述mRNA 相反,呈下降趋势,体外实验证实增加miR-27a 表达可促进软骨细胞增殖,抑制其凋亡[10-12]。提示mRNA 在OA 发生发展过程中发挥重要作用。
本研究发现miR-210 在OA 大鼠关节软骨组织和IL-1β 诱导的体外软骨细胞中表达均显著降低。miR-210 已被证实对多种细胞起促增殖作用,但其对软骨细胞增殖的影响如何尚不清楚。本研究通过增殖活力实验和流式检测观察转染sh-miR-210、mimics-miR-210 对软骨细胞增殖和凋亡能力的影响,发现软骨细胞增殖能力随着miR-210 表达沉默而降低,随着miR-210过表达而增强。IL-6和MMP-13是促进OA 发生的免疫细胞因子,在OA 中大量分泌和表达[13]。本研究发现,miR-210 能够显著降低OA标志细胞因子IL-6和MMP-13表达,证实miR-210参与OA 发生并发挥负调控作用,但并未明确其具体作用方式。进一步查阅文献发现,CH25H 是参与OA 发生的经典免疫因子,可通过影响CH25HCYP7B1-RORα信号轴调控OA代谢,诱发OA[14]。
CH25H 是一类重要免疫调控因子,在多种疾病中异常表达可导致患者机体代谢紊乱,为疾病发生提供有利条件[15]。在风湿性关节炎中,CH25H 促进重要免疫因子IL-1β/TNF-α/IL-6 表达,导致患者代谢紊乱,促进风湿性关节炎发生发展[16]。免疫因素对OA 同样重要。本研究显示,miR-210 显著抑制CH25H在体外软骨细胞中表达,同时过表达CH25H可部分抵消miR-210 对软骨细胞的促增殖作用,说明二者相互作用,但具体机制尚不清楚,将是下一步研究重点。
综上所述,本研究明确miR-210在OA 体内模型中表达显著下调,可能通过促进软骨细胞增殖对OA 发生起促进作用,进一步发现miR-210 可能通过抑制免疫因子CH25H 发挥促软骨细胞增殖作用。以上结果初步探讨了miR-210 在OA 发生中起重要作用,为下一步研究奠定基础,同时为OA 发病机制提供了新的理论依据。

