TAMs、PRL⁃3和C⁃erbB⁃2与乳腺癌淋巴结转移及预后的相关性
王丽娟 林晓茹 陈云婷 陈露文
乳腺癌的早期诊断及治疗对患者预后有积极影响,了解影响患者预后的危险因素,采取针对性预防措施也是降低患者预后不良的重要手段。以往研究显示,肿瘤微环境的改变与乳腺癌的发生有密切的联系[1]。肿瘤相关巨噬细胞(Tumor⁃asso⁃ciated macrophages,TAMs)占间质细胞的50%以上,是肿瘤微环境中的重要成份,众多研究表明TAMs 与多种恶性肿瘤发生、发展、预后关系密切,多种肿瘤中均存在TAMs 浸润[2]。研究表明,肝再生磷酸酶(Regenerative Phosphatase⁃3 ,PRL⁃3)与肿瘤转移之间存在联系,在胃癌、直肠癌等多种恶性肿瘤中均为高表达,可促进肿瘤细胞增殖、黏附及迁移[3]。人类表皮生长因子受体2(Human epi⁃dermal growth factor receptor 2,C⁃erbB⁃2)属于原癌基因,是目前公认的重要肿瘤标志物[4]。本文将通过分析TAMs、PRL⁃3 及C⁃erbB⁃2 在乳腺癌中的表达情况,了解其与患者转移、预后的关系,以期为临床对乳腺癌转移、预后评估提供新方向。
1 资料与方法
1.1 一般资料
收集2017年5月至2020年5月海南省三亚市妇女儿童医院收治的115 例乳腺癌患者术后病理组织作为观察组,均为女性,平均年龄(48.33±5.16)岁。淋巴结转移者46 例,未转移者69 例。纳入标准:①经术后病理检查及影像学检查诊断为乳腺癌,且符合《2020年CSCO 乳腺癌诊疗指南》[5]中的诊断标准;②临床资料完整;③签署知情同意书;④均为首次手术治疗者。排除标准:①合并其他脏器恶性肿瘤者;②入院前曾接受过放疗、新辅助化疗及肿物切除者;③合并免疫性疾病者。同时取观察组患者距肿瘤切缘>5 cm 处远癌组织作为对照组。本研究经院医学伦理委员会批准。
1.2 方法
1.2.1 TAMs、PRL⁃3 及C⁃erbB⁃2 检测方法
TAMs、PRL⁃3 及C⁃erbB⁃2 均使用免疫组化学检测方法,检测试剂:TAMs 为鼠抗人单克隆CD68 抗体(北京中杉生物技术公司);PRL⁃3 为一抗PRL⁃3 兔抗人多克隆抗体(北京中杉生物技术公司);C⁃erbB⁃2 为兔抗人C⁃erbB⁃2 单克隆抗体(福州迈新生物技术开发有限公司),制片完成后以光学显微镜进行观察。
结果判读[6]:TAMs:在细胞膜、细胞浆内可见棕黄色或黄褐色颗粒为阳性;PRL⁃3 细胞质中见黄色或棕黄色颗粒为阳性;C⁃erbB⁃2 以细胞膜出现棕色或细胞膜浆着棕色为阳性。在100 倍镜下观察切片情况,计数时使用高倍镜(×400)。每个视野中计数100 个癌细胞中阳性表达细胞数,总共计数5 个视野,取平均值。
使用半定量积分法对结果进行判读[6]。0 分:无阳性细胞;1 分:阳性细胞数≤25%;2 分:阳性细胞数26%~50%,3 分:阳性细胞数51%~75%,4 分:阳性细胞数≥76%。以细胞着色程度进行评分:0 分:无着色细胞;1 分:细胞着色为淡黄色;2 分:着色为棕黄色;3 分:着色为着色为棕褐色。根据两结果得分计算结果:积分低于3 分为阴性,3 分以上则为阳性。
1.2.2 随访
患者手术治疗后随访12 个月,随访截止至2021年5月31日,了解患者预后情况,根据2020年CSCO 乳腺癌诊疗指南[5]分为预后不良组(高复发风险者):①腋窝淋巴结≥4 个阳性,②淋巴结1~3 个阳性并伴有其他复发风险,③三阴乳腺癌;预后良好组(低复发风险者):①淋巴结1~3 个(LumnianA 型),②Ki⁃67 高表达(≤30%),③肿瘤≤2 cm,④年龄≤35 岁。
1.3 统计学方法
采用SPSS 20.0 软件进行统计分析,计量资料采用()表示,行t检验;计数资料采用n(%)表示,行χ2检验;采用多元Logistic回归分析影响乳腺癌患者预后生存的危险因素,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组TAMs、PRL⁃3 及C⁃erbB⁃2 表达情况比较
观察组TAMs、PRL⁃3 及C⁃erbB⁃2 阳性表达均明显高于对照组,差异有统计学意义(P<0.05)。见图1、表1。
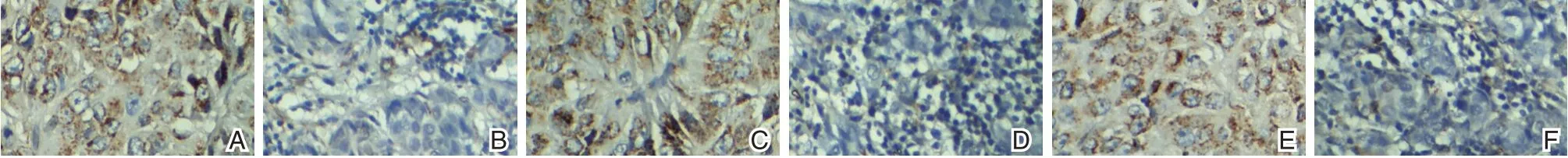
图1 TAMs、PRL⁃3 及C⁃erbB⁃2SP 染色图(SP,×400)Figure 1 TAMs,PRL⁃3 and c⁃erbb⁃2sp staining diagram(SP,×400)

表1 两组TAMs、PRL⁃3 及C⁃erbB⁃2 表达情况比较[n(%)]Table 1 Comparison of the expression of TAMs,PRL⁃3 and C⁃erbB⁃2 between the two groups[n(%)]
2.2 有无淋巴结转移者TAMs、PRL⁃3 及C⁃erbB⁃2表达情况比较
转移组TAMs、PRL⁃3及C⁃erbB⁃2阳性表达率明显高于无转移组,差异有统计学意义(P<0.05)。见表2。
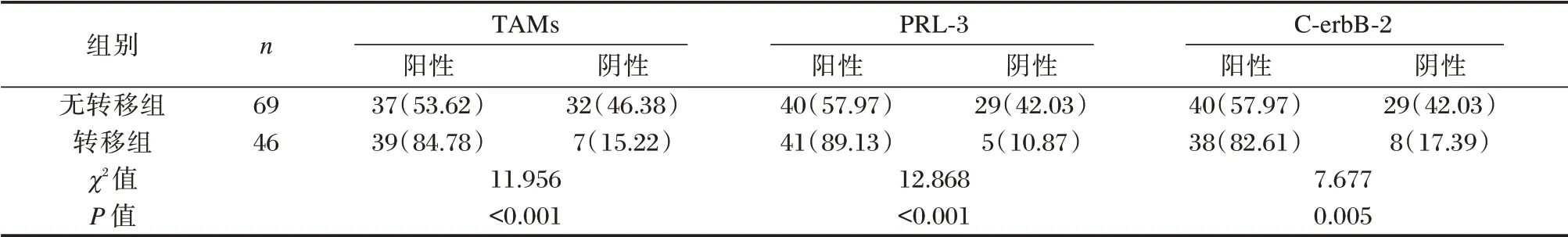
表2 有无淋巴结转移者TAMs、PRL⁃3 及C⁃erbB⁃2 表达情况比较[n(%)]Table 2 Comparison of TAMs,PRL⁃3 and C⁃erbB⁃2 expression with or without lymph node metastasis[n(%)]
2.3 影响乳腺癌预后不良的因素分析
115 例患者随访12 个月后预后良好88 例(预后良好组),预后不良27 例(预后不良组)。预后不良组淋巴结转移者、病理分期为Ⅲ~Ⅳ期、低分化、TAMs阳性、PRL⁃3 阳性、C⁃erbB⁃2 阳性占比明显高于预后良好组,差异有统计学意义(P<0.05)。见表3。
2.4 影响乳腺癌患者预后不良危险因素分析
赋予值见表3,Logistic回归模型分析得病理分期、分化程度、淋巴结转移情况、TAMs、PRL⁃3及C⁃erbB⁃2 为影响乳腺癌预后不良的独立危险因素(P<0.05)。见表4。
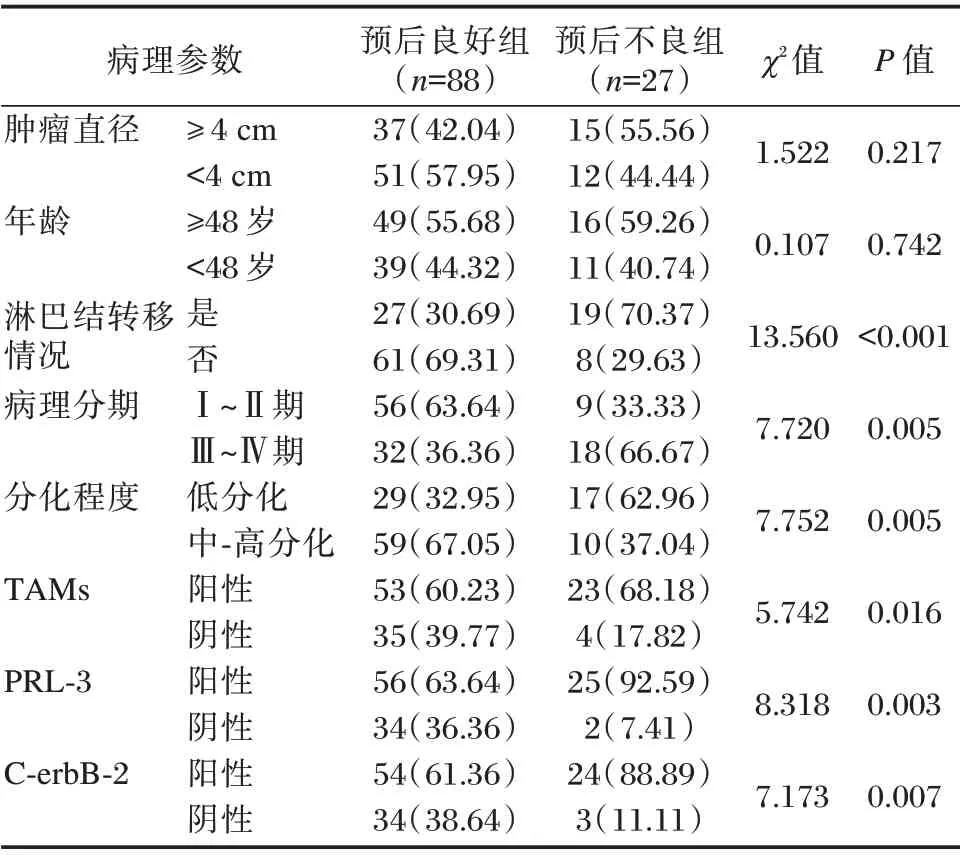
表3 影响乳腺癌预后不良的因素分析[n(%)]Table 3 Analysis of factors affecting the poor prognosis of breast cancer[n(%)]

表4 影响乳腺癌患者预后不良危险因素分析Table 4 Analysis of risk factors affecting the prognosis of breast cancer patients
3 讨论
TAMs 为肿瘤间质细胞的重要一员,所占比例可达50%~80%,其可通过直接或间接的方式促进肿瘤发生与进展[7]。研究显示TAMs 可促进肿瘤细胞分裂、血管生成、诱导肿瘤浸润、参与免疫抑制与逃逸,其生物学功能与肿瘤发生密切相关,可促进肿瘤进展,与肿瘤预后不良存在密切联系[8]。也有研究发现,肿瘤间质内TAMs 高表达的乳腺癌患者疾病进展快、易发生转移,预后较差,且肿瘤血管生成与TAMs 之间关系密切,与患者微血管密度成正相关[9]。本研究结果提示TAMs 在乳腺癌进展过程中发挥着重要的作用,可能与TAMs可促进肿瘤血管生成、加速肿瘤发展有关。
PRL⁃3 为酪氨酸蛋白磷酸酶家族中的一员,其在肿瘤中生物活性高,在心肌细胞、骨骼肌、胰腺组织中有不同程度表达,在肺部、脑、肾等组织中低表达[10]。以往研究显示PRL⁃3 在正常胃粘膜组织中表达阴性,在胃癌组织中阳性率高,且与胃癌患者淋巴结转移情况密切相关[11]。也有报道显示,PRL⁃3 可促进肿瘤相关性巨噬细胞分泌,从而诱导结肠癌细胞转移,影响患者预后情况[12]。本研究中,PRL⁃3 在癌组织中高表达,淋巴结转移者表达亦高于未转移者,PRL⁃3 高表达为乳腺癌患者预后的相关因素,说明PRL⁃3 在乳腺癌发生、转移的过程中可能发挥了一定的作用。结合以往文献分析,可能与以下几点有关:①PRL⁃3 可刺激血管内皮生长因子及其相关受体的过高表达,诱导肿瘤生长、侵袭和转移;②PRL⁃3 可正向调控P13K 细胞通路诱导肿瘤侵袭和转移;③促使PRL⁃3 信号转导途径激活,进而发挥调控肿瘤细胞活动性和侵袭性;④介导细胞外调节蛋白激酶信号传导通路的作用,可刺激肿瘤血管的生成,进一步加快肿瘤的生长和成熟,同时可诱导淋巴结转移和远处转移[13]。
C⁃erbB⁃2是目前公认与乳腺癌发生、发展之间有密切联系的原癌基因,对细胞生长、增殖、分化具有调控作用;其产物的过度表达往往提示肿瘤恶性程度高,预后情况不佳。目前研究发现C⁃erbB⁃2 在乳腺癌组织中的表达程度结果差异较大,最低阳性表达为20%,最高可达70%,本组中C⁃erbB⁃2 在乳腺癌组织阳性表达率为67.82%,与大部分研究结果相符[14]。有学者认为C⁃erbB⁃2表达与乳腺癌临床分期、病理类型、分化程度等存在相关性,C⁃erbB⁃2 表达情况与乳腺癌患者淋巴结转移情况为正相关,C⁃erbB⁃2 阳性表达者出现转移、复发机率高,总生存期短[15]。本研究中,C⁃erbB⁃2 在癌组织、有淋巴结转移者中表达明显高于癌旁组织以及无淋巴结转移者,且与患者预后存在一定联系,说明C⁃erbB⁃2 表达与乳腺癌淋巴结转移之间密切相关,C⁃erbB⁃2 过度表达的乳腺癌具有更强的侵袭力与转移能力,此类患者预后情况也较差。
综上所述,TAMs、PRL⁃3 及C⁃erbB⁃2 过度表达与乳腺癌淋巴结转移可能存在一定的联系,对乳腺癌患者预后评估有参考价值。

