一测多评法测定新疆假龙胆中3种环烯醚萜苷
耿若愚,居博伟,3,杨建华,胡君萍*
(1.新疆医科大学药学院,新疆 乌鲁木齐 830011;2.新疆医科大学第一附属医院,新疆 乌鲁木齐 830054;3.新疆医科大学第五附属医院,新疆 乌鲁木齐 830000)
新疆假龙胆Gentianellaturkestanerum(Gand.) Holub是龙胆科1年或2年生草本植物,主要分布于新疆伊犁等地,该药材具有利湿消肿、清热解毒等功效,全草可入药,民间用其全草泡茶治疗感冒、发热等症,在保肝利胆、消肿祛湿方面积累了丰富的临床经验[1-3]。综合文献调研及课题组前期研究显示,黄酮类、环烯醚萜苷类成分是假龙胆主要成分,环烯醚萜苷类成分包括龙胆苦苷、獐牙菜苦苷和獐牙菜苷等,具有保肝、抗炎等药理作用,对肝纤维化、急性肝损伤、类风湿关节炎等疾病的防治表现出巨大潜力[4-9]。新疆假龙胆作为新疆道地特色药用资源,在保肝防治研究领域具有较大的开发应用价值,但到目前为止尚未见有新疆假龙胆药材质量控制方面的研究报道,且现有市售的3种环烯醚萜苷对照品价格高昂,获取渠道单一,给药材的质控研究带来一定困难,因而亟需一种低成本、高效便捷的活性成分检测分析方法。一测多评法(quantitative analysis of multi-components by single-marker,QAMS)是指在多成分可同时测定的条件下,只测定其中一个成分(价格低廉,或者易获得)的含量,并计算其他成分与此成分的相对校正因子(relative correction factor,RCF),从而快速测定多成分的含量[10-17]。本研究采用一测多评法测定新疆假龙胆中的环烯醚萜苷成分的含量,以龙胆苦苷为内标物,分别获取龙胆苦苷与獐牙菜苦苷和獐牙菜苷的相对校正因子,最后得出3种成分的含量。此方法操作简便、高效准确,以期实现以单指标对新疆假龙胆进行多指标成分质量控制的目的,为新疆假龙胆药材质量控制体系的建立以及种属资源鉴定提供了参考。
1 材料
1.1 仪器 岛津LC-20AD高效液相色谱仪(日本岛津公司);Waters e2696-2998高效液相色谱仪(美国Waters公司);Agilent 1260高效液相色谱仪(美国Agilent公司);依利特Supersil ODS2(4.6 mm×250 mm,5 μm,柱号 E3121502)、Cosmosil Packed Column 5C18-MS-Ⅱ(4.6 mm×250 mm,5 μm,柱号 K62746)、Waters XBridge Sgield RP18(4.6 mm×250 mm,5 μm,柱号186003010)、Waters XBrigeTM C18(4.6 mm×250 mm,5 μm,柱号 186003117)、依利特Supersil AQ-C18(4.6 mm×250 mm,5 μm,柱号 E3015357)、Thermo SCIENTIFIC ODS HYPERSIL(4.6 mm×250 mm,5 μm,柱号 10285071)、依利特 Hypersil BDS C18(4.6 mm×250 mm,5 μm,柱号 E25221344),上述色谱柱依次命名为C1~C7;AB135-S型分析天平(瑞士Mettler yoledo公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);FJY1002-UVF基因研究型超纯水机(青岛富勒姆科技有限公司)。
1.2 试剂与药物 龙胆苦苷(批号SG8140)、獐牙菜苦苷(批号SS8760)、獐牙菜苷对照品(批号SS8750),均购于北京索莱宝科技有限公司;甲醇(色谱级,美国Fisher公司);磷酸(分析纯,批号CB1282-77,石家庄化工厂生产);水为超纯水;新疆假龙胆10批,经新疆医科大学药学院胡君萍教授鉴定为新疆假龙胆Gentianellaturkestanerum(Gand.) Holub全草,具体信息见表1。
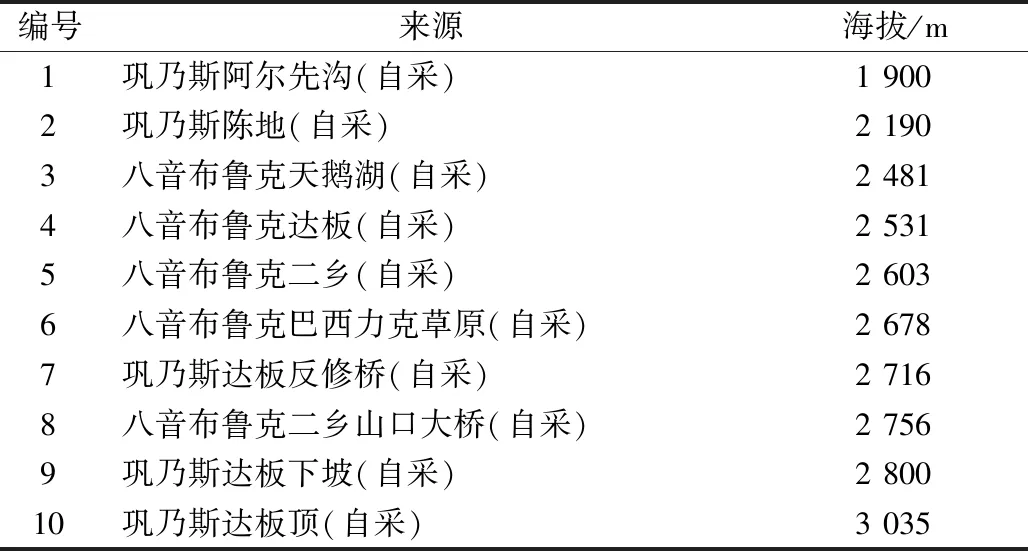
表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 色谱条件 依利特 Supersil ODS2柱(250 mm× 4.6 mm,5 μm);流动相甲醇(A)-0.03%磷酸水溶液(B),梯度洗脱(0~30 min,20%A;30~45 min,20%~80%A;45~50 min,80%A;50~65 min,80%~20%A);柱温30 ℃;体积流量1.5 mL/min;检测波长240 nm;进样量10 μL。
2.2 对照品溶液制备 精密称取獐牙菜苷、龙胆苦苷、獐牙菜苦苷对照品适量,置于10 mL量瓶中,用甲醇稀释并定容,得混合对照品溶液。獐牙菜苦苷、龙胆苦苷、獐牙菜苷对照品质量浓度分别为92.70、18.90、2.30 mg/L。
2.3 供试品溶液制备 称取新疆假龙胆适量,粉碎,取新疆假龙胆粉末约0.1 g,精密称定,置于10 mL量瓶中,称定质量,超声提取30 min,放冷,补充甲醇减少的量,摇匀,滤过,为新疆假龙胆样品贮备液。取1 mL样品贮备液于10 mL量瓶中,用初始比例流动相稀释定容,即为供试品溶液。使用前用0.22 μm微孔滤膜滤过,即得供试品溶液。
2.4 方法学考察
2.4.1 色谱系统适用性试验 吸取混合对照品溶液、供试品溶液各10 μL,在“2.1”项色谱条件下进样。在上述色谱条件下,獐牙菜苦苷、龙胆苦苷、獐牙菜苷的分离度良好,均大于1.5,理论塔板数大于3 000,色谱图见图1。

1.獐牙菜苦苷 2.龙胆苦苷 3.獐牙菜苷1.swertiamarin 2.gentiopicrosideuse 3.sweroside图1 各成分HPLC色谱图Fig.1 HPLC chromatograms of various constituents
2.4.2 线性关系考察 分别吸取“2.2”项下混合对照品溶液2、6、12、16、20 μL,在“2.1”项色谱条件下进样,记录峰面积,每个浓度测量3次,取平均值。以待测对照品浓度为横坐标(X),各环烯醚萜苷的色谱峰面积为纵坐标(Y),得回归方程,结果表明3种环烯醚萜苷在各自范围内线性关系良好,见表2。
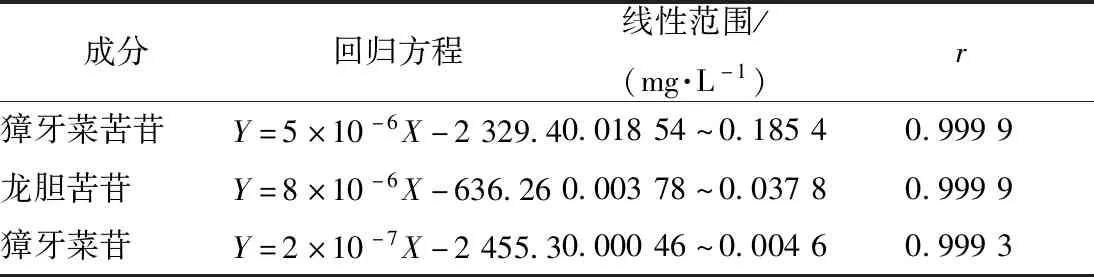
表2 各成分线性关系Tab.2 Linear relationships of various constituents
2.4.3 精密度试验 精密吸取“2.2”项下混合对照品溶液10 μL,在“2.1”项色谱条件下连续进样6次,记录3种环烯醚萜苷的色谱峰面积,计算相应的RSD。得獐牙菜苦苷、龙胆苦苷、獐牙菜苷峰面积RSD分别为0.8%、1.9%、3.3%,表明仪器精密度良好。
2.4.4 稳定性试验 精密吸取同一批次供试品溶液10 μL,分别于制备后0、2、4、8、12、24 h,在“2.1”项色谱条件下进样,记录3种环烯醚萜苷的色谱峰面积,计算相应的RSD。得獐牙菜苦苷、龙胆苦苷、獐牙菜苷峰面积RSD分别为0.51%、2.10%、2.19%,表明供试品溶液在24 h内稳定性良好。
2.4.5 重复性试验 取同一批次的新疆假龙胆粉末约0.1 g,精密称定,按“2.3”项下方法制备6份供试品溶液,精密吸取供试品溶液各10 μL,在“2.1”项色谱条件下进样,记录各个环烯醚萜苷的色谱峰面积,计算相应的RSD。得獐牙菜苦苷、龙胆苦苷、獐牙菜苷峰面积RSD分别为0.44%、0.32%、2.05%,表明该方法重复性良好。
2.4.6 加样回收率试验 精密称取已知含量的同一批次新疆假龙胆药材粉末0.25 g,分别精密加入混合对照品溶液适量,按“2.3”项下方法制备供试品溶液,在“2.1”项色谱条件下重复进样6次,计算各环烯醚萜苷的平均加样回收率和RSD。结果见表3。

表3 各成分加样回收率试验结果(n=6)Tab.3 Results of recovery tests for various constituents(n=6)
2.5 相对校正因子计算
2.5.1 多点校正法计算相对校正因子 在一定的线性范围内,以内参物(s)与其他待测成分(i)的相对校正因子的计算公式为
(1)
其中,RCF代表相对校正因子、s代表内参物、i代表其他待测成分、A表示色谱峰面积、C代表相应的对照品浓度。
分别吸取混合对照品溶液6、10、12、16、20 μL,在“2.1”项色谱条件下进样,记录3种环烯醚萜苷的色谱峰面积,以龙胆苦苷(A)为内参物,按式(1)计算獐牙菜苦苷(B)和獐牙菜苷(C)的相对校正因子,并计算RSD。计算得到獐牙菜苦苷和獐牙菜苷相对于龙胆苦苷的相对校正因子分别为1.399、0.499,RSD分别为0.407%、3.979%,结果见表4。
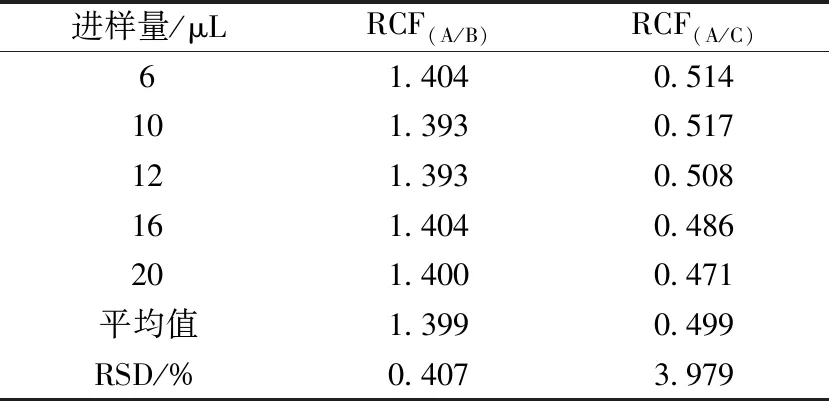
表4 各成分相对校正因子Tab.4 Relative correction factors of various constituents
2.6 相对校正因子的耐用性考察
2.6.1 色谱柱对校正因子的影响 分别使用5只不同型号的色谱柱,在“2.1”项色谱条件下进样10 μL。记录3种环烯醚萜苷的色谱峰面积,按公式(1)计算以龙胆苦苷为内参物的相对校正因子的平均值分别为1.399、0.485,相应的RSD分别为0.887、0.342,表明得到的相对校正因子在不同仪器和色谱柱之间的耐用性良好,结果见表5。
2.6.2 仪器对校正因子的影响 分别使用3台不同型号的仪器,在“2.1”项色谱条件下进样10 μL。记录3种环烯醚萜苷的色谱峰面积,按式(1)计算以龙胆苦苷为内参物的相对校正因子的平均值分别为1.486、0.517,相应的RSD分别为4.979%、3.589%,表明得到的相对校正因子在不同仪器和色谱柱之间的耐用性良好,结果见表6。

表5 不同色谱柱对相对校正因子的影响Tab.5 Effects of different columns on relative correction factors

表6 不同HPLC仪器对相对校正因子的影响Tab.6 Effects of different HPLC instruments on relative correction factors
2.6.3 不同体积流量对相对校正因子的影响 精密吸取同一混合对照品溶液10 μL分别以体积流量为1.3、1.4、1.5、1.6、1.7 mL/min条件下进样,记录3种环烯醚萜苷的色谱峰面积,计算相应的相对校正因子分别为1.402、0.519,相应的RSD分别为0.846%、1.298%,表明相对校正因子在1.3~1.7 mL/min的体积流量范围内耐用性良好,结果见表7。
2.6.4 不同检测波长对相对校正因子的影响 精密吸取同一混合对照品溶液10 μL,分别在检测波长为238、239、240、241、242 nm的条件下进样,记录3种环烯醚萜苷的色谱峰面积,计算相应的相对校正因子分别为1.418、0.488,相应的RSD分别为3.597%、1.590%,表明相对校正因子在检测波长为238~242 nm范围内耐用性良好,结果见表8。
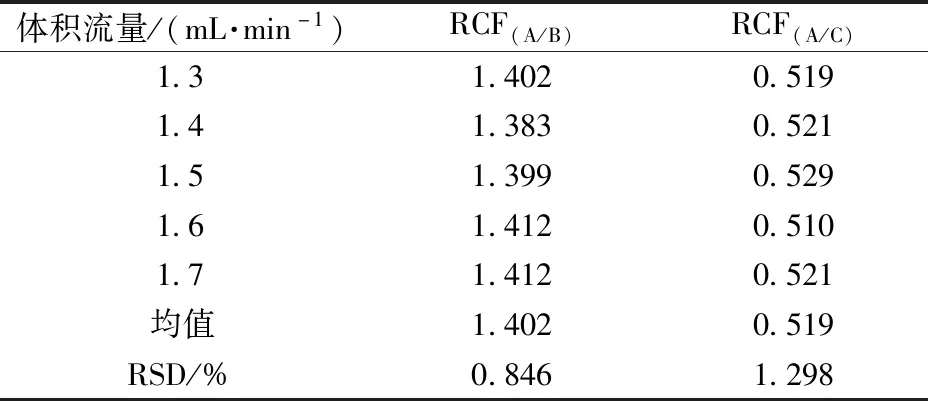
表7 不同体积流量对相对校正因子的影响Tab.7 Effects of different flowing rates on relative correction factors
表8 不同检测波长对相对校正因子的影响Tab.8 Effects of different detection wavelengths on relative correction factors
2.7 相对保留时间法预测待测成分色谱峰的定位 待测色谱峰的定位可以通过计算相对保留时间,相对保留时间是指待测组分与内参物保留时间的比值,计算公式为
ras=tRa/tRs
(2)
2.7.1 不同仪器、色谱柱对相对保留值的影响 分别使用3台不同型号的仪器以及不同型号的色谱柱,在“2.1”项色谱条件下进样10 μL。记录3种环烯醚萜苷的保留时间,按式(2)计算以龙胆苦苷为内参物的相对保留值的平均值分别为1.309、0.819,相应的RSD分别为0.339%、0.750%,表明得到的相对保留值在不同仪器和色谱柱之间的重复性良好,结果见表9。

表9 不同仪器、色谱柱下的相对保留值Tab.9 Relative retention under different instruments and chromatographic columns
2.7.2 不同体积流量对相对保留值的影响 精密吸取同一混合对照品溶液10 μL,分别在体积流量为1.3、1.4、1.5、1.6、1.7 mL/min条件下进样,记录3种环烯醚萜苷的保留时间,计算相应的相对保留值分别为1.331、0.814,相应的RSD分别为1.795%、0.277%,表明得到的相对保留值在体积流量1.3~1.7 mL/min范围内重复性良好,结果见表10。

表10 不同体积流量下的相对保留值Tab.10 Relative retention at different flowing rates
2.7.3 不同柱温对相对保留值的影响 精密吸取同一混合对照品溶液10 μL,分别在柱温为25、30、35、40 ℃的条件下进样,记录3种环烯醚萜苷的保留时间,计算相应的相对保留值分别为1.306、0.818,相应的RSD分别为3.800%、2.021%,表明相对保留值在柱温为25~40 ℃范围内重复性良好,结果见表11。
表11 不同柱温下的相对保留值Tab.11 Relative retention at different column temperatures
2.7.4 不同进样量对相对保留值的影响 分别吸取混合对照品溶液2、6、12、16、20 μL进样,记录记录3种环烯醚萜苷的保留时间,计算相应的相对保留值分别为1.317、0.821,相应的RSD分别为0.422%、1.631%,表明相对保留值在进样量为2~20 μL范围内重复性良好,结果见表12。
表12 不同进样量下的相对保留值Tab.12 Relative retention under different injection volumes
2.8 双标线性校正法预测待测色谱峰定位 相对保留时间法是目前常用的色谱峰定性方法,但由于色谱柱和色谱仪的差异,其预测结果与实际结果存在较大差异,并且需要限定色谱柱和色谱仪才能使用,在实际工作中应用性不强,准确性不能得到保障。王龙星等[17]研究发现,在不同的色谱柱上组分的保留时间存在线性关系。在此基础上孙磊等[18]提出了双标线性校正技术,即在兼顾效率和成分的同时,能够较为准确的定性色谱峰。双标线性校正技术主要有3个步骤,首先在待测组分中选择双标成分,在未知色谱柱上运行对照品及样品溶液,得到双标的实际保留时间;接着在不同色谱柱上重复上述过程,计算同一对照品在不同色谱柱的保留时间均值,即标准保留时间(standard retention time,SRT)。以SRT为纵坐标,各色谱柱实际保留间为横坐标绘制标准曲线;通过标准曲线,代入剩余组分SRT,即可得到剩余待测组分的保留时间。本研究中共有3种待测组分,因此两两组合进行预测,以预测保留时间和实际测定保留时间的差值进行比较,结果见表13。
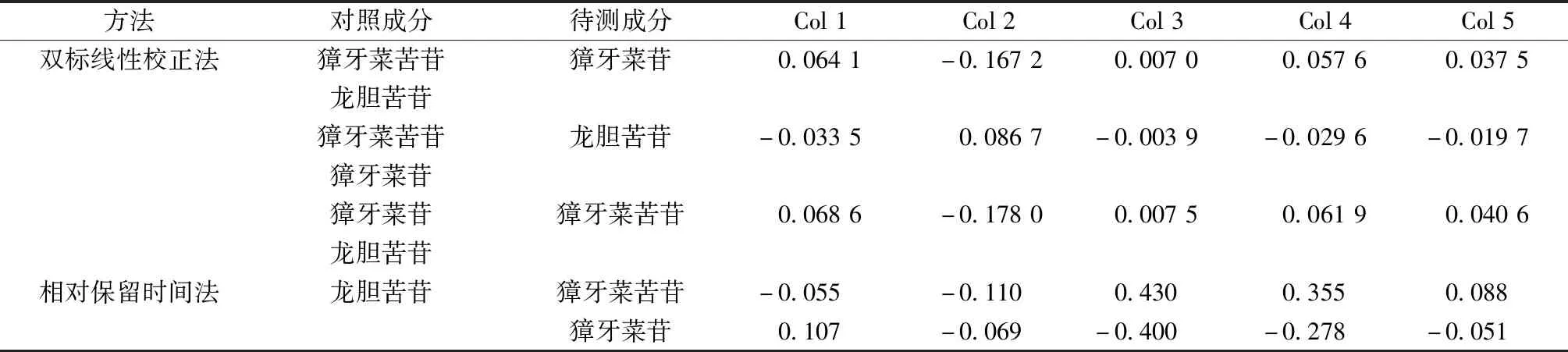
表13 保留时间预测值的绝对偏差及与相对保留时间法的比较Tab.13 Absolute deviations of retention times predicted and comparision of results of two methods
如表所示,双标线性校正法的3种组合的预测结果没有显著性差异,鉴于獐牙菜苷对照品的价格昂贵,最终选择以獐牙菜苦苷和龙胆苦苷作为双标成分。在1、2、5号色谱柱上,双标线性校正法和相对保留时间法的结果无显著性差异,2种方法预测的色谱峰定位均较为准确,但在3、4号色谱柱中,双标线性校正法的预测结果更准确,与真实值之间的差异更小,且和相对保留时间法的结果存在显著性差异,这表明双标线性校正法的预测结果更接近真实值,且不受对照品,色谱柱种类的限制,应用性更强。

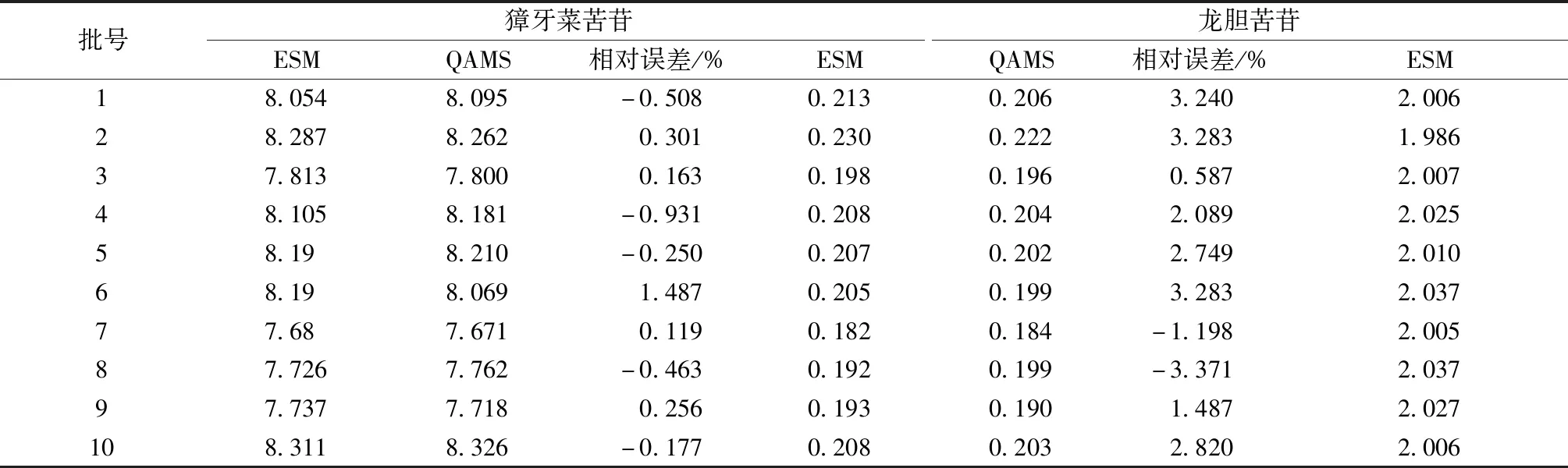
表14 一测多评法和外标法所得结果比较Tab.14 Comparison of results obtained by QAMS method and external standard method
3 讨论
3.1 内标选择 在3种环烯醚萜苷中,獐牙菜苷的对照品价格昂贵,不适宜在长期大量分析实验中使用,龙胆苦苷对照品价廉易得,且在实验中发现其在供试品中含量大于2%,所以本实验选用龙胆苦苷作为内参物。在双标线性校正法预测色谱峰时,选择龙胆苦苷和獐牙菜苦苷为内标。
3.2 相对校正因子考察 本实验考察了柱温、体积流量、色谱柱、色谱仪及检测波长对RCF的影响,以验证一测多评法在新疆假龙胆质量控制中的技术应用性和方法重现性。结果表明,以上条件适度改变时相对校正因子没有显著性变化,表明RCF在不同条件下的重复性较理想。
3.3 色谱峰定位 针对如何准确定位色谱峰的问题,本实验使用了相对保留时间法和双标线性校正法对色谱峰进行定性,考察了单一因素柱温、体积流量、色谱柱和色谱仪对相对保留时间的影响,结果表明双标线性校正法的预测结果精度高,更稳定,允许色谱条件在一定范围内变动,对色谱柱变化的容错率更高,该方法的技术适用性更优,且不会显著升高检测成本。
综上,本研究借助一测多评法建立新疆假龙胆3种环烯醚萜苷类活性成分的含量测定方法,结果表明该方法快速高效,操作简便,节约了研究成本,减少了检测试剂和耗材的消耗;重复性良好,计算得到的相对校正因子耐用性良好。通过本研究的开展,一方面有望构建并完善药材质量控制体系,为药材种属鉴定提供参考依据;另一方面深入开展新疆假龙胆资源可持续应用研究,对于富民兴疆战略的实施具有重要意义。

