海藻酸钠-琼脂-蒙脱土固定化菌对造纸废水降酚性能的研究
王浩楠 林 涛 王雪青 张安龙 罗 清,*
(1.陕西科技大学轻工科学与工程学院,轻化工程国家级实验教学示范中心,陕西西安,710021;2.陕西科技大学环境科学与工程学院,陕西西安,710021)
苯酚及其衍生物是制浆造纸[1]、纺织加工、煤气化、石油精炼等工业废水中常见的主要有机污染物。其中造纸废水生化出水中含有27 种有机污染物,包括2,4-二叔丁基苯酚、2,2'-亚甲基双-(4-甲基-6-叔丁基苯酚)、双酚A、2,4,6-三氯苯酚等苯酚类特征污染物[2]。而单体苯酚是苯酚类污染物最简单的中间体,单体苯酚由于其难降解性和普遍存在性,常被认定为具有酚类代表性的难降解化学污染物[3-4]。在各种去除苯酚的方法中,生物降解法具有成本低、无二次污染、可循环使用等优点,在含酚废水处理中具有良好的应用前景[5]。
然而,用于生物降解的游离微生物在细胞生长和细胞分离再利用过程中,容易受到环境因素(如培养液pH值和污染物浓度)敏感性的限制[6]。对游离细菌进行固定化处理可增强微生物抵抗极端环境毒性的能力,同时可以实现微生物的快速高效分离。许多有机材料和无机材料都可以作为细菌固定化基质。琼脂作为一种天然高分子聚合物,由于其胶凝能力强、耐酸,有较高的生物相容性,常被用作有机固定化基质,因此许多研究中使用琼脂来固定微生物和酶[7]。海藻酸钠在温和条件下可与钙离子交联,和游离细菌具有较高的相容性,是一种广泛使用的无毒固定细菌材料[8]。近年来,蒙脱土、高岭土等黏土矿物作为生物成分的载体和固定基质,因其对细胞无毒害作用和亲水性而备受关注[9]。Fang 等人[10]用琼脂卡拉胶复合纳米Fe3O4固定化细菌,研究了材料对细菌的吸附性能和各因素的影响程度,结果发现固定化后可明显提高降酚速率,且能实现高达50 次的循环利用率。Mandal 等人[11]研究发现膨润土固定化的分枝杆菌VF1 对酚降解速率有明显提高,黏土复合材料可以减缓环境对细菌的毒性,从而为细菌的生存创造一个合适的微环境。
本研究利用蒙脱土作为有机复合固定化材料海藻酸钠-琼脂凝胶的支持基质,制备海藻酸钠-琼脂-蒙脱土固定化微球。研究优化了固定化微球的最佳耦合条件和不同苯酚初始浓度下细菌的降解规律和降解动力学模型,以确定苯酚降解动力学参数;探究了极端pH 条件下固定化微球的苯酚降解效果和固定化微球的循环利用性能及存储稳定性。
1 实 验
1.1 实验菌株、培养条件和试剂
1.1.1 实验菌株
实验使用的苯酚降解菌株为革兰氏阴性短粗杆菌Klebsiella pneumoniaeZS01,来自于本实验室(-80℃超低温冷冻储存冰箱)。
1.1.2 培养条件
(1)菌株在pH 值为7 的MPYE 培养基中进行富集,每升培养基中含有3 g 鱼粉蛋白胨,3 g 酵母膏,1 g CaCl2·2H2O,1.6 g MgCl2,在恒温摇床中以150 r/min的转速在35℃下进行培养。菌株生长24 h 后,在4℃下以8000 r/min 的转速离心5 min 去除上清液来收集细菌。用无菌水通过紫外可见分光光度计在600 nm下将细菌浓度调整到0.8,用于细菌固定化。
(2)在苯酚降解过程中,富集菌株在35℃的Me⁃dA 培养基中生长,每升培养基中含有:2 mL 质量分数2%天冬氨酸、20 mL pH 值为6.8 的Solution C 溶液(10 g 氮川三乙酸,3.33 g CaCl2,29.5 g MgSO4·7H2O,93 mg (NH4)6Mo7O24·4H2O,99 mg FeSO4·7H2O,50 mL微量元素溶液)、1.25 g L-谷氨酸、10 mL 质量分数10% NaCl。培养基用1 mol/L KOH 和1 mol/L HCl 溶液将其pH 值调至7.0~7.3 后120℃高温灭菌30 min,然后用微孔滤膜加入10 mL 维生素溶液、20 mL 磷酸盐缓冲溶液(将KH2PO4溶液加入到K2HPO4溶液中至pH值为6.8)。
(3)苯酚原液的配制:取一定量的苯酚将其配制成6 g/100 mL的苯酚原液并置于4℃冰箱中保存备用。
1.1.3 试剂
蒙脱土(240 m2/g)、海藻酸钠、琼脂和苯酚试剂均购自上海阿拉丁生化科技有限公司;其他化学品均为分析纯或色谱纯;所有培养基和实验材料均预先在120℃下高压灭菌。
1.2 实验仪器
立式蒸汽压力灭菌锅,型号SN510C,重庆雅玛拓科技有限公司;生物安全柜,型号AC2-4S1,新加坡ESCO 科技有限公司;双层恒温摇床,型号QYC-210C,江苏盛蓝仪器制造有限公司;离心机,型号3k15,上海斯信生物科技有限公司;紫外可见分光光度计,型号UV759,上海佑科仪器仪表有限公司;环境扫描电子显微镜(ESEM),型号S4800,日本理学。
1.3 实验方法
1.3.1 固定化微球的制备
将蒙脱土和琼脂溶解在去离子水中,混合分散加热至100℃后,加入海藻酸钠,不断加热搅拌30 min,至水凝胶混合均匀,并且确保水凝胶不含气泡。混合均匀的水凝胶溶液在121℃的高压灭菌锅中灭菌30 min,将富集菌株加入至灭菌后冷却的水凝胶溶液(约40℃)中并充分混合均匀。通过注射器将均质水凝胶溶液滴入灭菌的CaCl2(4% 质量/体积)中,制备直径约3 mm、质量约50 mg 的水凝胶珠,于4℃冰箱中固定化12 h。固定的水凝胶珠用0.1 mol/L磷酸盐缓冲液(pH值=7.2)至少洗涤3次以去除微球上残留的钙离子,制得海藻酸钠-蒙脱土-琼脂固定化微球。制备的固定化微球储存在4℃中以备后用。
1.3.2 苯酚降解实验
为更好地研究固定化微球的降解效果,首先探究了影响固定化微球生物降解苯酚性能的4个因素。根据前期预实验结果,在进行单因素实验时,对不同影响因素采用一定递增比例的浓度进行批量实验。将不同浓度的固定化微球和灭菌苯酚加入装有100 mL 灭菌MedA培养基的250 mL锥形瓶中,使苯酚浓度达到1000 mg/L。将所有烧瓶用灭菌封口膜密封以防止苯酚氧化,然后置于35℃、150 r/min的恒温培养箱中降解。定期收集样品,并测量残留苯酚浓度。
在上述最佳条件下,还研究了固定化微球在苯酚作为唯一碳源时,苯酚降解性能最优时的苯酚初始浓度。在不同苯酚初始浓度(200、400、600、800、1000 mg/L)条件下,接种相同浓度的游离细菌作为对比实验,将它们与固定化微球的降酚性能进行比较。定期收集样品测量苯酚的残留浓度。苯酚降解数据用于计算苯酚降解的比降解速率和降解动力学分析。
1.4 分析方法
残留苯酚浓度采用4-氨基安替比林法测定[12]。采用比浊法对培养液中的生物量进行测定(OD600)。
1.5 苯酚降解动力学
一阶动力学通常用于描述不同污染物的生物降解。基于1.4 研究结果,使用伪一级模型评估苯酚降解过程的降解动力学。一阶动力学速率方程见式(1)和式(2)。

式中,St为t时刻苯酚浓度,mg/L,S0为苯酚初始浓度,mg/L,μ为比降解速率,h-1。生物降解率(dS/dt)由生物量指数生长阶段苯酚浓度随时间的斜率决定。
Haldane 模型[13]被拟合到实验数据中,以表示本研究中游离细菌和固定化微球对苯酚的降解动力学,见式(3)。

式中,μmax为最大比降解速率,h-1,S0为苯酚初始浓度,mg/L,Ks为底物亲和常数,mg/L,Ki为底物抑制常数,mg/L。Ki值较大表示微生物对底物抑制的敏感性较低。通过使用非线性回归[14]计算相应的苯酚初始浓度和μ,获得动力学参数和拟合曲线。
1.6 重复使用性和贮存稳定性
将固定化微球加入到含有1000 mg/L 苯酚的100 mL MedA 培养基中,每次循环时间一直持续到苯酚降解完成。每次生物降解过程结束后,弃去之前的培养基,用无菌水彻底清洗固定化微球3次,然后将其转移到含有1000 mg/L 苯酚的100 mL MedA 新鲜培养基中,进行循环降解实验。
为了评估固定化微球的贮存稳定性,将固定化微球和含有相同浓度的游离细菌同时在4℃的冰箱中储存5~30 天,然后在苯酚浓度为1000 mg/L 进行降解实验。
2 结果与讨论
2.1 游离细菌和固定化微球的表面形态及ESEM 形貌特征
2.1.1 表面形态
图1(a)为海藻酸钠微球的表面直观图,由图1(a)可以看出,海藻酸钠具有很好的成球性,呈透明白色状。图1(b)为固定化微球的表面直观图,复合琼脂和蒙脱土后,微球变为不透明乳白色,形状规则,球体大小均匀。图1(c)为固定化微球重复使用5 次后的外观图,经5次循环后,微球外观已变成黄色,这是因为微球内部繁殖生长出大量的细菌细胞,且实验室细菌为黄色,因此固定化微球也变成黄色。
2.1.2 ESEM分析
图2(a)~图2(d)为游离细菌、不同固定材料及固定化微球的横截面形貌图。由图2(a)可以看出,海藻酸钠微球内部包含不规则的交联网络结构,结构类似于先前研究得出的结论[15]。由图2(b)可以看出,此时海藻酸钠-琼脂-蒙脱土微球内部变成了更为紧凑的片状网络结构。可见琼脂和蒙脱土与海藻酸钠交联后,微球内部孔隙增多,一方面为细菌的附着和固定提供了更大的比表面积,另一方面也增加了底物的传质效率,也有利于营养物质的传输和新陈代谢产物的排出。对比游离细菌(图2(c))的形貌图,说明固定化微球(图2(d))内部有大量细菌成功附着。
2.2 单因素实验
2.2.1 海藻酸钠质量分数

图1 不同材料的形态Fig.1 Appearance of different materials
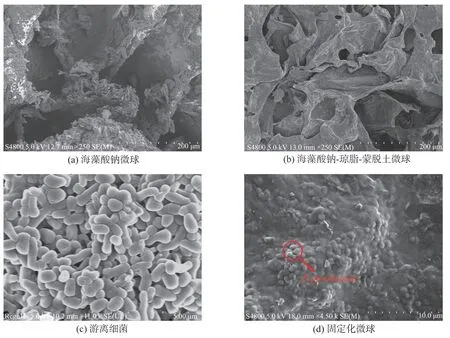
图2 不同固定材料及其固定化微球的ESEM图Fig.2 ESEM images of different immobilized materials and immobilized microphere
本研究将海藻酸钠滴入质量分数4%CaCl2溶液中形成凝胶微球,研究了不同海藻酸钠质量分数对苯酚降解的影响。图3(a)为海藻酸钠质量分数对苯酚降解速率的影响。由图3(a)可知,海藻酸钠质量分数为1%的固定化微球苯酚达到最大降解速率(18.18 mg/(L·h))。随着海藻酸钠质量分数的增加,交联网络结构增多,固定化微球内部比表面积增大,为微生物提供了足够的吸附、生长、繁殖的空间,从而提高了微生物传质效率。海藻酸钠质量分数增加至1.5%时,导致固定化微球的苯酚降解速率下降(15.87 mg/(L·h)),说明高质量分数海藻酸钠会使固定化微球内部过饱和,阻碍底物分子通过微球内部扩散,降低细菌对苯酚的降解速率[16]。综上,制备固定化微球海藻酸钠的最佳质量分数为1.0%。
2.2.2 蒙脱土质量分数
不同蒙脱土质量分数对苯酚降解的影响结果见图3(b)。由图3(b)可知,当蒙脱土质量分数从0 增加到1.0%时,苯酚降解速率缓慢增加。当蒙脱土质量分数为1.5%时,苯酚降解速率达最大值17.85 mg/(L·h)。这是因为蒙脱土可以吸收少量苯酚,减轻苯酚对细胞的毒性,为细菌生存创造良好的微环境。在固定化微球中加入蒙脱土可以提高其机械强度、渗透性[15]。但当蒙脱土质量分数增加至2.0%时,苯酚降解速率与低质量分数蒙脱土苯酚降解速率相当,约(16 mg/(L·h)),这可能是由于固定化微球中高质量分数的蒙脱土堵塞了微球的内部孔隙,阻碍了细菌的生长和底物的扩散,从而抑制了降解细菌的活性。综合考虑,固定化微球中蒙脱土的最佳质量分数为1.5%。
2.2.3 琼脂质量分数
琼脂质量分数对固定化微球降解苯酚性能的影响如图3(c)所示。由于琼脂质量分数增高(0.5%、1.0%),固定化微球的片状网络结构增加,固定化微球内部平均孔径增加,机械强度和稳定性也随之增加,固定化细菌的数量也随之增加,细菌降解苯酚的速率进一步提高,这一结果在Rehman 等人[17]的研究中也有体现。当琼脂质量分数过高时(2.0%),固定化微球内部变得更为致密,导致内部孔径减小,也影响了底物扩散到固定化微球内部的速度,从而降低了苯酚的降解效率。因此,制备固定化微球的最佳琼脂质量分数为1%。
2.2.4 细菌接种量
不同包埋细菌浓度(体积分数10%~30%)(OD600为0.8)对苯酚降解速率的影响结果如图3(d)所示。由图3(d)可知,随着细菌接种量的增加,苯酚的降解速率逐渐增加。细菌接种量从20%增加至25%时,苯酚降解速率迅速增加到18 mg/(L·h),这是因为细菌细胞对高浓度苯酚的适应性逐渐增强,导致细菌细胞增殖更快,生物降解效率更高。当接种量升高至30%时,降解速率并未显著提高,大量细菌在微球内部迅速繁殖导致微球过饱和,此时不仅影响微球的机械稳定性,也会导致细菌从微球泄露到溶液中,影响后续循环降解实验[18]。综合上述因素,制备固定化微球的最佳细菌接种量为25%。
2.2.5 正交实验
根据单因素实验结果,采用正交实验考察影响固定化微球各因素之间的交互作用,从而确定最优的细菌固定化条件,正交因素水平如表1所示。

表1 固定化微球降解苯酚正交实验因素水平表Table 1 Factors and levels of orthogonal experiment on degradation rate of phenol by immobilized microspheres
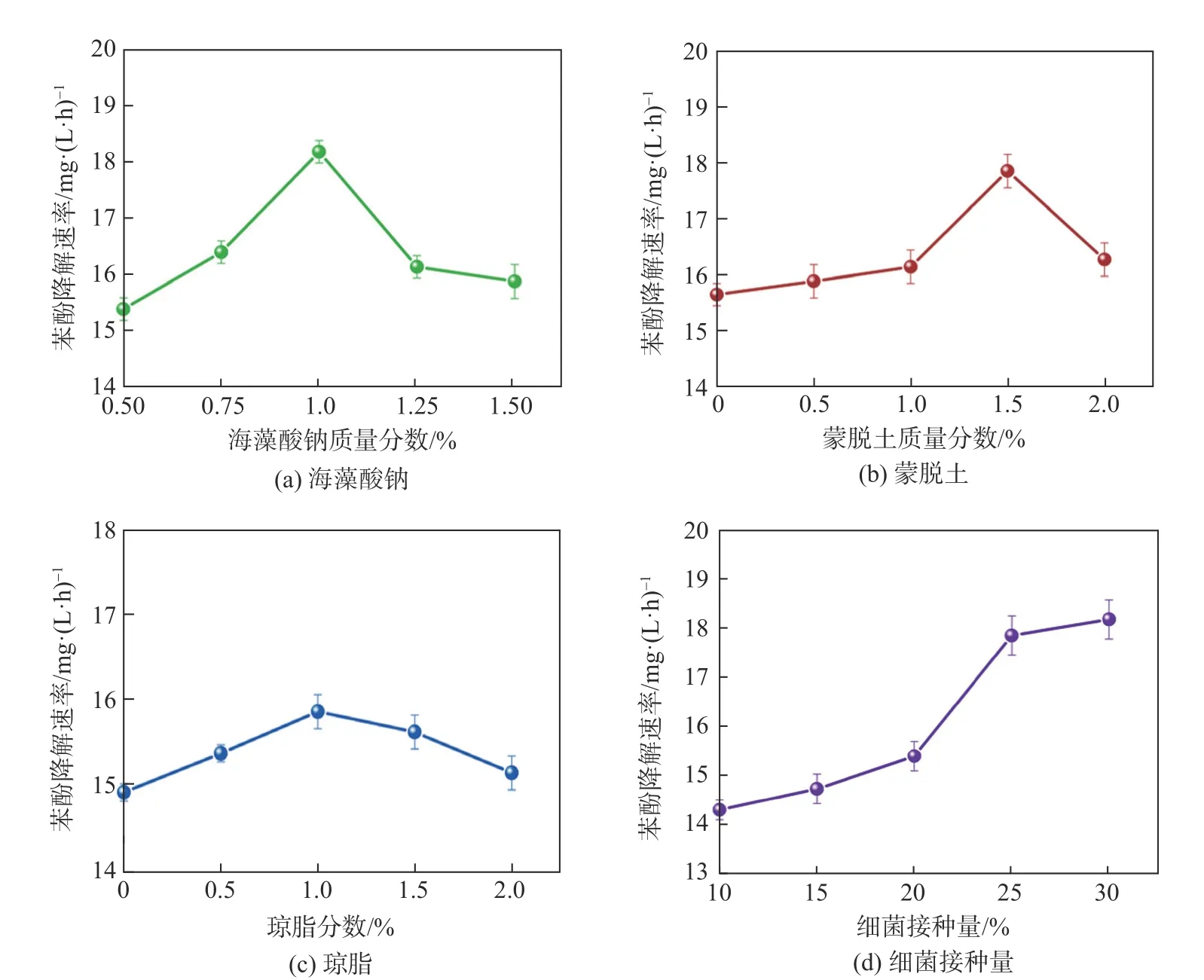
图3 影响苯酚降解速率的因素Fig.3 Factors affecting the degradation rate of phenol
Ki值表示该列因素水平为i时所对应的实验结果总和,可以判断某个因素的最优水平和最优组合;R值表示某个因素水平的极差,反应某个因素水平波动时,实验结果的变动幅度,R值越大,该因素对实验结果的影响越大,可以判断因素的主次顺序。以固定化微球对苯酚的降解速率为考察指标,正交实验结果如表2 所示。由表2 可知,影响固定化微球对苯酚降解速率因素的主次顺序为:海藻酸钠质量分数>细菌接种量>琼脂质量分数>蒙脱土质量分数。正交实验得出制备固定化微球的最优组合为:海藻酸钠质量分数1.0%,蒙脱土质量分数1.5%,琼脂质量分数1.0%,细菌接种量25%。在最优固定化条件下制备固定化微球,固定化微球可在60 h内完全降解1000 mg/L的苯酚,苯酚降解速率为16.67 mg/(L·h)。
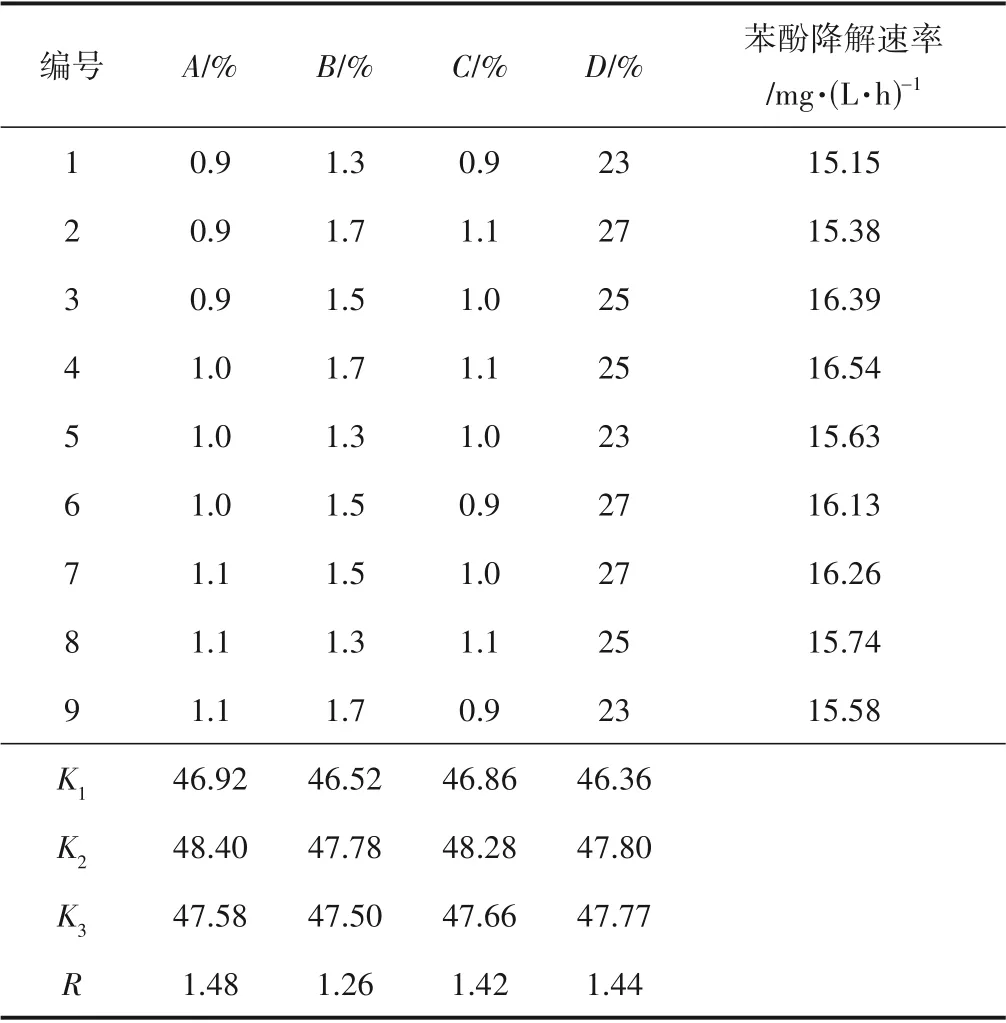
表2 固定化微球降解苯酚正交实验结果Table 2 Orthogonal test results and analysis of degradation rate of phenol by immobilized microspheres
2.3 苯酚初始浓度的影响
在最优海藻酸钠-琼脂-蒙脱土固定化条件下制备固定化微球后,固定化微球在不同苯酚初始浓度下的苯酚降解过程如图4 所示。由图4 可知,固定化微球在60 h 内对不同初始浓度下的苯酚可以全部有效降解,而游离细菌降解完成则需要72 h(降解速率为13.89 mg/(L·h))。首先,固定化微球对苯酚有一定的吸附作用,所以固定化微球在前6 h,苯酚浓度均有明显下降。不同的是在低苯酚初始浓度(0~400 mg/L)的条件下,苯酚浓度的降低实际上与时间呈线性关系,因此,在线性范围内对于给定的苯酚初始浓度,降解速率是恒定的。但在高浓度条件下(400~1000 mg/L),固定化微球的降解存在一定的滞后期(大概12 h左右),这是由于高浓度苯酚对细菌降解的抑制作用,因此苯酚浓度随时间的下降呈非线性。游离细菌的降解规律与固定化微球有很大的相似性,但不同的是游离细菌有长达24 h滞后期。对细菌进行固定化处理在一定程度上可以降低高浓度苯酚直接接触对细菌降解产生的抑制作用,因此固定化后明显降低了细菌降解苯酚的迟滞期。
2.4 苯酚降解动力学
在指数生长阶段测定了200~1000 mg/L 苯酚初始浓度的一级生物降解动力学参数,结果如表3 所示。由表3可知,随着苯酚初始浓度的增加,固定化微球在400 mg/L时比降解速率达到最大值。

图4 苯酚初始浓度对固定化微球和游离细菌降解苯酚的影响Fig.4 Effect of the initial concentration of phenol on the degradation of phenol by immobilized micropheres and free bacteria
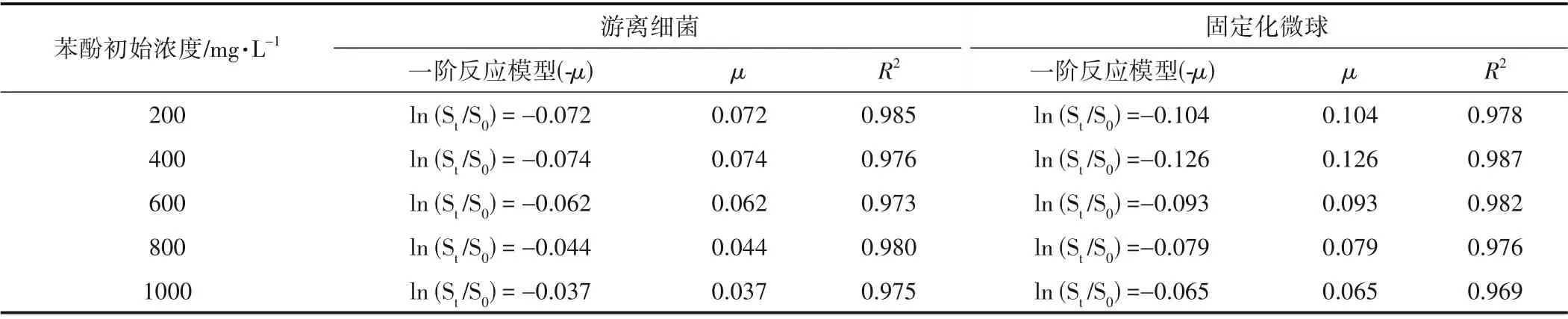
表3 游离细菌和固定化微球对苯酚的一级降解动力学参数Table 3 Parameters of first-order biodegradation kinetics of phenol by free bacteria and immobilized micropheres

图5 游离细菌和固定化微球比生长率拟合曲线Fig.5 Fitting curve of specific growth rate of free bacteria and immobilized micropheres
将上述比降解速率与其对应的苯酚初始浓度通过非线性曲线拟合,确定游离细菌和固定化微球的比生长率拟合曲线图以及模型预测的动力学参数见图5。由图5 可知,游离细菌(R2=0.944)和固定化微球(R2=0.953)的实验数据和模型预测均具有较高的相关系数。数据拟合Haldane 模型得到的动力学参数值表明固定化微球获得的预测μmax值(0.257 h-1)显著高于游离细菌μmax(0.198 h-1),表明固定化微球具有更高的苯酚降解性能。游离细菌苯酚比降解速率在苯酚初始浓度约100~200 mg/L 时达到最大值,而固定化微球的比降解速率在苯酚初始浓度200~300 mg/L时达到最高;苯酚的进一步增加导致μ的减少,表明高浓度苯酚对生物降解能力有相当大的抑制作用。固定化微球可以耐受高浓度的苯酚,在1000 mg/L 时固定化微球μ约为0.07 h-1,而游离细菌μ为0.04 h-1。模型参数显示固定化微球的底物抑制常数Ki(402.5)大于游离细菌Ki(233.1),说明固定化微球对苯酚抑制的敏感性低于游离细菌。这是因为固定化微球内部由有机-无机耦合形成的交叉网络结构可以作为苯酚对细胞毒性的有益物理屏障,从而降低底物对细菌抑制作用的敏感性,增强细菌在高苯酚初始浓度下的降酚能力[19]。
2.5 苯酚在强酸性和强碱性条件下降解
培养液的pH 值影响细菌的酶活性,进而影响微生物的生长速度,以及降酚菌对苯酚的降解效率。极端pH 环境下对固定化微球降解苯酚初始浓度为1000 mg/L 的影响见图6。图6(a)显示当pH 值为1 时,游离细菌完全不能降解苯酚,这是由于强酸性容易导致酶失活,相同条件下固定化微球则可以完成降解,但降解所需时间长达78 h;pH值为3时固定化微球完成降解时间也需68 h。以上结果表明,复合固定化材料有效地保护了细菌的活性。图6(b)显示当pH 值提高到10 和12,游离细菌对苯酚有一定程度的降解,同时固定化微球也能在相同条件下保持较高的降解效率(pH 值为10和12时,完成降解时间分别为60 h和68 h)。固定化微球在pH值为10的降解效率最高,这可能是由于苯酚降解过程中的酸性代谢物与培养基中的碱性化合物发生中和反应,从而自动调整了反应系统中的pH[20]。结果表明,固定化微球作为屏障,可以保护内部细菌免受极端环境的侵害,固定化后细菌对酸性和碱性环境均具有较好的适应性。
2.6 固定化微球的重复使用性和储存稳定性
2.6.1 重复使用性
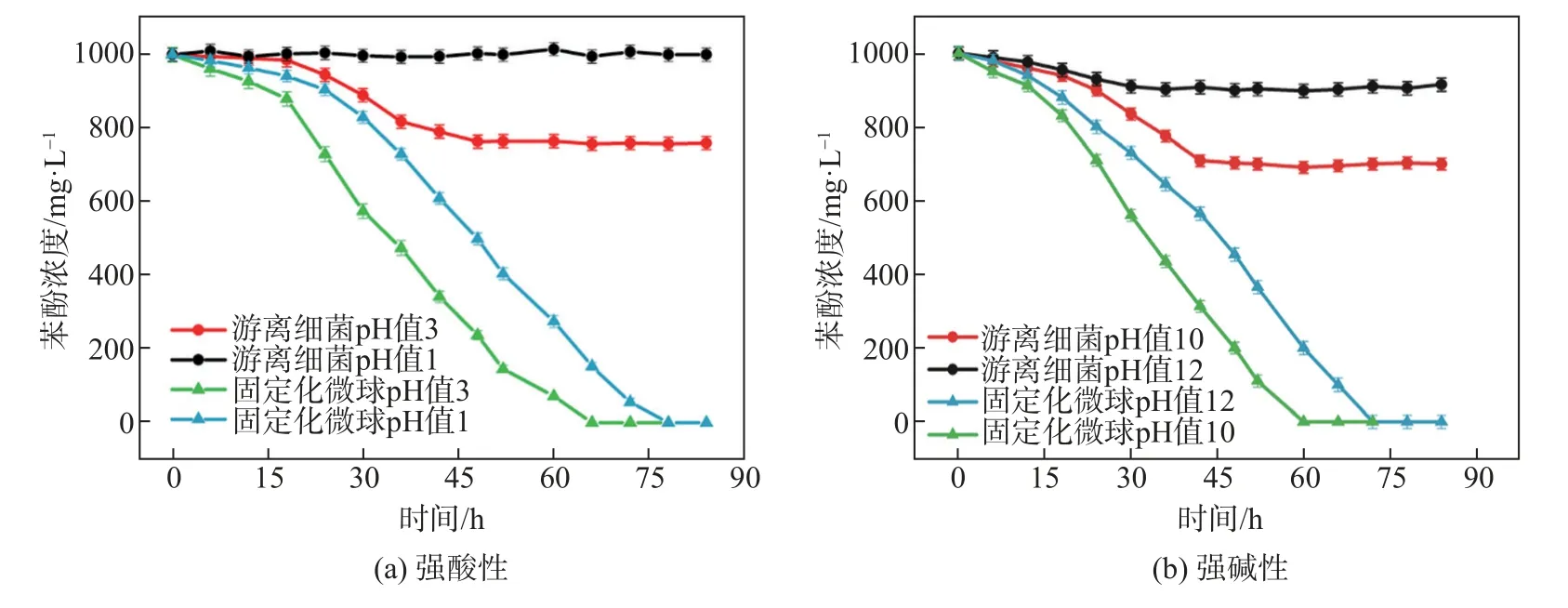
图6 极端pH值对游离细菌和固定化微球降解苯酚的影响Fig.6 Effect of extreme pH on the degradation of phenol by free bacteria and immobilized micropheres

图7 循环周期中固定化微球的苯酚降解速率与细菌活性Fig.7 Degradation rate and cell viability of immobilized micropheres in the cycle
重复使用性是固定化微球的一个重要考察指标,循环周期中固定化微球苯酚降解速率和细胞活性见图7。如图7(a)所示,在前6 个循环中苯酚降解速率迅速增加,苯酚降解速率从16.67 mg/(L·h)增加到45.45 mg/(L·h),此时固定化微球降酚效率处于稳定期,降解时间维持在22 h。由图7(b)可知,设定初始细菌活性为100%,相对活性以其初始活性的百分比表示,循环周期中固定化微球的相对活性与苯酚降解速率的趋势是一致的,重复培养时细菌分泌大量胞外聚合物,形成了生物膜,为重复苯酚降解提供适当的环境[19]。后期降解效率略微下降,这可能是因为固定化微球中细菌生物质的最大量,限制了底物转移到微球内部中。实验过程中观察发现,珠粒的形态基本保持完整的形态,直到32 次循环结束,珠子结构完全被破坏,循环终止。
2.6.2 储存稳定性
固定化微球的储存稳定性是其是否能被工业化大规模应用的重要考量因素之一。图8为固定化微球和游离细菌的储存稳定性。如图8所示,随着储存时间的延长,固定化微球保持稳定的苯酚降解率,在4℃下储存30 天后依然可以去除99%的苯酚。微球内的细菌保持生理稳定性且微球具有较高的机械强度。相比之下,游离细菌的苯酚降解率在超过15 天后急剧下降,甚至在30 天后失去活性。以上结果表明固定化微球具有很强的储存稳定性,可以重复使用,在实际应用中具有巨大的潜力。

图8 固定化微球和游离细菌的储存稳定性Fig.8 Storage stability of immobilized micropheres and free bacteria
3 结 论
本研究制备了海藻酸钠-琼脂-蒙脱土固定化微球苯酚降解菌,以苯酚降解速率为考察指标,探究了最佳固定化条件及各因素对苯酚降解速率的影响。
3.1 以海藻酸钠-琼脂-蒙脱土凝胶微球为载体制备固定化微球的最佳条件为:1.0%海藻酸钠、1.5%蒙脱土、1.0%琼脂和25%细菌接种量。与游离细菌苯酚降解速率(13.89 mg/(L·h))相比,固定化微球的苯酚降解速率(16.67 mg/(L·h))显著提高。
3.2 细菌的生物降解能力受苯酚初始浓度影响较大。较高的苯酚初始浓度会抑制生物量,降低生物降解率。固定化微球在60 h 内对1000 mg/L 的苯酚有较好的降解效果,而在相同条件下游离细菌降解则需要72 h。Haldane 抑制模型显示,固定化可以显著降低细菌对苯酚抑制的敏感性。
3.3 极端酸碱性条件下,固定化微球的降酚性能体现了显著的优越性,可以承受更广泛的酸性变化,并在碱性条件下保持较高的降解效率。
3.4 固定化微球可重复使用32 次,在4℃保存30 天后,依旧可以去除99%的苯酚。

