川芎嗪调控NF-κB 信号通路对银屑病HaCaT 细胞模型趋化因子和炎症因子表达影响
王 生 刘 洋 张 晶 (河北医科大学附属唐山工人医院皮肤科,唐山 063000)
银屑病是一种慢性皮肤疾病,病程较长且容易复发,一般药物治疗后的效果并不明显,遗传、内分泌、感染、代谢障碍等均可诱导银屑病的发生[1]。角质形成细胞发育不良、角化过度、炎症浸润、毛细血管扩张等均为银屑病的病理特点[2]。研究显示,角质形成细胞在银屑病的发生过程中占据重要地位,其能够表达炎症因子IL-6、IL-4、IL-13 和趋化因子Eotaxin、RANTES、TARC,促进炎症反应[3]。川芎嗪是一种从中药川芎分离提取出来的四甲基吡嗪,具有降血压、利尿、抗血小板凝集、抗肿瘤等功效[4]。既往研究表明,川芎嗪治疗后银屑病小鼠尾部鳞片中颗粒层明显增加[5]。川芎嗪处理后HaCaT 细胞中EGF10 表达水平降低,而EGF10 是银屑病发生的促进因子[6]。目前对川芎嗪作用机制的相关研究显示,川芎嗪抵抗细胞炎症因子分泌与下调NF-κB 信号通路的激活水平有关[7]。NF-κB 是在人体内发挥多种作用的信号调控通路,在肿瘤、心血管疾病、神经系统疾病等进展中具有重要调节作用[8]。在银屑病中发现NF-κB 过度激活,而下调NF-κB 信号水平能够抑制银屑病进展,减少银屑病角质形成细胞炎症因子分泌[9]。现阶段对川芎嗪调控NF-κB 信号影响银屑病角质形成细胞炎症因子和趋化因子分泌的作用尚不明确。本实验以TNF-α 和IFN-γ 刺激人角质形成HaCaT 细胞,体外构建银屑病HaCaT 细胞模型,探讨川芎嗪在银屑病中的作用及可能机制,为川芎嗪治疗银屑病提供基础。
1 材料与方法
1.1 材料 川芎嗪购自成都德思特生物技术有限公司;CCK-8细胞增殖检测试剂盒购自美国Abbkine;IL-6含量检测试剂盒购自上海联迈生物工程有限公司;IL-4 含量检测试剂盒购自上海西唐生物科技有限公司;IL-13含量检测试剂盒购自上海沪鼎生物科技有限公司;人角质形成HaCaT 细胞购自武汉普诺赛生物科技有限公司;p65抗体、IκBα抗体购自美国Cell Signaling Technology。
1.2 方法
1.2.1 CCK-8 法检测川芎嗪对HaCaT 细胞增殖活性的影响 将HaCaT 细胞以3 000个/孔分别接种至96 孔板,将细胞置于饱和湿度、37 ℃、5%CO2培养箱内培养过夜,然后将细胞培养液更换成含有0、0.1、0.2、0.4、0.8 mg/ml 的川芎嗪的细胞培养液培养,24 h 后取出培养板,分别在细胞内添加10µl CCK-8溶液,37 ℃下继续反应4 h。取出培养板,检测波长为450 nm 处的A 值,以空白孔调零,计算细胞存活率变化。
1.2.2 实验分组处理 HaCaT 细胞分为Control、Model、TMP-L、TMP-M、TMP-H组,Model组在实验0 h时用含10 ng/ml TNF-α 和10 ng/ml IFN-γ 的细胞培养液培养,TMP-L、TMP-M、TMP-H 组细胞在实验开始前2 h分别用含有0.1、0.2、0.4 mg/ml的川芎嗪预处理,然后用含10 ng/ml TNF-α 和10 ng/ml IFN-γ 的细胞培养液培养。Control 为空白对照细胞,不做处理。收集Control、Model、TMP-L、TMP-M、TMP-H 组培养24 h 后的细胞用于后续检测。TNF-α 和IFN-γ刺激后的HaCaT细胞分泌的IL-6、IL-4、IL-13水平增加,细胞中Eotaxin、RANTES、TARC 表达水平升高,提示成功构建了体外银屑病HaCaT细胞模型。
1.2.3 qRT-PCR 检测Eotaxin、RANTES、TARC mRNA 表达 收集细胞,在细胞内添加PBS 溶液洗涤2 次,然后吸取1 ml 的Trizol 试剂添加到细胞内,提取细胞总RNA。RNA溶解在80µl的DEPC水中。按以下方法配制逆转录体系,包含:2 µl 5×Prime Buffer、0.5µl Radom 6 mers、0.5µl Oligo dT Primer、0.5 µl Prime Script RT Enzyme Mix、500 ng 总RNA,最后添加RNase Free dH2O 至10µl。将上述试剂混合后,瞬时离心,然后在37 ℃下反应15 min,85 ℃反应5 s,4 ℃冷却。PCR 引物如下:Eotaxin F-5′-AA⁃CATGGCGGGCTCTGCTAC-3',R-5′-CCTGCCTTGGGACAGATGCT-3';RANTES F-5′-CCCCGTGCCGA⁃GATCAAGGAGTATTT-3',R-5′-CGTCCAGCCTGGGGAAGGTTTTTGTA-3';TARC F-5′-ACTGCTCCAGGGATGCCATCGTTTTT-3',R-5′-ACAAGGGGATGGGATCTCCCTCACTG-3';GAPDH F-5′-CGTCTAGAAAAACCTGCCAA-3',R-5′-TGAAGTCAAAGGAGAC⁃CACC-3'。配制PCR 反应体系,包括:0.5µl 正向及反向引物、5µl SYBR GreenⅠ、1µl cDNA,然后添加DEPC 水至10 µl,首先设置95 ℃孵育40 s,然后以90 ℃孵育3 s,65 ℃退火40 s,共40个循环,以GAPDH为参照,分析Eotaxin、RANTES、TARC mRNA 水平,计算方法为2-ΔΔCt法。
1.2.4 ELISA 法检测IL-6、IL-4、IL-13 含量 收集细胞培养液上清,ELISA 分别检测IL-6、IL-4、IL-13含量,步骤均按照IL-6、IL-4、IL-13 含量检测试剂盒说明书进行。
1.2.5 Western blot 检测p65、IκBα 蛋白表达 在RIPA 裂解溶液中以100∶1 比例加入PMSF,混合均匀后置于冰上孵育备用。收集细胞,弃上清,PBS洗涤3 次。将裂解溶液添加到细胞内,涡旋30 s,冰上反应30 min,期间每隔10 min 涡旋1次。4 ℃条件下以12 000 g 离心10 min。吸取上清溶液,添加5×Loading Buffer 混合后,100 ℃煮沸5 min。将玻璃板洗涤干净并组装。按照常规方法制备10%的分离胶并灌入玻璃板间,室温静置50 min 后,弃去上层的无水乙醇,以滤纸吸干。制备5%的浓缩胶,灌入玻璃板内,室温结合30 min。以30 µg/孔蛋白样品进行点样,设置80 V 电压电泳30 min,观察染料进入分离胶后,以120 V 电压电泳90 min。裁剪PVDF膜,以90 V电压转膜。将PVDF膜从电泳槽内取出,并置于TBST 溶液洗涤3 次,然后于5%脱脂奶粉中室温中孵育1 h。将一抗和二抗分别用封闭液稀释。将PVDF 膜分别置于一抗、二抗溶液中孵育后,ECL法显色。内参为GAPDH,分析目的蛋白的表达变化。p65、IκBα以1∶800稀释,二抗以1∶4 000稀释。
1.2.6 NF-κB信号激活剂的逆转作用检测 HaCaT细胞在实验开始前2 h 用1µmol/L 的NF-κB 信号激活剂PMA 和0.2 mg/ml 的川芎嗪预处理,然后用含10 ng/ml TNF-α 和10 ng/ml IFN-γ 的细胞培养液培养,记为TMP-M+PMA组,以TMP-M为参照培养24 h后,qRT-PCR检测Eotaxin、RANTES、TARC mRNA 表达(参照1.2.3),ELISA 法检测IL-6、IL-4、IL-13含量(参照1.2.4),Western blot 检测p65、IκBα 蛋白表达(参照1.2.5)。
1.3 统计学分析 实验数据采用SPSS21.0软件分析,计量资料以±s表示,两组数据间比较采用t检验,多组差异比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 川芎嗪对HaCaT 细胞增殖影响 与0 mg/ml川芎嗪处理的细胞相比,0.1、0.2、0.4 mg/ml川芎嗪处理后HaCaT细胞存活率无明显变化,而0.8 mg/ml川芎嗪处理的HaCaT 细胞存活率明显降低(表1)。选择对细胞增殖活性没有影响的0.1、0.2、0.4 mg/ml的川芎嗪进行后续实验。
表1 川芎嗪处理后HaCaT细胞存活率(±s)Tab.1 HaCaT cell survival rate after ligustrazine treat⁃ment(±s)

表1 川芎嗪处理后HaCaT细胞存活率(±s)Tab.1 HaCaT cell survival rate after ligustrazine treat⁃ment(±s)
Note:Compared with 0 mg/ml group,1)P<0.05.
Ligustrazine concentration/(mg·ml-1)Cell survival rate/%100.00±9.65 98.25±10.36 94.22±8.78 92.78±10.54 76.25±6.321)9.350<0.001 0 0.1 0.2 0.4 0.8 FP
2.2 川芎嗪对银屑病HaCaT 细胞模型趋化因子Eotaxin、RANTES、TARC mRNA 表达影响 结果见表2,与Control 组相比,Model 组HaCaT 细胞模型中Eotaxin、RANTES、TARC mRNA 表达水平升高;与Model组相比,TMP-L、TMP-M、TMP-H组HaCaT细胞模型中Eotaxin、RANTES、TARC mRNA 表达水平依次降低。
表2 川芎嗪对银屑病HaCaT细胞模型中Eotaxin、RANTES、TARC mRNA表达的影响(±s)Tab.2 Effect of ligustrazine on expressions of Eotaxin,RANTES and TARC mRNA in HaCaT cell model of psoriasis(±s)
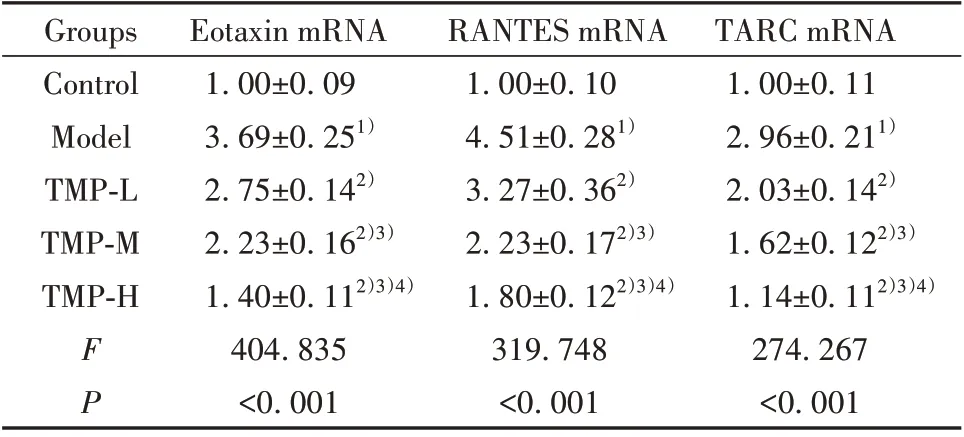
表2 川芎嗪对银屑病HaCaT细胞模型中Eotaxin、RANTES、TARC mRNA表达的影响(±s)Tab.2 Effect of ligustrazine on expressions of Eotaxin,RANTES and TARC mRNA in HaCaT cell model of psoriasis(±s)
Note:Compared with Control group,1)P<0.05;compared with Model group,2)P<0.05;compared with TMP-L group,3)P<0.05;compared with TMP-M group,4)P<0.05.
TARC mRNA 1.00±0.11 2.96±0.211)2.03±0.142)1.62±0.122)3)1.14±0.112)3)4)274.267<0.001 Groups Control Model TMP-L TMP-M TMP-H FP Eotaxin mRNA 1.00±0.09 3.69±0.251)2.75±0.142)2.23±0.162)3)1.40±0.112)3)4)404.835<0.001 RANTES mRNA 1.00±0.10 4.51±0.281)3.27±0.362)2.23±0.172)3)1.80±0.122)3)4)319.748<0.001
2.3 川芎嗪对银屑病HaCaT 细胞模型炎症因子IL-6、IL-4、IL-13 分泌影响 结果见表3,与Control组相比,Model 组HaCaT 细胞模型分泌的IL-6、IL-4、IL-13 水平升高;与Model 组相比,TMP-L、TMP-M、TMP-H 组HaCaT 细胞模型分泌的IL-6、IL-4、IL-13水平依次降低。
表3 川芎嗪对银屑病HaCaT 细胞模型分泌IL-6、IL-4、IL-13水平的影响(±s,pg/ml)Tab.3 Effect of ligustrazine on levels of IL-6,IL-4 and IL-13 secreted by HaCaT cell model of psoriasis(±s,pg/ml)
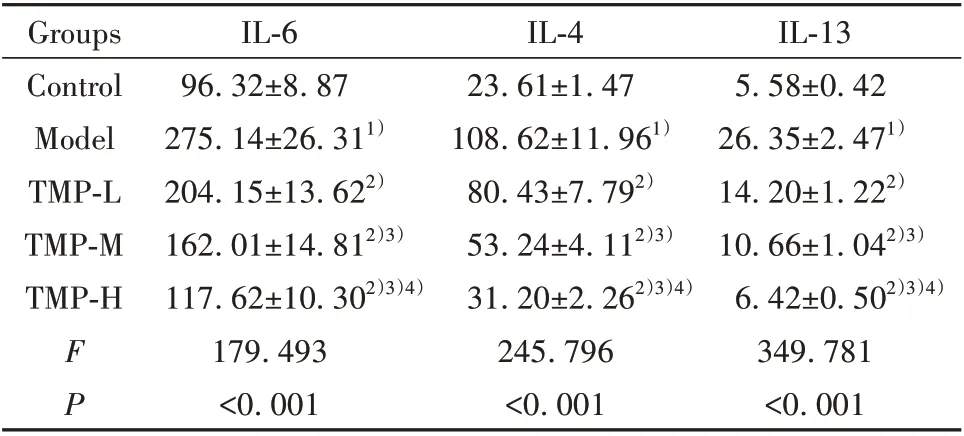
表3 川芎嗪对银屑病HaCaT 细胞模型分泌IL-6、IL-4、IL-13水平的影响(±s,pg/ml)Tab.3 Effect of ligustrazine on levels of IL-6,IL-4 and IL-13 secreted by HaCaT cell model of psoriasis(±s,pg/ml)
Note:Compared with Control group,1)P<0.05;compared with Model group,2)P<0.05;compared with TMP-L group,3)P<0.05;compared with TMP-M group,4)P<0.05.
IL-13 5.58±0.42 26.35±2.471)14.20±1.222)10.66±1.042)3)6.42±0.502)3)4)349.781<0.001 Groups Control Model TMP-L TMP-M TMP-H FP IL-6 96.32±8.87 275.14±26.311)204.15±13.622)162.01±14.812)3)117.62±10.302)3)4)179.493<0.001 IL-4 23.61±1.47 108.62±11.961)80.43±7.792)53.24±4.112)3)31.20±2.262)3)4)245.796<0.001
2.4 川芎嗪对银屑病HaCaT 细胞模型中NF-κB 信号通路激活影响 结果见图1、表4,与Control 组相比,Model 组HaCaT 细胞模型中p65 蛋白水平升高,IκBα 蛋白水平降低;与Model 组相比,TMP-L、TMP-M、TMP-H 组HaCaT 细胞模型中p65 蛋白水平依次降低,IκBα蛋白水平依次升高。
表4 川芎嗪对银屑病HaCaT 细胞模型中p65、IκBα 蛋白表达的影响(±s)Tab.4 Effect of ligustrazine on p65 and IκBα proteinexpressions in HaCaT cell model of psoriasis(±s)

表4 川芎嗪对银屑病HaCaT 细胞模型中p65、IκBα 蛋白表达的影响(±s)Tab.4 Effect of ligustrazine on p65 and IκBα proteinexpressions in HaCaT cell model of psoriasis(±s)
Note:Compared with Control group,1)P<0.05;compared with Model group,2)P<0.05;compared with TMP-L group,3)P<0.05;compared with TMP-M group,4)P<0.05.
p65 0.23±0.02 0.86±0.081)0.56±0.052)0.45±0.042)3)0.30±0.032)3)4)235.106<0.001 Groups Control Model TMP-L TMP-M TMP-H FP IκBα 0.96±0.09 0.25±0.041)0.52±0.062)0.63±0.062)3)0.79±0.072)3)4)150.172<0.001

图1 Western blot检测川芎嗪对银屑病HaCaT细胞模型中p65、IκBα蛋白表达的影响Fig.1 Effect of ligustrazine on p65 and IκBα protein expressions in HaCaT cell model of psoriasis were detected by Western blot
2.5 NF-κB 信号激活剂对川芎嗪作用的银屑病HaCaT细胞模型中NF-κB信号激活的影响 结果见图2、表5,与TMP-M 组相比,TMP-M+PMA 组HaCaT细胞模型中p65蛋白水平升高,IκBα蛋白水平降低。
表5 NF-κB 信号激活剂和川芎嗪对银屑病HaCaT 细胞模型中p65、IκBα蛋白表达的影响(±s)Tab.5 Effects of NF-κB signal activator and ligustrazine on expressions of p65 and IκBα protein in HaCaT cell model of psoriasis(±s)
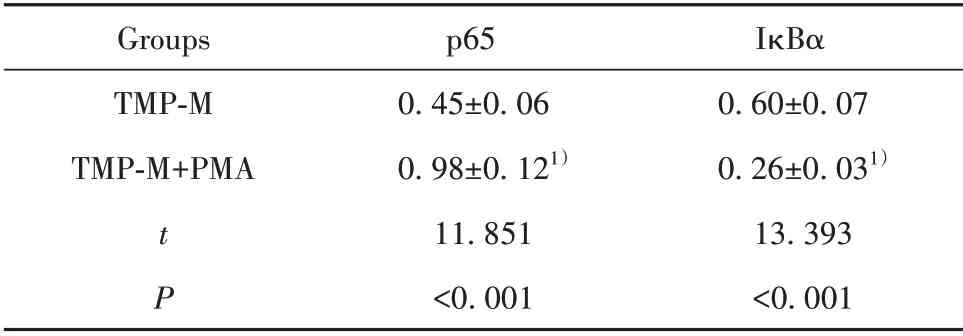
表5 NF-κB 信号激活剂和川芎嗪对银屑病HaCaT 细胞模型中p65、IκBα蛋白表达的影响(±s)Tab.5 Effects of NF-κB signal activator and ligustrazine on expressions of p65 and IκBα protein in HaCaT cell model of psoriasis(±s)
Note:Compared with TMP-M group,1)P<0.05.
IκBα 0.60±0.07 0.26±0.031)13.393<0.001 Groups TMP-M TMP-M+PMA tP p65 0.45±0.06 0.98±0.121)11.851<0.001
2.6 NF-κB 信号激活剂对川芎嗪作用的银屑病HaCaT细胞模型趋化因子表达和炎症因子分泌的影响 结果见表6,与TMP-M 组相比,TMP-M+PMA 组HaCaT 细胞模型中Eotaxin、RANTES、TARC mRNA水平升高,细胞分泌的IL-6、IL-4、IL-13增多。
表6 NF-κB 信号激活剂和川芎嗪对银屑病HaCaT 细胞模型中Eotaxin、RANTES、TARC mRNA 表达和分泌IL-6、IL-4、IL-13水平的影响(±s)Tab.6 Effect of NF-κB signal activator and ligustrazine on expressions of Eotaxin,RANTES,TARC mRNA and secretion of IL-6,IL-4 and IL-13 levels in HaCaT cell model of psoriasis(±s)
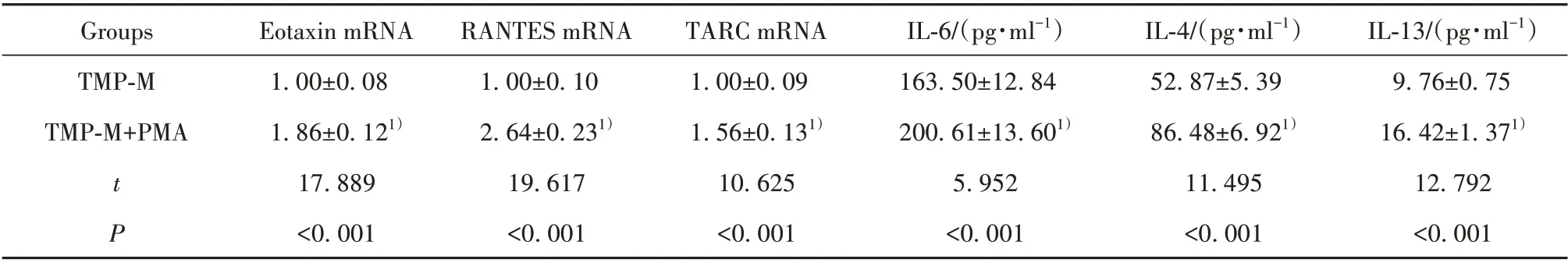
表6 NF-κB 信号激活剂和川芎嗪对银屑病HaCaT 细胞模型中Eotaxin、RANTES、TARC mRNA 表达和分泌IL-6、IL-4、IL-13水平的影响(±s)Tab.6 Effect of NF-κB signal activator and ligustrazine on expressions of Eotaxin,RANTES,TARC mRNA and secretion of IL-6,IL-4 and IL-13 levels in HaCaT cell model of psoriasis(±s)
Note:Compared with TMP-M group,1)P<0.05.
IL-13/(pg·ml-1)9.76±0.75 16.42±1.371)12.792<0.001 Groups TMP-M TMP-M+PMA tP Eotaxin mRNA 1.00±0.08 1.86±0.121)17.889<0.001 RANTES mRNA 1.00±0.10 2.64±0.231)19.617<0.001 TARC mRNA 1.00±0.09 1.56±0.131)10.625<0.001 IL-6/(pg·ml-1)163.50±12.84 200.61±13.601)5.952<0.001 IL-4/(pg·ml-1)52.87±5.39 86.48±6.921)11.495<0.001
3 讨论
银屑病是临床上常见的有遗传背景的慢性炎症性皮肤疾病,以红色丘疹、银白色鳞屑皮损为主要表现[10]。近年来,角质形成细胞在银屑病进展中的作用逐渐被揭示,其可分泌大量炎症因子,促进炎症反应,加速疾病进展[11]。已经发现有多种细胞因子在银屑病皮损组织中高表达,并可诱导角质形成细胞分泌更多炎症因子和细胞因子[12]。TNF-α和IFN-γ 具有诱导角质形成细胞损伤的作用,其也是常见的体外构建银屑病角质形成细胞模型的诱导因子。既往研究发现,TNF-α 和IFN-γ 刺激后的角质形成细胞分泌的炎症因子如IL-6、IL-4、IL-13等的表达水平升高,且趋化因子如Eotaxin、RANTES、TARC 的表达水平也升高[13]。IL-6、IL-4、IL-13 等炎症因子能够加重炎症反应,诱导组织损伤。人体组织中有多种趋化因子,其可激活并趋化白细胞,促进组织炎症发生[14-15]。本研究结果显示,TNF-α 和IFN-γ 刺激后的HaCaT 细胞分泌的IL-6、IL-4、IL-13水平增加,细胞中Eotaxin、RANTES、TARC表达水平升高,提示体外银屑病HaCaT细胞模型构建成功。
川芎最初记载于《神农本草经》,归胆、肝、心包经,味辛、性温,川芎嗪是从川芎内提取出来的生物碱单体,具有抗炎、抗氧化等功效[16]。有研究显示,川芎嗪对心肌缺血再灌注、关节炎软骨细胞等有保护作用,其可降低组织细胞中炎症因子水平,抑制炎症反应[7,17]。既往研究发现,川芎嗪对HaCaT 细胞中促银屑病因子FGF10有抑制功效[6]。川芎嗪腹腔注射后的银屑病小鼠皮损程度有所缓解[5]。本实验表明,川芎嗪能够降低银屑病HaCaT 细胞模型分泌炎症因子水平,减少细胞中趋化因子Eotaxin、RANTES、TARC 表达,提示川芎嗪可能通过抑制角质形成细胞分泌促炎因子阻碍银屑病进程,与既往研究报道相符,说明川芎嗪具有抗银屑病作用。
NF-κB 最早发现于B 细胞,后续发现NF-κB 参与黏附因子、炎症因子、生长因子等的表达,其也被认为是免疫及炎症反应的中心枢纽,NF-κB 激活后不仅能够诱导下游炎症因子如IL-6、IL-4、IL-13的表达,还可通过促进趋化因子如Eotaxin、RANTES、TARC 的表达趋化白细胞,促进组织炎症发生[18]。目前在哺乳动物体内发现了多种NF-κB 信号亚单位,这些成员均有Rel 同源区域,它们通过形成二聚体影响基因的转录过程[19]。p65 是经典NF-κB 信号转导必不可少的亚单位[20]。IκBα 是NF-κB 的抑制蛋白,其可与NF-κB 结合抑制NF-κB 的活性[21-22]。既往研究表明,NF-κB在银屑病进展中过度活化,其活性升高后促进角质形成细胞促炎因子分泌,而抑制NF-κB 具有保护银屑病角质形成细胞的作用[23-24]。本研究发现,银屑病HaCaT 细胞模型中p65蛋白表达水平升高,IκBα 蛋白表达水平降低,而川芎嗪能够降低p65 蛋白表达水平,促进IκBα 蛋白表达,说明川芎嗪的作用机制可能与NF-κB 有关。既往研究证实,川芎嗪的抗炎作用与NF-κB 有关,其可降低NF-κB 激活水平,抑制LPS 诱导的关节软骨细胞炎症损伤,后续在心肌缺血再灌注中也发现川芎嗪的作用机制与NF-κB 有关[7,17]。本研究进一步观察发现,NF-κB 信号激活剂逆转川芎嗪对银屑病HaCaT 细胞模型促炎因子表达作用,川芎嗪参与银屑病进展与NF-κB 信号有关,与既往研究结果相符,均说明川芎嗪的药理作用与NF-κB信号有关。
综上,川芎嗪在银屑病进展中发挥抑制作用,其可在体外减少银屑病HaCaT 细胞模型分泌炎症因子和表达趋化因子,且其机制与NF-κB 信号有关。目前对于川芎嗪通过何种机制调控NF-κB 进而影响银屑病HaCaT 细胞炎症尚不明确,课题组在以后的实验中会进行具体探讨。本实验为川芎嗪治疗银屑病的临床应用提供了资料,为进一步研究川芎嗪在银屑病中的作用机制奠定了基础。

