倾向性评分匹配法辅助评估不同肿瘤细胞减灭术治疗上皮性卵巢癌的效果
张利珍,周传亚,张新丽
濮阳市妇幼保健院妇科,河南 濮阳4570000
上皮性卵巢癌(epithelial ovarian cancer,EOC)的主要治疗方法是肿瘤细胞减灭术联合化疗,目的是尽可能切除全部原发瘤和转移瘤,抑制肿瘤进展,从而延长患者的生存时间[1]。但早期EOC 的诊断率较低,多数EOC 患者确诊时已处于中晚期,常伴有多器官转移,初始肿瘤细胞减灭术(primary debulking surgery,PDS)难以获得较高的减瘤满意率,临床获益有限[2]。研究显示,间歇性肿瘤细胞减灭术(interval debulking surgery,IDS)可对减瘤不满意的患者进行二次减瘤手术,可以提高EOC 患者的减瘤满意率[3-4]。但也有研究表明,IDS 并不能延长EOC 患者的生存时间,没有证据支持IDS 的效果更优[5]。由于EOC 治疗效果容易受多种因素影响,如病灶大、转移广泛等,目前,IDS 治疗EOC患者的整体效果是否优于PDS 尚存在争议。倾向性评分匹配可以考虑多种匹配因素,减少除研究因素外其他因素的干扰,减少混杂偏倚,提高研究价值[6]。本研究探讨比较PDS 与IDS 治疗EOC 的效果,并通过倾向性评分匹配法减少数据偏倚,为后续EOC 患者治疗方案的选择提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2015 年8 月至2020 年8 月濮阳市妇幼保健院收治的EOC 患者。纳入标准:①符合《中华妇产科学(第3 版)》[7]中EOC 的诊断标准;②原发肿瘤;③国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期[8]为Ⅲ~Ⅳ期;④临床资料完整;⑤卡氏功能状态(Karnofsky performance status,KPS)评分[9]>60 分。排除标准:①治疗后复发或转移性EOC;②合并其他恶性肿瘤;③合并心、肝、肾等重要脏器功能障碍;④合并感染性疾病、免疫系统疾病。依据纳入和排除标准,本研究共纳入163 例EOC 患者,依据治疗方法不同分为观察组(n=75)和对照组(n=88),观察组患者给予IDS 治疗,对照组患者给予PDS 治疗,倾向性评分采用1∶1 最邻近匹配法、Match Tolerance(用来设置倾向性评分匹配标准)为0.02 对患者进行匹配,最终成功匹配两组47 对。倾向性评分匹配后,两组患者年龄、妊娠次数和分娩次数等临床特征比较,差异均无统计学意义(P>0.05)(表1),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。

表1 倾向性评分匹配后两组患者的临床特征
1.2 治疗方法
依据2013 年美国国家癌症综合网络(National Comprehensive Cancer Network,NCCN)卵巢癌临床实践指南[10]进行肿瘤细胞减灭术治疗。对照组患者实施肿瘤细胞减灭术后,给予6~8 个疗程的化疗。观察组患者实施肿瘤细胞减灭术后,给予3~5个疗程的化疗,然后再次给予肿瘤细胞减灭术和3~5 个疗程的化疗。化疗方案首选紫杉醇+顺铂(TP)方案,出现耐药则替换为异环磷酰胺+表柔比星+奥沙利铂(IAP)方案,3 周为1 个疗程。
1.3 观察指标和评价标准
①参考《中华妇产科学(第3 版)》[7]评估两组患者的减瘤满意率:满意,完全切除肿瘤或单个残留肿瘤最大直径≤1 cm;不满意,单个残留肿瘤最大直径>1 cm。②依据实体瘤疗效评价标准1.1(response evaluation criteria in solid tumor 1.1,RECIST 1.1)[11]评估两组患者的临床疗效:完全缓解(complete response,CR),所有目标病灶完全消失并维持4 周;部分缓解(partial response,PR),病灶最大直径和基线相比缩小≥30%,且维持4 周;疾病进展(progressive disease,PD),病灶最大直径和基线相比增大>20%或出现新病灶;疾病稳定(stable disease,SD),介于PR 与PD 之间。总有效率=(CR+PR)例数/总例数×100%。③治疗前、治疗完成时,分别采集患者5 ml 空腹静脉血,4000 r/min 离心10 min,离心半径为10 cm,化学发光免疫法和酶联免疫吸附测定检测两组患者血清肿瘤标志物水平,包括糖类抗原125(carbohydrate antigen 125,CA125)、人附睾上皮分泌蛋白4(human epididymis protein 4,HE4)、血管内皮生长因子(vascular endothelial growth factor,VEGF)水平。④比较两组患者的不良反应发生情况,包括骨髓抑制、胃肠道反应、周围神经损伤、肝肾功能不全。⑤采用患者回院复查的方式对患者进行为期1 年的随访,复发根据影像学检查、血清肿瘤标志物检测结果评估,记录两组患者的复发情况,影像学检查可见卵巢原有病灶增大或出现新的病灶、血清肿瘤标志物水平升高判断为复发。
1.4 统计学方法
采用SPSS 25.0 软件对所有数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验;计量资料均经Shapiro-Wilk 进行正态性检验,正态分布计量资料以均数±标准差(±s)表示,比较采用配对t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 减瘤满意率的比较
观察组患者的减瘤满意率为76.60%(36/47),高于对照组患者的53.19%(25/47),差异有统计学意义(χ2=5.650,P=0.017)。
2.2 临床疗效的比较
观察组患者的临床疗效明显优于对照组,差异有统计学意义(Z=2.619,P=0.009)。观察组患者的治疗总有效率为78.72%(37/47),明显高于对照组患者的53.19%(25/47),差异有统计学意义(χ2=6.823,P=0.009)。(表2)
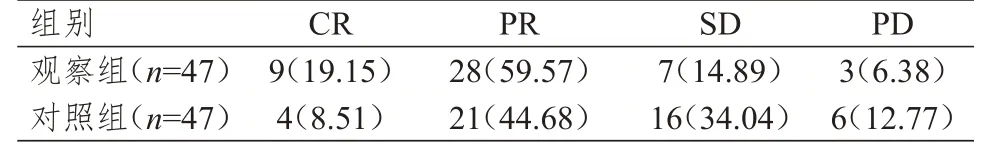
表2 两组患者的临床疗效[n(%)]*
2.3 肿瘤标志物水平的比较
治疗前,两组患者CA125、HE4、VEGF 水平比较,差异均无统计学意义(P>0.05)。治疗完成时,两组患者CA125、HE4、VEGF 水平均明显低于本组治疗前,且观察组患者CA125、HE4、VEGF 水平均明显低于对照组,差异均有统计学意义(P<0.01)。(表3)
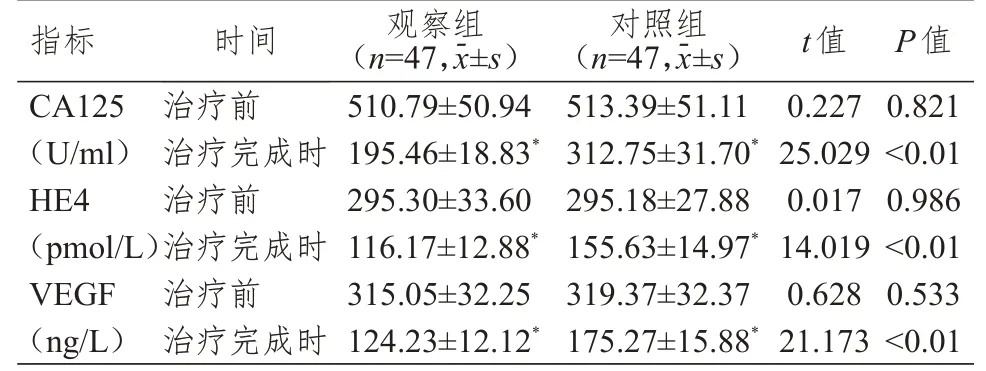
表3 治疗前和治疗完成时两组患者血清肿瘤标志物水平的比较
2.4 不良反应发生情况的比较
观察组患者的不良反应总发生率为25.53%(12/47),明显低于对照组患者的55.32%(26/47),差异有统计学意义(χ2=8.658,P=0.003)。(表4)

表4 两组患者的不良反应发生情况[n(%)]
2.5 复发情况的比较
随访1年,观察组患者的复发率为2.13%(1/47),与对照组患者的6.38%(3/47)比较,差异无统计学意义(χ2=0.261,P=0.609)。
3 讨论
EOC 确诊时多已进展至中晚期,治疗难度较大,特别是对于已经发生了远处转移的患者,手术根治率较低[12]。肿瘤细胞减灭术联合辅助化疗是EOC 患者常用的治疗方法,旨在尽可能切除肿瘤,改善预后[13]。但目前常规PDS 治疗的减瘤满意率较低,治疗效果不够理想。因此,探索一种有效的治疗措施,对改善EOC 患者的预后有重要意义。
IDS 可间歇性进行两次肿瘤减灭术,初次肿瘤减灭术后进行化疗,以缩小肿瘤体积,再次通过肿瘤减灭术尽可能地根治性切除肿瘤[14]。有研究发现,IDS 相较于PDS 提高了减瘤满意率[15]。但受多种混杂因素的影响,IDS 治疗EOC 的效果是否优于PDS 临床尚存在争议。本研究经倾向性评分匹配后,两组患者年龄、妊娠次数和分娩次数等临床特征均无明显差异,本研究通过倾向性评分匹配法,排除了以上因素的干扰,减少了数据偏倚,提高了研究结果的可信度。
本研究结果显示,观察组患者的临床疗效优于对照组,减瘤满意率高于对照组,这可能是因为IDS 可以在第二次肿瘤减灭术前通过化疗缩小了肿瘤体积、减小了手术范围,降低了手术难度,可提高减瘤满意率[16]。IDS 可减少肿瘤与正常组织间的粘连,降低肿瘤负荷,从而更好地发挥肿瘤减灭术的效果,提高了减瘤满意率和临床疗效[17]。
CA125、HE4、VEGF 是EOC 临床常见的肿瘤标志物,其中,CA125 在正常卵巢组织中不表达,在上皮性卵巢癌组织中高表达,诊断EOC 的灵敏度较高[18];HE4 主要表达于生殖系统上皮组织,在卵巢癌组织中高表达[19];VEGF 可参与肿瘤新生血管生成,与肿瘤细胞的增殖、分化、迁移有关,可反映肿瘤的恶性程度[20]。本研究结果显示,治疗完成时,两组患者CA125、HE4、VEGF 水平均明显低于本组治疗前,且观察组均明显低于对照组。表明IDS 治疗EOC 的总体肿瘤细胞清除程度可能更高。分析原因可能为:IDS 治疗在第二次肿瘤减灭术术前进行化疗可以有效杀灭微小肿瘤转移灶,减少肿瘤负荷,降低肿瘤恶性程度,从而降低了肿瘤标志物水平[21]。在IDS 第二次肿瘤减灭术前化疗,可以通过化疗药物抑制EOC 细胞的活性,诱导EOC 细胞进入休眠状态,可抑制肿瘤细胞的增殖、扩散和转移,从而降低肿瘤标志物水平[22]。
本研究结果显示,IDS 联合辅助化疗可减少EOC 患者不良反应,这可能是因为IDS 治疗方案的单次化疗时间相对较短,从而减轻了不良反应。此外,随访1 年,本研究两组患者的复发率无明显差异,这也可能与本研究纳入的病例数较少有关。因此,未来应继续进一步扩大样本量,进一步探索两种肿瘤减灭术对EOC 患者的影响;同时延长随访时间,以进一步分析两种肿瘤减灭术对EOC 患者的中远期影响。
综上所述,与PDS 相比,IDS 可明显提高EOC患者减瘤满意率,改善临床疗效,降低肿瘤标志物水平,减少不良反应。倾向性评分匹配法减少了数据偏倚,提高了研究结果的可信度。

