冬凌草吸附法分离富集溶液中的Pb2+
左国强,张晓杰,宋欣宇,张露露
(济源职业技术学院 材料工程学院,河南 济源 459000)
在环境保护领域,重金属离子铅属于持久性污染物,能持久存在于环境中,并通过生物、食物链累积对人类健康造成严重影响,因此对重金属离子铅的分离富集工作长期受到人们的关注。
重金属离子Pb2+的分离富集方法主要有离子交换法[1]、吸附法[2]、电解法[3]、膜分离技术[4]等,这些方法虽处理效率高,但成本较高且操作过程复杂,易造成二次污染[5]。与之相比,生物吸附法因不仅具备传统吸附剂的优良性能,同时具有环境友好的特点,近年来成为国内外学者研究的热点[6-8]。生物吸附剂按其来源主要分为微生物和农业废弃物两大类,农业废弃物由于含有大量的吸附活性基团,因此,对重金属具有良好的吸附作用。文献[9-11]分别以秸秆类农业废弃物、绿茶、废弃茶叶渣作为废水中Pb2+的吸附材料,不仅使重金属污染水体得以净化,而且实现了废弃物的资源化利用,达到了以废治废的目的。
冬凌草为唇形科植物碎米桠的干燥地上部分,广泛分布于黄河流域及以南的广大地区,以河南省为主产地。目前,对冬凌草的研究主要集中在医学上,用于治疗咽喉肿痛、扁桃体炎、蛇虫咬伤及食道癌等疾病,而能否对废水中的重金属离子Pb2+有良好的去除效果还少有报道。本文以河南济源产冬凌草颗粒作为吸附剂,通过批量的吸附试验探究其在不同酸度、温度、吸附时间、冬凌草用量和初始浓度条件下对废水中Pb2+的吸附行为,为废水中重金属离子Pb2+的分离提供了一种新的思路,同时也为冬凌草的高值化利用提供理论依据。
一、试验设备及方法
(一)主要仪器和试剂
PHS-3C型酸度计(上海仪电科学仪器股份有限公司),JJ-1型精密增力电动搅拌器(常州金坛区西城新瑞仪器厂),电子恒温水浴锅(北京中兴伟业仪器有限公司),FW100高速粉碎机(天津市泰斯特仪器有限公司),Scios2型扫描电子显微镜(美国Thermofisher Scientific公司),Thermo Nicolet IS10型红外光谱分析仪(美国赛默飞公司),Micromeritics ASAP 2460比表面与孔隙度分析仪(美国micromeritics公司),XYD2-60-H纯水仪(北京湘顺源科技有限公司),TAS-990原子吸收分光光度计(北京普析通用仪器有限责任公司),仪器工作条件见表1。

表1 原子吸收光谱仪工作条件
Pb2+标准储备溶液(中国计量科学研究院):1000 mg/L,使用时逐级稀释到所需浓度;冬凌草(外购于济源市九里沟冬凌草专业合作社);HCl溶液:0.1 mol/L;NaOH溶液:0.1 mol/L,NaOH、HCl均为分析纯,试验用水为超纯水。
(二)吸附剂制备
将外购的冬凌草放入50 ℃温水中浸泡30 min,取出后用超纯水连续冲洗3次,然后在恒温干燥箱中以60 ℃加热12 h,将烘干后的冬凌草粉碎,过100目筛,装于样品袋内放入干燥器中备用。
(三)吸附试验
移取一定量的10 mg/L的Pb2+溶液于500 mL烧杯中,用0.1 mol/L HCl溶液或0.1 mol/L NaOH溶液调节到不同的酸度,移取100 mL一定酸度的Pb2+溶液于250 mL三口烧瓶中,准确加入一定量的冬凌草颗粒,恒温下机械搅拌30 min,过滤,利用原子吸收光谱仪测定滤液中Pb2+的浓度,通过标准曲线法仪器自动读出滤液中Pb2+的浓度。采用公式(1)计算Pb2+的吸附率E%,采用公式(2)计算Pb2+的吸附容量Q(mg/g)。
(1)
(2)
式中:c0为Pb2+的初始浓度,mg/L;c为滤液中Pb2+的浓度,mg/L;V为溶液的体积,mL;m为冬凌草颗粒的质量,g。
(四)吸附等温模型
冬凌草颗粒对Pb2+的等温吸附机制采用Langmuir方程和Freundlich方程进行拟合,分别见式(3)、式(4):
(3)
(4)
式(3)、式(4)中,Ce为平衡浓度,mg/L;Qe为平衡吸附量,mg/g;Qm为饱和吸附量,mg/g;KL为Langmuir吸附平衡常数,KF为Freundlich吸附系数;n为Freundlich常数。
(五)材料表征
冬凌草颗粒形貌特征采用扫描电子显微镜(SEM)进行测试,测试条件为加速电压10 kV,放大倍数为1000倍;样品与KBr(光谱纯)按1∶200的比例充分研磨混合压片后,用Thermo Nicolet IS10傅里叶变换红外光谱仪分析测定冬凌草颗粒表面官能团,分辨率为2 cm-1,扫描区域为500~4000 cm-1;冬凌草颗粒的比表面积、孔体积及孔径采用BET法测定,吸附介质为液氮。
二、结果与讨论
(一)冬凌草颗粒的表征
1.扫描电镜(SEM)分析
图1为冬凌草颗粒从不同的角度放大1000倍的SEM图。由图1可见,冬凌草颗粒表面粗糙,表层不规整,有很多细长不规则凹槽,颗粒中间有一些狭长孔道,这些孔道和凹槽为植物组织固有的细胞结构,这为重金属离子的吸附提供了空间。

图1 冬凌草颗粒的SEM图
2.冬凌草颗粒的比表面与孔隙度分析
图2为冬凌草颗粒的孔径分布图。依据BJH模式计算出的冬凌草的平均孔径D约为5.32 nm,由此可见,冬凌草颗粒的孔径主要分布在中孔区域,采用BET模式计算出的冬凌草颗粒的比表面积约为2.64 m2/g,冬凌草的中孔构成了材料的吸附通道,为重金属离子的吸附提供了空隙。
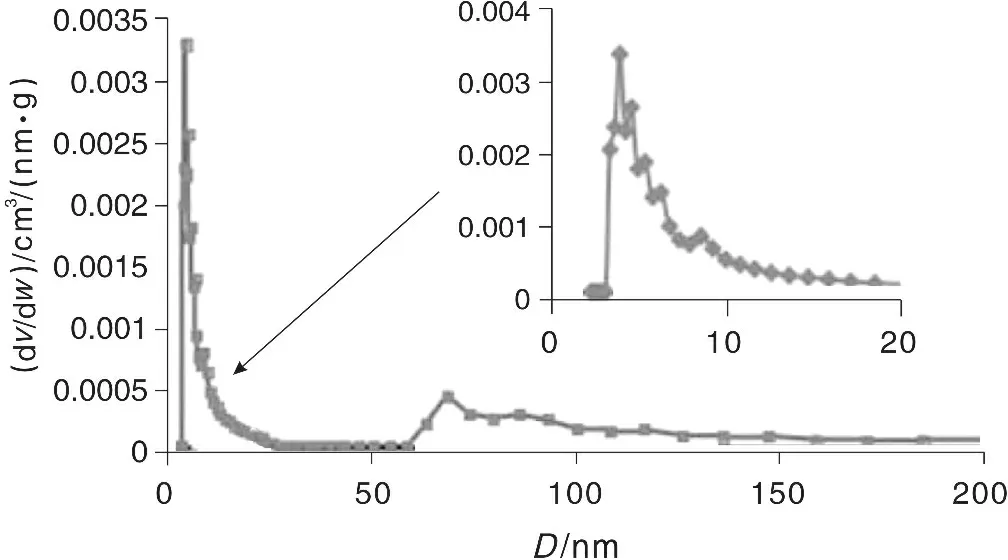
图2 冬凌草颗粒的孔径分布图
3.冬凌草颗粒红外光谱分析
图3为冬凌草颗粒的红外光谱图(FT-IR)。由图3可见,3330 cm-1处的宽且强的吸收峰是—OH的伸缩振动峰,2856 cm-1处的峰为—CH2的不对称伸缩振动峰,1650 cm-1处的峰为C=O的伸缩振动峰,1029 cm-1处的峰为—OH的振动和C—O—C的伸缩振动引起的,这说明了冬凌草中含有—OH和—COOH。

图3 冬凌草颗粒红外光谱分析
(二)酸度对Pb2+吸附率的影响
为研究酸度对吸附率的影响,固定三口烧瓶中Pb2+溶液的体积为100 mL,分别调节到不同的pH,其余操作同试验设备及方法中的(三)吸附试验。当溶液pH较高时,Pb2+多以Pb(OH)2沉淀形式存在,因此本试验控制体系的酸度为pH=2~6,结果如图4所示。由图4可见,酸度对Pb2+的吸附率影响较大,当pH=2时,吸附率仅为50.2%,这说明,强酸性环境不利于冬凌草对Pb2+的吸附,这可能是由于冬凌草的化学成分主要有:5,4′—二羟基—6,7,8,3′—四甲氧基黄酮、冬凌草乙素、冬凌草甲素、香草酸、阿魏酸、咖啡酸、槲皮素等[12],这些物质中含有羟基、羧基等活性基团,这些活性集团在较高的酸度下,难以电离,进而影响Pb2+与羟基氧的络合。随着体系pH值的增大,吸附率不断升高,当pH=4~6时,吸附率均为100%,这是由于溶液中的重金属离子Pb2+与冬凌草颗粒表面羟基、羧基电离的H+发生了离子交换作用,冬凌草吸附了Pb2+而释放出H+,如式(5)、(6)所示。综合考虑,本试验选择体系的酸度为pH=5。
R(OH)2+Pb2+→R(O)2—Pb+2H+,
(5)
R—(COOH)2+Pb2+→R—(COO)2—Pb+2H+。

(6)
(三)吸附时间对Pb2+吸附率的影响
为研究吸附时间对吸附率的影响,固定三口烧瓶中Pb2+溶液的体积为100 mL,控制体系的酸度为pH=5,每隔15 min检测一次体系中Pb2+的浓度,其余操作同试验设备及方法中的(三)吸附试验。试验结果如图5所示。由图5可见,当搅拌时间为15 min时,Pb2+的吸附率即可达到87.2%,继续增大搅拌时间,吸附率进一步升高,当t=30 min时,吸附率为95.2%,此后,吸附率不再发生明显变化。这主要是由于吸附刚开始进行时,冬凌草颗粒表面的吸附空位较多,反应可以快速发生,但随着反应的进行,冬凌草颗粒表面吸附的Pb2+与溶液中的Pb2+产生静电斥力作用,冬凌草颗粒对Pb2+的吸附也就越来越困难,最终趋于平衡。相对于秸秆类农业废弃物[9]、绿茶[10]、废弃茶叶渣[11],冬凌草对体系中的Pb2+吸附速度明显较快。综合考虑,本实验选择搅拌时间为30 min。
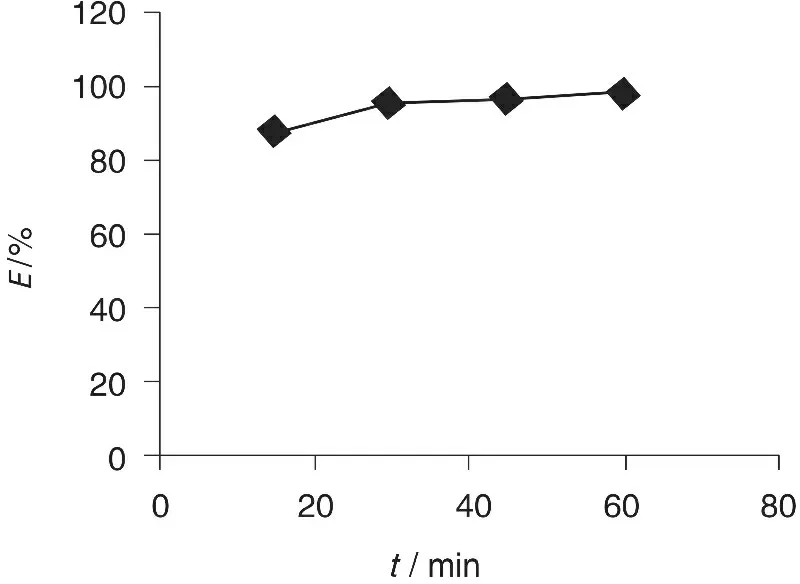
图5 Pb2+的吸附动力学曲线
(四)冬凌草用量对Pb2+ 吸附率的影响
为研究冬凌草用量对吸附率的影响,固定三口烧瓶中Pb2+溶液的体积为100 mL,分别加入不同量的冬凌草,其余操作同试验设备及方法中的(三)吸附试验。试验结果表明,当冬凌草的用量为0.1 g时,吸附率为81.5%,随着冬凌草颗粒用量的增加,吸附率逐渐增加,这是由于冬凌草颗粒用量的增加,能够起到吸附作用的—OH、—COOH的量也相应增多,吸附率也就不断增大。当冬凌草的用量为0.2 g时,吸附率达到98%,可以满足微痕量金属离子分离富集要求,综合考虑,本试验控制冬凌草的用量为0.2 g。
(五)温度对Pb2+吸附率的影响
试验表明,控制冬凌草的用量为0.2 g,搅拌时间为30 min,溶液的pH=5,当Pb2+的初始浓度为50 mg/L以下时,吸附率都在98%以上,温度对吸附率的影响表现不明显。因此,本试验固定Pb2+的初始浓度为100 mg/L,控制水浴温度分别为20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃,其余操作同试验设备及方法中的(三)吸附试验。研究温度对Pb2+吸附率的影响,结果如图6所示。由图6可见,当温度较低时(20 ℃时),吸附率变化较小,如在20~40 ℃范围内,吸附率都在95%以上,随着温度的升高,吸附率略有下降,这可能是由于在低温时,冬凌草颗粒对Pb2+的吸附主要是物理吸附,吸附速率快,并且不受温度影响,当温度升高到一定值时,冬凌草颗粒对Pb2+的吸附由物理吸附过渡到化学吸附,由于化学吸附是放热反应,因此,温度升高,吸附率下降[13]。这与绿茶对水溶液中的Pb2+和Cd2+的吸附规律相一致[10]。当温度升高到70 ℃时,吸附率降低为91.7%,难以满足微痕量元素的分离富集要求,综合考虑,本试验控制吸附温度为室温25 ℃左右最为经济。

图6 温度对吸附率的影响
(六)Pb2+初始浓度对冬凌草颗粒吸附容量的影响
固定冬凌草颗粒的用量为0.2 g,分别使用不同浓度的Pb2+溶液,调节溶液的pH=5,在不同的温度下,分别进行吸附试验,计算吸附容量,考察Pb2+初始浓度对吸附容量的影响,结果如图7所示。由图7可见,同一温度下,随着Pb2+初始浓度的增大,冬凌草颗粒对Pb2+的吸附容量也随之升高,而后逐渐趋于稳定,这是由于试验中冬凌草颗粒表面羟基、羧基等活性点位是一定的,当Pb2+溶液初始浓度较低时,冬凌草颗粒能够完全吸附,当Pb2+初始浓度升高到一定值时,冬凌草颗粒表面的活性点位被完全利用,吸附容量达到最大且保持稳定。
由图7还可以看出,在不同的温度下,体系达到吸附平衡时,Pb2+溶液的初始浓度值不一样,30 ℃、50 ℃时,吸附达到平衡时Pb2+的初始浓度值约为250 mg/L,70 ℃时,这一值降低为150 mg/L,这进一步说明了升高温度对冬凌草颗粒的吸附不利,这可能是由于高温时冬凌草颗粒对Pb2+的吸附以化学吸附为主,温度的影响就更为明显。经计算,30 ℃、50 ℃、70 ℃时,冬凌草颗粒对Pb2+的吸附容量分别为83.58 mg/g、78.38 mg/g、61.63 mg/g,远大于钱国勇等人[10]报道的绿茶对Pb2+的吸附容量(46.66 mg/g)。
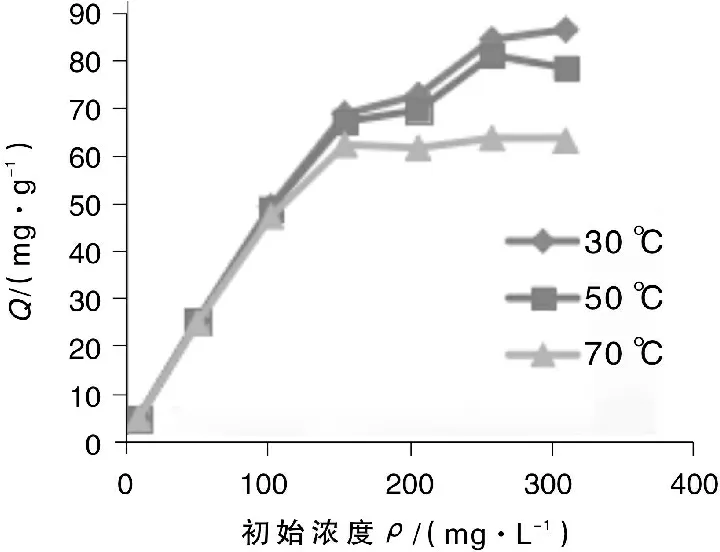
图7 冬凌草吸附Pb2+的等温曲线
(七)等温吸附模型
冬凌草颗粒吸附Pb2+的等温吸附数据通过Langmuir和Freundlich模型进行拟合,结果如表2所示。Langmuir等温吸附方程的拟合决定系数R2都大于0.99,而Freundlich等温吸附方程的拟合决定系数R2小于0.94,通过Langmuir等温吸附方程计算得到的理论饱和吸附量也与试验中的最大吸附量基本一致,这表明冬凌草颗粒对Pb2+的吸附更符合Langmuir等温吸附方程,吸附以单层吸附为主。由于物理吸附没有选择性,既可以是单分子层也可以是多分子层,而化学吸附具有选择性,为单分子层[14],因此,冬凌草颗粒吸附溶液中Pb2+的吸附机理是单分子层的物理吸附和化学吸附。由表2还可以看出,饱和吸附量Qmax随着温度的升高而降低,这说明升温不利于吸附反应的进行,这与上述分析的温度对Pb2+吸附率的影响相一致。

表2 冬凌草颗粒吸附Pb2+的Langmuir和Freundlich等温方程拟合参数
(八)冬凌草颗粒应用潜力
不同材料对模拟废水中Pb2+的吸附量对比见表3。由表3可见,本研究所用冬凌草对模拟废水中Pb2+的吸附量虽低于西红柿秆和磁性壳聚糖/硅藻土,但高于绿茶、草莓秆、茶叶渣、松木锯末和玉米秸秆等生物基质材料,具有一定的应用潜力。
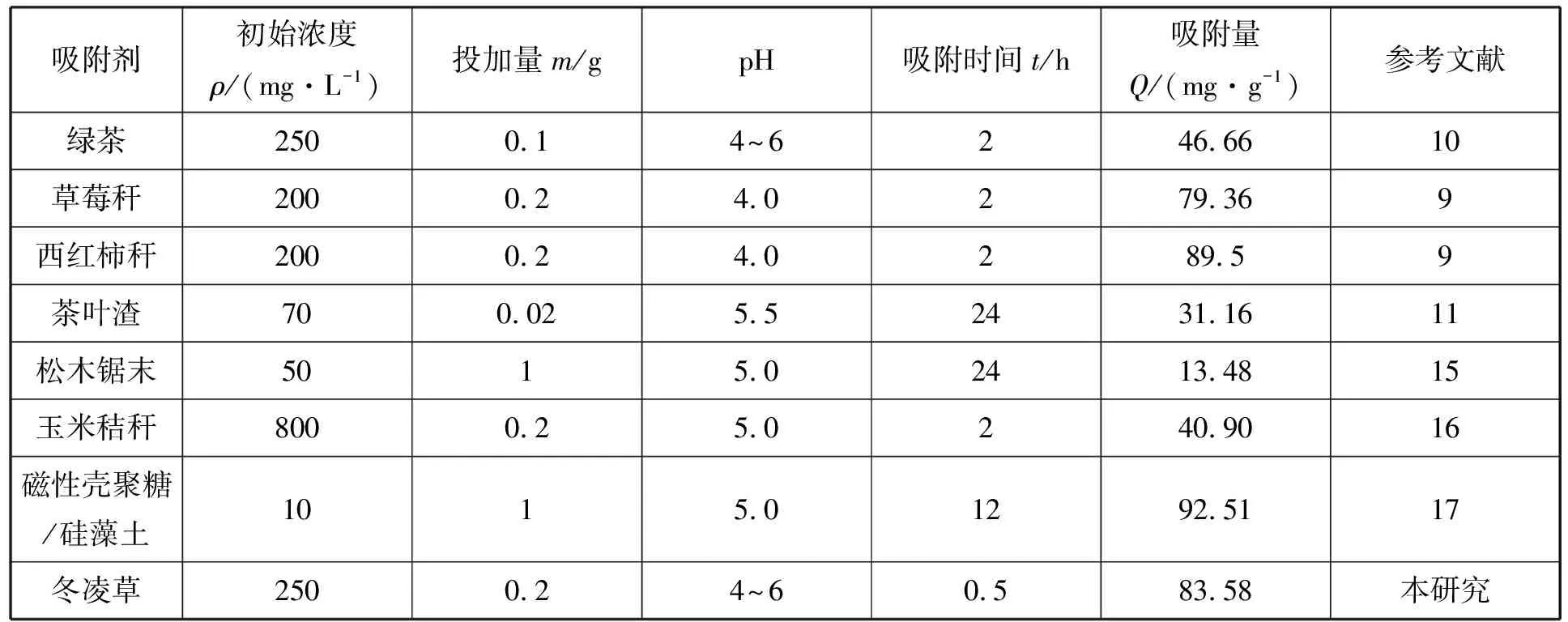
表3 不同材料对模拟废水中Pb2+的吸附量对比
三、结论
采用冬凌草颗粒为吸附剂,在较为温和的条件下,实现了环境中微痕量重金属离子Pb2+的吸附分离,室温下,控制溶液的pH=4~6,在100 mL质量浓度为 10 mg/L的Pb2+溶液中加入0.2 g冬凌草,机械搅拌30 min,98%的Pb2+可被冬凌草吸附除去,冬凌草颗粒对Pb2+的吸附容量可以达到83.58 mg/g。该方法具有材料来源丰富、价格低廉、操作简单、易于推广等优点,为环境中重金属离子的吸附分离提供了一种新的方法。

