氧化应激促进重组腺相关病毒2型体外转导分析
王晓, 黄晓平, 黎玲, 刘嘉, 刁勇
(1. 华侨大学 医学院, 福建 泉州 362021; 2. 泉州师范学院 化工与材料学院, 福建 泉州 362000)
腺相关病毒(adeno-associated virus,AAV)是一种无包膜、单链的DNA病毒,需要腺病毒或单纯疱疹病毒辅助才可进行复制,AAV基因组可以在细胞和组织中长期存在,迄今未发现AAV与任何人类疾病相关[1-2].而重组AAV(recombinant adeno-associated virus,rAAV)载体,因具有免疫原性小、宿主范围广、理化性质稳定、能长期表达外源基因等优点,被公认为是基因治疗的理想载体[3-4].2017年12月,以rAAV为载体治疗遗传性视网膜病变的基因药物Luxturna在美国上市,这无疑给以rAAV为载体的基因治疗带来了前所未有的光明[5-7].
但在临床实验中,rAAV也遇到表达效率低的问题,提高rAAV的表达效率成为基因治疗领域需解决的一个问题[8-9].血清型筛选、衣壳蛋白突变和修饰、基因组改造等生物技术在提高表达效率方面取得了一定进展[10-11].除了生物技术策略外,现已有多种非生物技术策略可提高rAAV载体表达效率,如DNA损伤剂(紫外线、γ-射线、顺铂)、泛素蛋白酶体抑制剂(MG132,LnLL)、DNA合成酶抑制剂(巴菲敌柯林、羟基脲)、DNA拓扑异构酶抑制剂(喜树碱、依托泊苷)等[12-14].这些手段可以影响rAAV载体在细胞质内的传递,或影响其在核内的行为,在表达效率优化方面表现出了良好的应用前景.
氧化应激会造成生物膜不饱和脂肪酸过氧化、DNA损伤等,而DNA损伤剂已证实可促进rAAV转导,但氧化应激促进rAAV转导的机制目前尚未研究清楚.在细胞中,过氧化氢(H2O2)的初始产物通常认为是活性氧(ROS)或超氧阴离子,H2O2也被认为是活性氧中间体(ROI)介导的细胞损伤的关键物质.H2O2产物羟基自由基(HO·)可以氧化DNA、蛋白质和膜脂质,导致细胞损伤.本文以重组腺相关病毒2型(rAAV2)为材料,研究H2O2和铁过载(Fe-NTA)处理前、后,细胞中rAAV2转基因表达量、阳性细胞数和基因组数目的变化,从ROS角度揭示氧化应激促进rAAV2转导的分子机制.
1 材料与方法
1.1 材料
聚乙烯亚胺(PEI,美国Polysciences公司);蛋白罗丹明标记试剂盒(上海生工生物工程股份有限公司);超氧化物阴离子荧光探针(Dihydroethidium,美国Invitrogen公司);硝酸铁(Fe(NO3)3)、次氮基三乙酸(NTA)、H2O2(美国Amresco公司);DMEM培养基、1640培养基、胎牛血清(美国Gibco公司);核酸酶Benzonase(德国Merk公司);DNeasy Blood & Tissue试剂盒(德国QIAGEN公司);Sybr Green Master Mix(南京诺唯赞生物科技股份有限公司).
1.2 rAAV2载体的制备
参照本实验室的rAAV制备方法[15-16]:待293T细胞密度达到85%时,将三质粒与PEI按照质量比为1∶3进行混合后共转染293T细胞;转染72 h后收获细胞,裂解并用Benzonase处理;氯化铯密度梯度离心分离、透析和浓缩制备符合实验要求的rAAV2载体;最后,进行实时荧光定量聚合酶链式反应(qPCR)分析.
1.3 rAAV2载体的标记
参考文献[17]的方法,利用蛋白罗丹明标记试剂盒对rAAV2进行四甲基罗丹明(TAMRA)的荧光标记,并用于共聚焦成像.将物质的量比为1∶5 000的rAAV2载体和mono-NHS-TAMRA分子在室温下孵育45 min,然后通过SpinOUT GT-600型色谱柱去除未结合的染料,再利用qPCR对rAAV2进行定量分析.H2O2刺激Hela细胞12 h后,TAMRA-rAAV2以感染复数(MOI)为1∶2 000转导Hela细胞,磷酸盐缓冲液(PBS)洗涤3次;采用质量浓度为0.04 g·mL-1的多聚甲醛固定15 min,PBS洗涤2次,再用双蒸水洗涤;最后,用4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)进行复染,利用Zeiss LSM 710型激光共聚焦显微镜分析TAMRA-rAAV2病毒载体的亚细胞定位.
1.4 转导实验
按照每孔1×105个将细胞接种至24孔板,根据设置的时间在转导前进行氧化应激,随后用表达荧光素酶(Gaussia luciferase,Gluc)或绿色荧光蛋白(green fluorescent protein,GFP)转基因的rAAV2进行转导,转导后利用IncuCyte实时动态细胞成像分析系统检测阳性细胞数、荧光强度或取上清测定Gluc的表达量.
1.5 rAAV2基因组提取和qPCR定量
rAAV2转导细胞12 h后,通过胰蛋白酶消化收集细胞,利用DNeasy Blood & Tissue试剂盒收集总DNA,采用qPCR方法分析rAAV2基因组数目,按照文献[18]的方法进行病毒基因组定量.以GFP(正向引物,5′-GAGCGCACCATCTTCTTCAA-3′;反向引物,5′-TCCTTGAAGTCGATGCCCTT-3′)、Gluc(正向引物,5′-AATGCCCGGAAAGCTGGCTG-3′;反向引物,5′-CGATGAACTGCTCCATGGGC-3′)、人β肌动蛋白(正向引物,5′-AGCGAGCATCCCCCAAAGTT-3;反向引物,5′-GGGCACGAAGGCTCATCATT-3′)为引物,以Sybr Green Master Mix为染料进行qPCR反应,反应条件为95 ℃,2 min,之后按95 ℃,10 s;60 ℃,10 s;72 ℃,10 s循环40次.
1.6 H2O2应激模型
以每孔4.0×103个细胞接种于96 孔板,细胞贴壁后,加入终浓度分别为25,50,100,200,400,800 μmol·L-1的H2O2,按照设定的时间进行rAAV2转导,利用IncuCyte实时动态细胞成像分析系统监测细胞中绿色荧光表达情况,统计分析阳性细胞数和荧光强度.
1.7 Fe-NTA应激模型
参照文献[19]的方法,取20 mL 100 mmol·L-1Fe(NO3)3溶液与20 mL 300 mmol L-1NTA溶液混合,用1 mol·L-1碳酸氢钠溶液调节至pH=7.4,定容至100 mL,配成20 mmol·L-1的Fe-NTA母液.以每孔4.0×103个细胞接种于96孔板,细胞贴壁后,加入终浓度分别为12.5,25.0,50.0,100.0,200.0,400.0 μmol·L-1的Fe-NTA溶液,按照设定的时间和MOI进行rAAV2转导,利用IncuCyte实时动态细胞成像分析系统监测细胞中绿色荧光表达情况,统计分析阳性细胞数和荧光强度.
1.8 细胞内ROS检测
细胞经过氧化应激和转导处理后,去除培养液,用PBS冲洗2 遍;然后,加入10 μmol·L-1超氧化物阴离子荧光探针(Dihydroethidium,DHE)工作液,37 ℃孵育60 min,用PBS清洗2 遍;荧光显微镜观察拍照,利用Image-Pro Plus软件进行荧光强度分析.
1.9 数据统计
所有数据用平均值±标准偏差(x±s)表示,结果采用SPSS统计学分析,*P<0.05表示差异具有统计学意义,**P<0.01表示差异极具统计学意义.
2 实验结果与分析
2.1 H2O2和Fe-NTA对细胞活力的影响
氧化应激对细胞活力的影响,如图1所示.图1中:c为浓度;η为细胞活力.
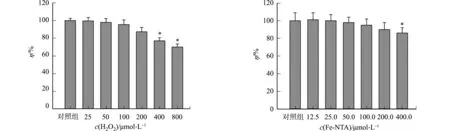
(a) H2O2 (b) Fe-NTA图1 氧化应激对细胞活力的影响Fig.1 Effect of oxidative stress on cell viability
由图1(a)可知:当加入的H2O2浓度c(H2O2)=400 μmol·L-1时,细胞活力为(86.3±4.3)%,与对照组相比,差异具有统计学意义;当c(H2O2)=800 μmol·L-1时,细胞活力为(65.7±3.9)%,与对照组相比,差异具有统计学意义;而当c(H2O2)=200 μmol·L-1时,细胞活力为(93.6±3.9)%,与对照组相比,差异无统计学意义.
由图1(b)可知:当c(Fe-NTA)=400.0 μmol·L-1时,细胞活力为(84.6±4.6)%,与对照组相比,差异具有统计学意义;而c(Fe-NTA)=200.0 μmol·L-1时,细胞活力为(92.9±5.4)%,与对照组相比,差异无统计学意义.
2.2 H2O2促进rAA2转导
不同细胞中添加H2O2对rAAV2转基因表达的影响,如图2所示.图2中:N1为不同H2O2浓度处理组rAAV2转基因表达量与对照组rAAV2转基因表达量的比值.由图2可知:H2O2能够促进rAAV2转基因在293T细胞中表达,随着H2O2浓度的增高,Gluc的表达量增大,与对照组相比,差异具有统计学意义.50 μmol·L-1组Gluc的表达量是对照组的1.4倍;100 μmol·L-1组Gluc的表达量是对照组的2.5倍;200 μmol·L-1组Gluc的表达量是对照组的3.6倍(图2(a)).在LO-2,Hela,A549细胞中,H2O2均能促进rAAV转基因的表达,与对照组相比,差异具有统计学意义(图2(b)~(d)).

(a) 293T细胞 (b) LO-2细胞
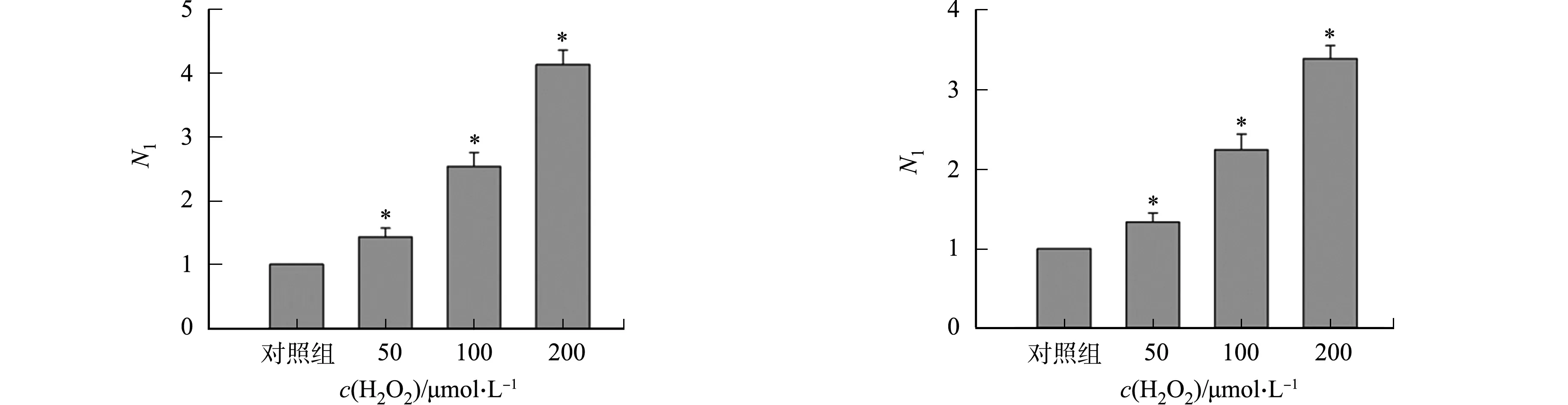
(c) Hela细胞 (d) A549细胞图2 不同细胞中添加H2O2对rAAV2转基因表达的影响Fig.2 Effects of adding H2O2 in different cells on rAAV2 transgene expression
不同H2O2浓度对rAAV2转导的影响,如图3所示.图3中:n为GFP阳性表达细胞数;N2为不同H2O2浓度处理组病毒基因组数与对照组病毒基因组数的比值.图3(a)~(e)为GFP阳性表达细胞及其数量的统计结果.由图3(e)可知:H2O2处理组阳性表达细胞数与对照组相比差异具有统计学意义;当H2O2浓度分别为50,100,200 μmol·L-1时,其阳性表达细胞数分别为(183±16),(248±22),(421±25)个·mm-2.rAAV转导细胞12 h后提取基因组的结果,如图3(f)所示.由图3(f)可知:H2O2氧化应激处理组的基因组数明显比对照组多;浓度为50,100,200 μmol·L-1H2O2处理组的基因组数分别是对照组的(1.55±0.21),(2.33±0.25),(3.28±0.25)倍.

(a) 对照组 (b) c(H2O2)=50 μmol·L-1

(c) c(H2O2)=100 μmol·L-1 (d) c(H2O2)=200 μmol·L-1
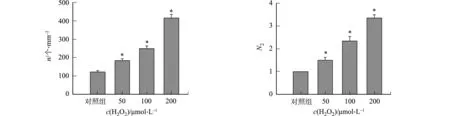
(e) 阳性细胞数 (f) 基因组数图3 不同H2O2浓度对rAAV2转导的影响Fig.3 Effects of different H2O2 concentrations on rAAV2 transduction
2.3 Fe-NTA氧化应激促进rAAV2转导
不同细胞中添加Fe-NTA对rAAV2转基因表达的影响,如图4所示.图4中:N3为不同Fe-NTA浓度处理组rAAV2转基因表达量与对照组rAAV2转基因表达量的比值.

(a) 293T细胞 (b) LO-2细胞
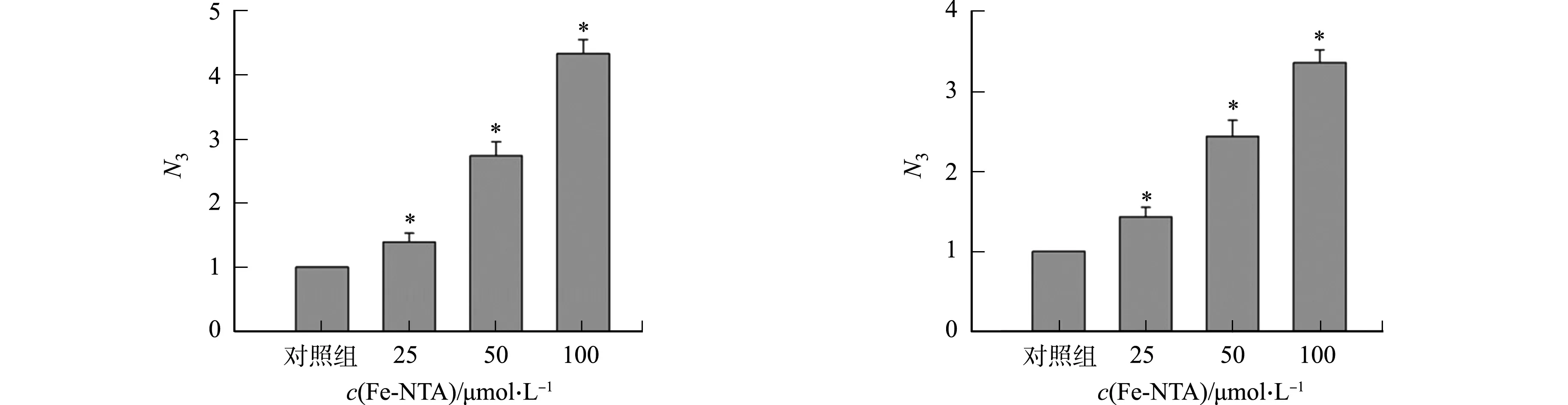
(c) Hela细胞 (d) A549细胞图4 不同细胞添加Fe-NTA对rAAV2转基因表达的影响Fig.4 Effects of adding Fe-NTA in different cells on rAAV2 transgene expression
由图4可知:在293T细胞中,25 μmol·L-1Fe-NTA能促进Gluc表达,其表达量是对照组的1.5倍,50 μmol·L-1Fe-NTA促进Gluc表达量是对照组的2.3倍,100 μmol·L-1Fe-NTA促进Gluc表达量是对照组的3.6倍,与对照组相比,差异具有统计学意义;在LO-2,Hela,A549细胞中,Fe-NTA氧化应激同样能促进rAAV2转基因表达.
不同Fe-NTA浓度对rAAV2转导的影响,如图5所示.图5中:N4为不同Fe-NTA浓度处理组病毒基因组数与对照组病毒基因组数的比值.由图5(a)~(e)可知:在Fe-NTA氧化模型中,25,50,100 μmol·L-1Fe-NTA处理组的GFP阳性细胞数分别为(178±14),(288±24),(428±28)个·mm-2,与对照组相比,差异均具有统计学意义.经Fe-NTA处理后,提取细胞中rAAV2基因组进行定量分析,结果如图5(f)所示.由图5(f)可知:25,50,100 μmol·L-1Fe-NTA处理组的病毒基因组数目分别是对照组的(1.45±0.19),(2.45±0.23),(3.29±0.31)倍.

(a) 对照组 (b) c(Fe-NTA)=25 μmol·L-1

(c) c(Fe-NTA)=50 μmol·L-1 (d) c(Fe-NTA)=100 μmol·L-1

(e) 阳性细胞数 (f) 基因组数 图5 不同Fe-NTA浓度对rAAV2转导的影响Fig.5 Effects of different Fe-NTA concentrations on rAAV2 transduction
2.4 ROS促使rAAV2在细胞中的积累
有研究表明,rAAV2首先转运至核周区域的微管上,然后一部分rAAV2颗粒进入细胞核,在细胞核内脱壳[18,20-21].利用荧光标记的rAAV2(TAMRA-rAAV2)结合共聚焦显微镜的方法,对rAAV2在氧化应激细胞中的运输及分布进行分析.不同处理组TAMRA-rAAV2的亚细胞定位,如图6所示.

(a) PBS处理3 h (b) PBS处理6 h (c) PBS处理12 h (d) PBS处理24 h
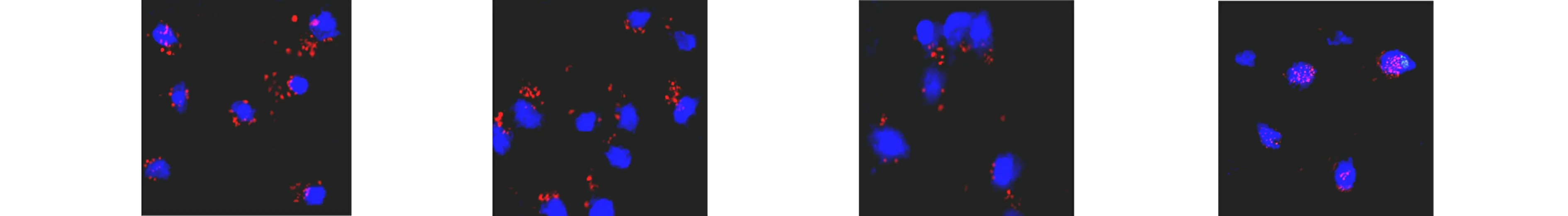
(e) H2O2处理3 h (f) H2O2处理6 h (g) H2O2处理12 h (h) H2O2处理24 h图6 不同处理组TAMRA-rAAV2的亚细胞定位Fig.6 Subcellular localization of TAMRA-rAAV2 in different treatment groups
由图6可知:在转导后3 h,对照组和H2O2处理组的TAMRA-rAAV2在细胞内的定位差异非常小(图6(a),(e));然而,转导后6 h,对照组细胞核周围有一些TAMRA-rAAV2载体聚集(图6(b)),但H2O2处理的细胞中TAMRA-rAAV2载体在核周的积累量更多(图6(f));转导后12 h,对照组TAMRA-rAAV2载体急剧减少(图6(c)),而H2O2处理组TAMRA-rAAV2载体聚集在核孔附近(图6(g));转导后24 h,这种作用更加明显,对照组的细胞中几乎没有残留TAMRA-rAAV2病毒载体(图6(d)),而H2O2处理的细胞中仍然有TAMRA-rAAV2载体在核周区域聚集(图6(h)).这些数据表明,H2O2可防止转导过程中细胞内rAAV2的损失.
氧化应激过程会产生大量的ROS,ROS被认为是氧化应激对细胞产生损伤的主要物质,而ROS是否是促进rAAV2转导的主要物质还需进一步验证.不同Fe-NTA浓度对ROS产生的影响,如图7所示.图7中:RLU为相对光单位.由图7可知:Fe-NTA处理后的细胞都会在细胞内形成ROS,而且随着Fe-NTA浓度的增大,荧光强度增高,细胞中ROS水平增高.

(a) 对照组 (b) c(Fe-NTA)=25 μmol·L-1 (c) c(Fe-NTA)=50 μmol·L-1
用N-乙酰-L-半胱氨酸(NAC)清除细胞内ROS,考察ROS是否介导rAAV2转导,结果如图8所示.由图8可知:H2O2诱导生成的ROS随着NAC浓度的增大而逐渐减少,其中,10 mmol·L-1NAC处理后细胞内的ROS水平与对照组相比, 差异无统计学意义; 而阳性细胞数目和GFP表达量也随着NAC浓度的增大而逐渐减少.结果表明,H2O2通过ROS的形成介导促进rAAV2转导,减少rAAV2在细胞运输过程中的损失,从而促进了rAAV2的转导.

(a) 对照组 (b) H2O2 (c) H2O2+1 mmol·L-1 NAC

(d) H2O2+5 mmol·L-1 NAC (e) H2O2+10 mmol·L-1 NAC

(f) ROS定量分析 (g) 阳性细胞数目 (h) GFP荧光强度图8 ROS对rAAV2转导的影响Fig.8 Effect of ROS on rAAV2 transduction
3 结论
研究H2O2和Fe-NTA两种氧化应激对rAAV2体外转导的影响,实验结果显示,氧化应激能够促进rAAV2转导,在293T,LO-2,Hela和A549细胞中,其表达GFP细胞数、Gluc表达量、病毒基因组数等与对照组相比,差异均具有统计学意义;H2O2处理后,rAAV2在胞质内明显增多,且长时间聚集在核周围;当氧化应激产生的ROS被NAC清除时,H2O2促进rAAV转导作用明显减弱,说明ROS是H2O2促进rAAV转导的主要物质.
rAAV2进入细胞后首先被网格蛋白包裹进入细胞,形成早期内含体、晚期内含体、蛋白酶体,最终进入细胞核,脱壳、单链合成双链[14].氧化应激能够激活细胞中的p53,NF-κB,JNKNF-κB等信号通路,电离辐射、紫外线激活NF-κB,激活的NF-κB能够增强与DNA结合力和激活蛋白磷酸酶/激酶途径,促进rAAV2的转导,而NAC在电离辐射和紫外线暴露后能阻止NF-κB的活化,对rAAV2转导无明显作用[22],电离辐射产生的ROS可能是促进rAAV2转导的主要因素.实验进一步证实,ROS越多,则促转导能力越强,ROS促使rAAV2在细胞核周围聚集的时间越长,说明ROS在rAAV2转导过程可以防止rAAV2被清除.
研究证实,H2O2和Fe-NTA氧化应激模型可促进rAAV2转导,促进转基因的表达、增加细胞中病毒基因组数目等,氧化应激产生的ROS可延长rAAV2在细胞核周聚集,延缓rAAV2的降解,揭示了氧化应激促使rAAV2转导的机制,为体外提高rAAV2转导提供方法.

