杏仁核在精神应激诱发IBS内脏高敏感形成中的研究进展
段光兵, 孙会会, 王珺文, 陈 莹, 许树长
(1. 同济大学医学院,上海 200092; 2. 同济大学附属同济医院消化科,上海 200065)
肠易激综合征(irritable bowel syndrome, IBS)是常见的功能性胃肠病,其主要特点是腹部疼痛伴随排便习惯的改变。IBS的发病机制尚不明确,目前认为内脏高敏感(visceral hypersensitivity)是其核心发病机制之一,与IBS患者腹痛等症状有关[1]。内脏高敏感是指内脏对刺激物的感知阈值降低,可表现为对非伤害性刺激产生不适感(allodynia)或对有害性刺激的反应增强(hyperalgesia)。随着2016年罗马Ⅳ标准[2]中“肠-脑轴互动异常”的提出,中枢神经系统在IBS等功能性疾病发生发展过程中的重要性日渐突显。IBS患者多伴有焦虑或抑郁等精神症状[3]。长期处于精神应激状态可诱发内脏高敏感的形成,杏仁核(amygdala)作为负性情绪和疼痛信号处理以及参与精神应激反应的重要核团[4-5],探讨杏仁核在IBS内脏高敏感形成中的机制研究逐年增多,现本文就其作一综述。
1 杏仁核的结构及其主要功能
1.1 杏仁核的结构
杏仁核位于颞叶背内侧部,主要包括基底外侧复合体(basolateral amygdala, BLA)和中央杏仁核(central amygdala, CeA)。BLA由外侧、基底及基底内侧细胞群构成,主要是谷氨酸能神经元,是信息传入杏仁核的主要接收核团;CeA由外侧和内侧细胞群构成,主要是γ-氨基丁酸(γ-aminobutyric acid, GABA)能神经元,是杏仁核信息输出的主要核团。在BLA与CeA之间还有一群由GABA能神经元构成的插层细胞结构(intercalated cells),可以拦截来自BLA的兴奋性投射,进而抑制CeA神经元的活化,起到“门控”的作用[4]。
1.2 杏仁核的主要功能
杏仁核是大脑边缘系统的重要脑区,在负性情绪处理(如焦虑、抑郁和恐惧)、奖赏、学习记忆及认知功能中发挥重要作用,动物和人体研究发现杏仁核与焦虑障碍、自闭症及酒精或药物成瘾有密切联系[4]。杏仁核在对疼痛调控过程中也有重要作用,其参与接收、整合和编码疼痛信息,是调节边缘系统与皮层区之间疼痛信号处理的中心[6]。杏仁核可通过不同的神经元类型对疼痛进行双向调控并参与疼痛的情绪处理[7-8]。
下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴是内脏高敏感形成中枢机制的重要组成部分,杏仁核(尤其是CeA)则是参与并促进应激反应的重要核团[5]。在精神应激刺激下,杏仁核活性增强,下丘脑室旁核分泌促肾上腺皮质激素释放因子(corticotropin releasing factor, CRF)增加,经垂体门脉系统激活HPA轴,促进皮质醇或皮质酮(corticosteroid, CORT)的释放。CORT随血液循环与糖皮质激素受体(glucocorticoid receptor, GR)或者盐皮质激素受体(mineralocorticoid receptor, MR)结合,引发机体一系列应激反应。在许多脑区,如下丘脑室旁核、海马及前额叶皮层等,CORT与GR/MR结合后对HPA轴产生负反馈抑制效应。在长期精神应激状态下,杏仁核内GR表达下降,解除了GR介导的对CRF释放的抑制作用,引发HPA轴功能调节障碍,导致皮质激素的持续释放,见图1,这与发现IBS患者体内皮质醇浓度增高一致[9]。
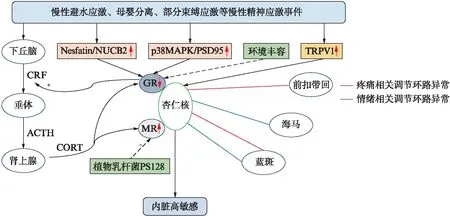
图1 杏仁核在精神应激诱发IBS内脏高敏感中的部分作用机制Fig.1 Roles of amygdala in visceral hypersensitivity in IBS induced by psychological stressNesfatin/NUCB2为摄食抑制因子/核组蛋白2;p38MAPK/PSD95为P38丝裂原活化蛋白激酶/突触后致密蛋-95;TRPV1为瞬时受体电位香草酸亚型1;CRF为促肾上腺皮质激素释放因子;ACTH为促肾上腺皮质激素;CORT为皮质酮激素;GR为糖皮质激素受体;MR为盐皮质激素受体
2 杏仁核在IBS内脏高敏感形成中的神经影像学研究
早期影像学研究已经发现,IBS患者在结直肠扩张刺激过程中杏仁核和前扣带回(anterior cingulate cortex, ACC)等与情绪处理有关的核团被持续激活,调节内源性疼痛的脑区如中脑也被激活[10],表明IBS患者中枢神经系统的调节功能异常。
随着影像学技术和分析理论的发展,越来越多的研究开始关注肠-脑轴互动异常的脑成像变化。静息态功能磁共振能够反映大脑静息状态下神经元的自发性活动,静息态功能连接(resting state functional connectivity, RSFC)则是在静息态功能磁共振基础上发展而来的一种常用的研究方法,用于根据脑区间血氧水平依赖(blood oxygen level dependent, BOLD)时间信号序列的相似性来定量不同脑区之间的功能相关性。区域间的RSFC增强代表各脑区的同步活动或脑区间的交互作用增加。
IBS患者腹痛相关恐惧学习及记忆处理过程异常,该过程由杏仁核、扣带回、前额叶皮层及海马介导[11]。Qi等[12]报道IBS患者的杏仁核与岛叶、中脑、海马旁回及感觉运动皮层的RSFC明显增强,且杏仁核、岛叶和感觉运动皮层的RSFC与疼痛强度呈正相关,而杏仁核、岛叶和中脑的RSFC则与IBS症状严重程度评分呈正相关。该研究显示IBS患者杏仁核与皮层边缘区的RSFC异常,这可能与IBS相关情绪唤醒环路的激活及内脏信息处理过程加强有关。但另有研究发现,在反复直肠扩张刺激时,内脏敏感性正常的IBS患者岛叶、前额叶皮层及杏仁核的BOLD信号反应减弱[13]。得出不同结论的原因可能与受试者分组和分析方法的不同有关,具体的机制仍有待进一步探讨。
杏仁核是一个表现出性别二态性的大脑核团,体现在大脑发育及焦虑障碍等疾病中[14]。IBS以女性患者较多见,且不同性别IBS患者杏仁核活性变化存在差异[9],提示杏仁核在IBS的发病机制中也可能存在着性别二态性。因此,在使用影像学手段评估IBS等疾病时,还应考虑到大脑核团在不同性别间的差异化表现。Allen等[15]应用雌激素依赖性内脏高敏感动物模型研究了结直肠扩张对不同脑区激活程度的影响。与对照组相比,雌二醇处理后的卵巢切除组大鼠在应激后出现内脏高敏感,杏仁核和腹侧纹状体的BOLD信号反应增强,表明雌激素可能与应激相关情绪唤醒环路的活性增强有关。
3 杏仁核在IBS内脏高敏感形成中的机制研究
IBS患者常伴发焦虑、抑郁等精神应激表现,而长期精神应激可引起神经系统形态学、内分泌及免疫功能的改变,严重时可造成神经精神性疾病等。早年经历虐待等不良生活应激事件或伴有创伤后应激障碍的IBS患者较其他IBS患者相比,其内脏敏感性明显增高,胃肠道症状更为严重,临床预后往往也更差[2]。而反复发作的胃肠道症状使得患者求医更为频繁,影响其正常的工作生活状态,健康相关生活质量降低,进一步加重焦虑、抑郁等精神症状。采取认知行为疗法或神经调节剂(如抗抑郁类药物)等治疗可有效改善IBS患者胃肠道及精神症状[16-17]。
慢性避水应激、母婴分离和部分束缚应激等慢性非创伤性精神刺激,能够较好地模仿人类焦虑、恐惧及挫折等生活状态,基于此构造的动物模型可以较好诱导IBS相关症状,因而被广泛应用于由精神应激诱发IBS的实验研究。在这些模型中均有杏仁核活性异常的报道,且杏仁核活性的改变与内脏敏感性增高有关[9]。
3.1 慢性精神应激引发杏仁核形态学改变
慢性应激可引起神经元的形态学特征发生改变,如前额叶皮层和海马神经元萎缩及BLA神经元肥大[18],提示应激可造成神经元重塑且不同脑区对慢性应激的反应结果有所不同。对BLA的进一步研究发现,经历慢性束缚应激后,小鼠BLA投射神经元的树突发生肥大,且在未投射至背内侧前额叶皮层的投射神经元中蘑菇型树突棘数量增加,谷氨酸能神经元活性增强,这可能与慢性束缚应激介导的焦虑样行为增加有关[19],为焦虑障碍及其他应激相关疾病的病理生理机制提供了新见解。
3.2 神经内分泌机制研究
大量动物实验表明,杏仁核内GR表达下降和(或)CRF表达增加均可降低对结直肠扩张的内脏运动反应的阈值,诱发内脏高敏感的形成[9]。杏仁核GR/CRF的表达异常可能与长期精神应激状态下GR启动子处组蛋白H3K9乙酰化水平下降有关[20]。
Zhou等[21]在母婴分离大鼠模型中发现杏仁核内摄食抑制因子-1(Nesfatin-1)、核组蛋白2(NUCB2)表达增加。Nesfatin-1是由NUCB2衍生而来的一种前体神经肽,在中枢神经系统中常广泛分布于与应激相关的核团,如下丘脑室旁核、孤束核、蓝斑及杏仁核,可能与HPA轴的激活有关。杏仁核内Nesfatin-1/NUCB2升高可能通过GR/MR途径介导IBS内脏高敏感的发生。此外,慢性避水应激组大鼠CeA内小胶质细胞中磷酸化p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)及突触后致密蛋白-95(post synaptic 95, PSD95)的表达显著升高,GR表达下降。而抑制小胶质细胞活性后可逆转应激介导的内脏高敏感[22]。因此,内脏高敏感的形成还可能与CeA中小胶质细胞p38 MAPK活化、GR功能障碍及神经元重塑有关。另有研究发现母婴分离组大鼠BLA内瞬时受体电位香草酸亚型1(transient receptor potential van-illoid subtype 1, TRPV1)显著上调,谷氨酸能神经元突触活性增加[23]。BLA内微量注射TRPV1拮抗剂——辣椒平可明显提高母婴分离组和对照组大鼠直肠扩张阈值,降低其内脏敏感性。而消退素D2以及G蛋白受体18激动剂可通过抑制背根神经节处神经元TRPV1的活化,从而降低感染后IBS的内脏敏感性[24],表明消退素D2和G蛋白受体18可能成为治疗IBS的新型靶点。
植物乳杆菌PS128可发挥“精神益生菌”的作用,通过调节脑内神经递质的表达改善焦虑及抑郁样行为。对内脏高敏感大鼠PS128灌胃给药后可降低杏仁核内MR表达及血清皮质酮浓度,显著降低其内脏敏感性[25]。该研究为临床应用PS128治疗IBS提供了实验性证据,也是脑-肠轴相互作用的实例。认知行为疗法可有效缓解IBS患者的症状并提高生活质量[16],但其具体机制仍不清楚。一项采用环境丰容模拟认知行为疗法的动物模型研究发现,认知行为疗法可能通过抑制应激介导的CeA内GR下调,从而降低内脏高敏感性[26]。
3.3 神经环路调控
胃肠道与中枢神经系统之间存在上行感觉信号传输及下行感觉调控通路。杏仁核与丘脑和脑干等共同参与下行疼痛调节环路的形成。近期研究发现蓝斑-BLA环路在焦虑和慢性疼痛共病时过度活化;丘脑室旁核后部-CeA环路可能是介导持续性疼痛的机制之一;慢性应激状态下可通过臂旁核-CeA环路加剧神经病理性疼痛[27-29]。杏仁核相关痛觉环路的调节异常可能介导了IBS患者内脏痛的发生。这些环路的发现有助于进一步阐明杏仁核在疼痛调节过程中的作用,并可能给慢性内脏疼痛的发病机制研究提供新的思路。在慢性应激状态下,BLA-腹侧海马环路的功能极易被影响,与应激介导的焦虑样行为增加有关[19],但BLA-腹侧海马环路如何被应激影响而促进焦虑样行为增加的确切机制仍有待明确。内脏高敏感还与BLA和ACC之间的θ节律振荡同步性被抑制有关,且ACC-BLA神经环路的破坏可能影响慢性内脏痛的认知功能[30]。
4 结 语
杏仁核作为大脑边缘系统的核团之一,参与情绪处理、疼痛调控和应激等重要病理生理过程。综上所述,杏仁核在精神应激诱发IBS内脏高敏感形成中可能的机制为: 在长期精神应激状态下,杏仁核内GR/MR功能障碍,引起HPA轴功能调节异常。此外,杏仁核神经元发生重塑,相关情绪及疼痛传导通路异常,最终诱发内脏高敏感的形成。以往研究多聚焦于中央杏仁核的作用,而杏仁核的另一重要亚区——基底外侧杏仁核是否亦参与调控IBS内脏高敏感的形成及其发挥作用的可能机制目前仍知之甚少,且杏仁核与其他脑区的相互作用以及诱发IBS内脏高敏感形成的关键神经环路仍有待明确。针对杏仁核各区功能和相关神经环路的进一步研究将有助于开发IBS等功能性胃肠病的靶向药物,提高临床疗效,减轻疾病负担。

