2012—2021年某院脑脊液病原菌分布与耐药性分析
邱付兰,黄月娥,钟荣荣,陈丽萍,刘辉
(1. 福建医科大学附属龙岩第一医院检验科,福建 龙岩 364000;2. 福建医科大学附属龙岩第一医院麻醉科,福建 龙岩 364000;3. 福建医科大学附属龙岩第一医院急诊科,福建 龙岩 364000)
中枢神经系统感染发病迅速且病死率高,脑脊液培养是临床诊断中枢神经系统感染的重要手段。通过对龙岩市第一医院2012—2021年804株脑脊液培养分离菌株的构成比和耐药性的分析,为了解该院中枢神经系统感染情况并为临床抗感染治疗提供依据。
1 材料和方法
1.1 材料
1.1.1 菌株 收集本院2012—2021年10年间住院患者脑脊液培养的804株细菌及病人资料,同一患者重复相同菌株取第一株细菌信息。药敏试验质控菌株:肺炎链球菌ATCC49619、铜绿假单胞菌ATCC27853、大肠埃希菌ATCC25922、粪肠球菌ATCC29212、金黄色葡萄球菌ATCC25923和ATCC29213。
1.1.2 仪器和试剂 美国赛默飞公司血培养仪和培养瓶、美国BD公司细菌仪及配套试剂、法国生物梅里埃公司ATB Fungus3酵母菌药敏试剂盒和ATB HAEMO嗜血杆菌药敏试剂盒、郑州安图公司的各种分离培养基、英国OXOID公司的抗菌药物纸片。
1.2 方法
1.2.1 标本采集与培养 按无菌技术采集我院疑似中枢神经系统感染住院患者的脑脊液标本,取≥1 mL脑脊液标本注入血培养瓶,将培养瓶放入Versa TREK血培养仪中培养,如阳性报警转种血平板和巧克力平板培养。
1.2.2 鉴定和药敏试验 采用BD细菌仪进行鉴定和药敏试验,部分药敏试验用K-B法。
1.2.3 数据分析和判断标准 采用WHONET 5.6软件统计分析,耐药率和敏感率采用百分率计算[(耐药或敏感株数/该菌检出株数)×100%]。药敏采用2021年版美国临床实验室标准化协会 (the Clinical and Laboratory Standards Institute, CLSI) 标准[1]。
2 结果
2.1 细菌构成及其分布
2.1.1 革兰阳性菌和革兰阴性菌菌株构成比及主要菌群 10年间共收集脑脊液培养非重复菌株804株,菌株构成比:革兰阳性菌82.84%;革兰阴性菌13.18%;真菌3.98%。脑脊液的主要分离菌为CNS。见表1。
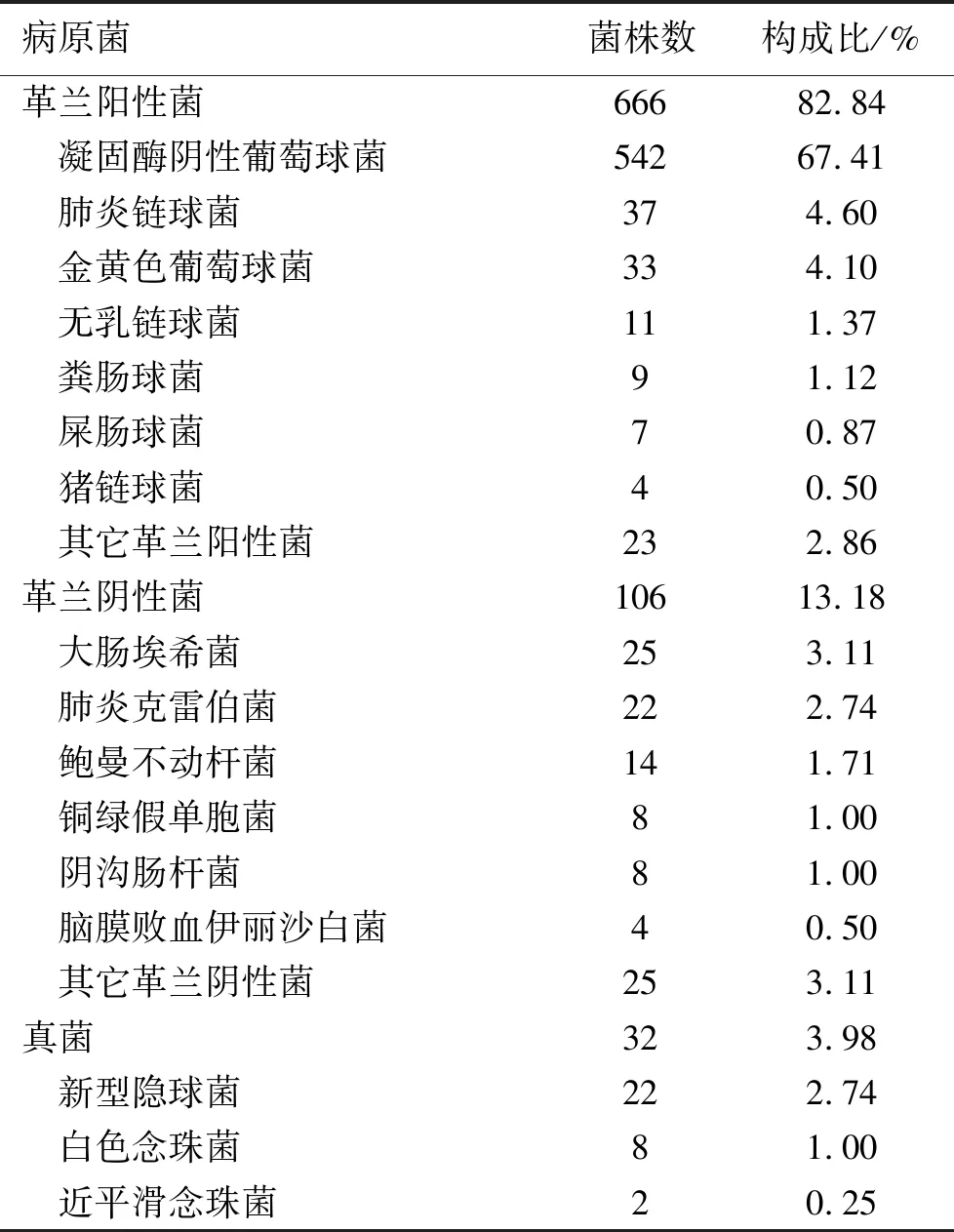
表1 2012—2021年脑脊液培养主要病原菌分布
2.1.2 分离菌科室分布 804株分离菌分离自神经外科520株,占64.68%;新生儿科87株,占10.82%;神经内科78株,占9.70%;重症医学科48株,占5.97%;儿科39株,占4.85%,急诊病房10株,占1.24%。神经外科是脑脊液标本的主要送检科室。542株CNS主要来源:神经外科74.72%(405/542),新生儿科8.30%(45/542),神经内科6.83%(37/542),重症医学科5.35%(29/542)。
2.1.3 不同年龄段分布 804株分离菌在各个年龄段的分布为:0~28 d 87株,占10.82%;29 d~14岁58株,占7.21%;15~17岁3株,占0.37%;18~60岁432株,占53.73%,>60岁224株,占27.86%。18~60岁年龄段占比最高。18岁以下患者分离菌148株,常见分离菌为CNS 64株,占43.24%;肺炎链球菌23株,占15.54%;大肠埃希菌15株,占10.14%;无乳链球菌10株,占6.76%;脑膜败血伊丽沙白菌4株,占2.70%。以CNS、肺炎链球菌为主。成年患者中分离菌656株,常见分离菌为CNS 478株,占72.87%;金黄色葡萄球菌28株,占4.27%;新型隐球菌20株,占3.05%;肺炎克雷伯菌20株,占3.05%;鲍曼不动杆菌12株,占1.83%。成年患者CNS、金黄色葡萄球菌多见。
2.2 革兰阳性菌对抗菌药物的敏感性
2.2.1 葡萄球菌属 葡萄球菌对利奈唑胺、替考拉宁、万古霉素耐药率为0。凝固酶阴性葡萄球菌(MRCNS)检出率为75.65%(410/542);甲氧西林耐药金黄色葡萄球菌(MRSA)检出率为54.54%(18/33); MRCNS和MRSA对庆大霉素、环丙沙星、克林霉素、红霉素、四环素的耐药率明显高于MSCNS和MSSA。见表2。

表2 2012—2021年葡萄球菌属对常用抗菌药物耐药率和敏感率
2.2.2 链球菌属 肺炎链球菌对青霉素、红霉素、克林霉素的耐药率>91.00%,而对利奈唑胺、莫西沙星、左氧氟沙星、万古霉素的敏感率为100.00%。无乳链球菌对红霉素、克林霉素、四环素耐药率较高>81.00%,而对于其它测试药物均敏感。见表3。
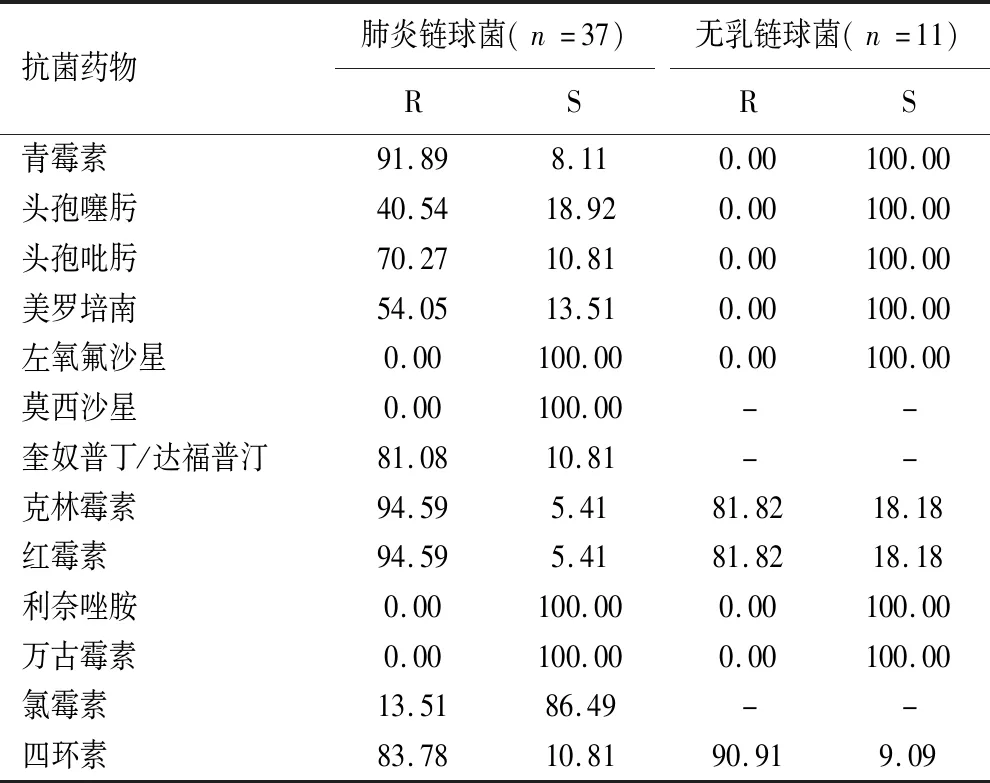
表3 肺炎链球菌、无乳链球菌对常用抗菌药物的耐药性和敏感性
2.3 主要革兰阴性菌对抗菌药物的耐药性和敏感性 大肠埃希菌对阿米卡星的敏感率为100.00%;对氨苄西林、复方新诺明、四环素的耐药率较高(80.00%),超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBL)阳性大肠埃希菌和肺炎克雷伯菌分别为44.00%、36.36%。肺炎克雷伯菌对哌拉西林、头孢唑林、复方新诺明、四环素的耐药率较高。14株鲍曼不动杆菌有13株为广泛耐药菌(extensively drug resistant bacteria,XDR),占92.86%,来自重症医学科和神经外科重症室;鲍曼不动杆菌对常用抗菌药物的耐药性高(>71.00%)。见表4。
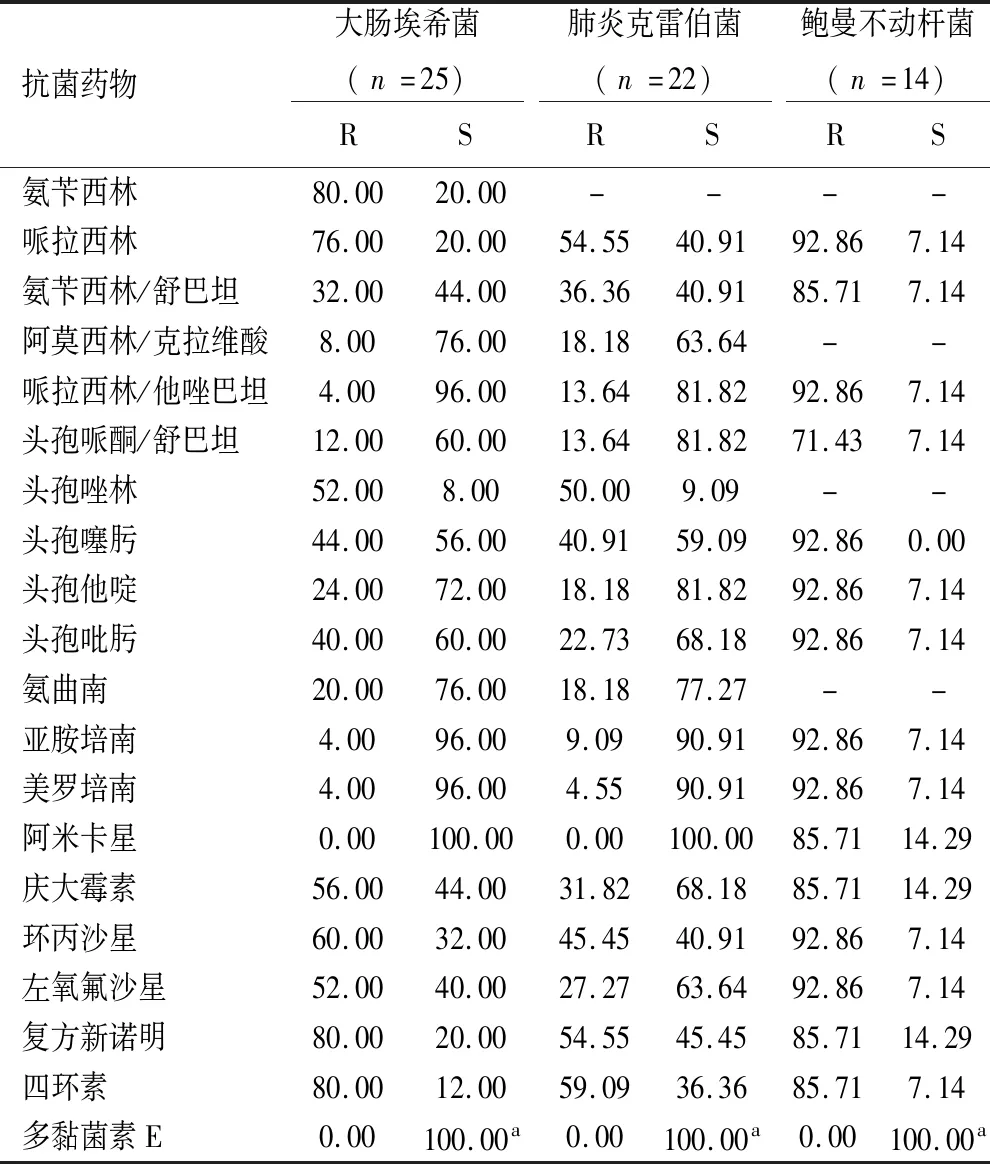
表4 主要革兰阴性杆菌对常用抗菌药物的耐药性和敏感性
2.4 真菌药敏结果 新型隐球菌对5-氟胞嘧啶、两性霉素B、伊曲康唑的敏感率为100.00%,伏立康唑为95.54%,氟康唑为86.36%。白色念珠菌对伏立康唑、氟康唑、伊曲康唑的敏感率为87.50%,对5-氟胞嘧啶、两性霉素B的敏感率为100.00%。
3 讨论
本次监测数据显示,我院脑脊液病原菌以革兰阳性菌主,占82.84%;革兰阴性菌占13.18%,真菌占3.98%,阳性菌的检出率比文献报道高[2]。分离前6位为CNS、肺炎链球菌、金黄色葡萄球菌、大肠埃希菌、新型隐球菌、肺炎克雷伯菌。脑脊液培养标本神经外科约占2/3,神经外科CNS分离率占74.72%,明显高于其他科室。《全国临床检验操作规程》第四版[3]推荐脑脊液细菌培养可采用脑脊液离心取沉淀接种平板和脑脊液注入血培养瓶两种培养方法,前一种方法污染率低,但对于奴卡菌、赛多孢等慢生长菌或少见菌的分离率低;后一种方法对于慢生长菌分离率较高,但常受到皮肤正常菌如CNS的污染,对于脑脊液分离的CNS评估是否为病原菌应密切结合患者临床表现及相关炎症指标[4]。对于采用脑脊液引流管的患者,具有中枢感染症状时,增加脑脊液培养次数有助于甄别污染菌[5]。利奈唑胺、替考拉宁、万古霉素对葡萄球菌的敏感率高,葡萄球菌引起重度颅内感染首选抗糖肽类药物[6];因利奈唑胺安全性好,有较强的脑组织穿透力,可用于治疗万古霉素过敏或疗效差的病人[7-8]。
脑脊液中肺炎链球菌的分离率4.6%,位列第二位,其中70.3%为儿童,肺炎链球菌常定植于儿童呼吸道,当机体抵抗力下降时易引发败血症和或中枢神经系统感染,病死率和致残率明显增加[9]。肺炎链球菌可产生自溶酶导致细菌发生自溶现象,特别是当脑脊液中含菌量多时将标本注入血培养后能在数小时自溶而导致细菌死亡;本研究者在工作中曾遇到2例病人脑脊液直接涂片可见革兰阳性球菌,疑似肺炎链球菌,但脑脊液培养瓶在血培养仪中并无阳性报警,取脑脊液培养瓶中液体涂片可见革兰阳性球菌,但转种血平板和巧克力平板后不生长,后取脑脊液常规标本离心取沉淀接种平板后得到肺炎链球菌菌落,此现象提示当脑脊液注入血培养瓶后应尽早将瓶子放入血培养仪,在仪器报阳后及时转种平板才可避免肺炎链球菌自溶。本研究显示,肺炎链球菌对莫西沙星、左氧氟沙星、万古霉素利奈唑胺具有高敏感率,对于重症病人可采用上述药物治疗。无乳链球菌对左氧氟沙星、β内酰胺类、万古霉素、利奈唑胺敏感率为100.00%,提示可选择上述药物经验治疗。
革兰阴性菌引起的中枢感染常用美罗培南治疗,本研究发现5株CRE进行碳青霉烯酶的检测有利于抗菌药物的选择。鲍曼不动杆菌对常用抗菌药物的耐药性>71.00%,与刘雪等[10]报道相近。XDR鲍曼不动杆菌来自重症医学科和神经外科重症室,重症病人多因侵入性操作、严重疾病及免疫功能低下等增加了感染XDR鲍曼不动杆菌的风险。鲍曼不动杆菌基因组研究发现该菌具有快速获得和传播耐药性的能力,多重耐药、广泛耐药、全耐药鲍曼不动杆菌呈世界性流行[11]。已有研究表明替加环素与碳青霉烯类、头孢他啶联合用药治疗XDR鲍曼不动杆菌有较好的效果[12]。张文宏等[13]报道1例中枢神经系统多重耐药鲍曼不动杆菌感染的病例,治疗初期采用鞘内/脑室内注射多黏菌素B,并联合静脉使用多粘菌素B及大剂量使用舒巴坦制剂,后期根据联合药敏的结果序贯以大剂量舒巴坦联合碳青霉烯类药物抗感染治疗,取得非常好的疗效。
脑膜败血伊丽沙白菌(EM)由于细菌外膜通透性较差且诱导产生β-内酰胺酶,导致对氨基糖苷类和β-内酰胺类药物耐药[14],EM 引起的新生儿脑膜炎其病死率可达33.00%~53.00%[15-16],本院10年间脑脊液培养共分离4株脑膜败血EM,年龄7 d~7个月,3例病人合并血流感染。药敏结果显示该菌对所有β-内酰胺类及氨基糖苷类抗菌药物均耐药,对哌拉西林/他唑巴坦敏感率为50.00%,左氧氟沙星、环丙沙星、复方新诺明敏感率为75.00%,头孢哌酮/舒巴坦敏感率100.00%,但因儿童用药受限,左氧氟沙星、环丙沙星、复方新诺明不建议使用。对于疑似革兰阴性菌导致中枢神经感染的重症患儿,临床常经验性使用头孢曲松或美罗培南治疗,而脑膜败血伊丽沙白菌因对这类抗菌药物耐药,常致经验用药失败。菌种名的确定并尽早使用合适抗菌药物治疗可降低死亡率,4例病人中1例发病后4 d使用头孢哌酮/舒巴坦治疗成功,另1例发病6 d后使头孢哌酮/舒巴坦治疗疗效不佳转院,余2例使用哌拉西林/他唑巴坦或联合万古霉素治疗感染控制不佳转上级医院治疗。尽早采用头孢哌酮/舒巴坦治疗EM致婴幼儿中枢神经系统感染可能获得成功,但因相应病例较少,仍需在日后观察更多的病例加以验证。
人与感染猪链球菌的动物密切接触且患者皮肤有伤口时易引发脑膜炎及败血症,重症患者可发展为病死率高的链球菌中毒性休克样综合征[17]。2020—2021年2年间分离4株猪链球菌,但BD细菌分析仪均鉴定为少酸链球菌,而梅里埃细菌仪和布鲁克质谱仪鉴定为猪链球菌,提示在BD仪器鉴定为少酸链球菌时须用其它仪器进行复核,以免发生误诊。同时应及时通知农业部门对传染源进行消毒处理避免疫情蔓延。
脑脊液中分离真菌以新型隐球菌为主,均来自成人患者;隐球菌性脑膜炎的诊断有赖于脑脊液墨汁染色、隐球菌荚膜抗原检测和真菌培养,隐球菌荚膜抗原检测因高度敏感性和特异性,操作简单快速成为隐球菌性脑膜炎的主要检测方法。隐球菌对常用抗真菌药物敏感性较高,文献报道采用两性霉素B、5-氟胞嘧啶、氟康唑三药联合可获得最佳疗效[18]。脑脊液培养是确诊中枢神经系统感染的重要依据,加强脑脊液病原学和耐药性监测,对于指导临床制定经验治疗方案、合理应用抗菌药物具有重要意义[19]。严格执行无菌操作,合理使用抗菌药物,避免颅脑手术和各种侵袭性操作导致的院内感染,及时掌握细菌耐药性的变迁,可从根本上保障患者的医疗安全。

