基于网络药理学研究决明子对氟尿嘧啶致肝损伤的保护作用机制分析
王恒,邹纯才,鄢海燕
(皖南医学院药学院,安徽 芜湖 241002)
药物性肝损伤 (drug-induced liver injury,DILI) 是指由各类处方或非处方的化学药物、生物制剂、天然药物及其代谢产物等诱发的肝损伤[1]。DILI易发展成肝衰竭,致死率可达75%。据世界卫生组织(WHO)统计:药物引起的肝功能异常已经上升为全球肝病死亡病原的第五位[2]。在我国,DILI发病率仅次于病毒性肝炎、脂肪性肝病[3]。近年来,随着抗肿瘤药物的不断研发,恶性肿瘤患者的预后有了明显的提高,生存期也大大延长,但其不良反应也为肿瘤患者的治疗带来了新的问题。肿瘤药物治疗时易引起药物性肝损伤,特别是在肝炎发病率较高的中国,寻找有效药物降低或预防药物性肝损伤值得研究。
决明子是豆科植物决明CassiaobtusifoliaL.或小决明CassiatoraL的成熟干燥种子,其味甘、苦、咸,性微寒,善入肝、肾、大肠经,具有清肝明目、润肠通便的功效[4],始载于《神农草本经》,列为上品。现代研究表明,决明子具有降血压、降血脂、保肝、明目、抗氧化、抑菌等作用[5]。决明子作为我国常用中药,同时也是药食同源物质之一,药理作用广泛,在临床疾病的预防及养生等方面具有显著的作用,但其作用机制尚不明确,本文通过网络药理学对决明子抗肿瘤药致肝损伤作用靶点进行预测分析,明确决明子对5-FU致肝损伤保护作用机制,为深入研究其治疗抗肿瘤药致肝损伤提供理论依据与参考。
1 材料与方法
1.1 决明子蒽醌类活性成分的筛选及靶点的整理 通过中药系统药理学数据库与分析平台(TCMSP)、 CNKI数据库及PubMed等数据库收集决明子蒽醌类成分,绘制结构式并以MDL SDfile(*.sdf)格式保存。将绘制的结构式导入SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/),检测匹配得到药物的预测靶点,设置Probability≥ 0.05,获得决明子蒽醌类的活性成分靶点蛋白。
1.2 收集疾病相关靶点 通过CooLGeN(http://ci.smu.edu.cn/CooLGeN/Home.php)、GeneCards(https://www.genecards.org/)数据库,以“Liver injury caused by fluorouracil”和“Liver injury”为关键词进行检索,获取疾病相关靶点。利用Venny2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)将“1.1”项下的决明子蒽醌类成分的预测靶点去重后与疾病相关靶点取交集靶点。
1.3 构建靶点的蛋白互作网络图 为了解释目的蛋白之间的相互作用,将“1.2”项下得到的交集靶点导入STRING数据库( https://string-db.org/)中,选择物种为人,初步获得决明子蒽醌类成分抗5-Fu致肝损伤保护作用的PPI网络信息。导出数据库中生成的PPI网络信息的“TSV”文件,导入Gephi0.9.2软件中进行分析,获得网络中节点的度值,筛选核心靶点,度值越大表明靶点所起的作用越大。
1.4 GO功能富集分析及KEGG信号通路富集分析 为了阐明决明子蒽醌类成分中目标化合物的功能及其在信号转导中的作用,利用DAVID数据库(https://david.ncifcrf.gov)对参与PPI网络的蛋白的GO功能和KEGG通路富集进行了分析,并介绍靶蛋白的细胞组成、分子功能、生物学过程和信号通路。
1.5 化学成分-靶点蛋白-通路网络的构建 通过Gephi0.9.2建立了“成分-疾病-靶点通路”相互作用的网络模型。将“1.1”项下的决明子蒽醌类成分及靶点、“1.3”项下的交集靶点、“1.4”项下的通路信息导入Gephi0.9.2,构建活性成分-蛋白靶点-通路的网络图。
1.6 分子对接验证 通过SYBYL-X 2.1.1软件进行重要靶点和成分的分子对接,以PPI网络中度值前十的靶点为受体,与其对应的活性成分为配体,对氟尿嘧啶致肝损伤靶点与决明子蒽醌类成分的相互作用进行研究。在PDB数据库(http://www.rcsb.org / )中下载靶点的蛋白结构,分别将小分子与蛋白结构导入Sybyl软件中进行预处理,去除配体,水分子,进行加氢,以蛋白的配体小分子为口袋,与成分分子进行对接处理,得到靶点与其对应成分对接后的Total Score分值,Total Score值换算结合自由能公式为△G0=-2.303 RT×Total Score(其中R为分子的理想气体常数,T为理想气体的热力学温度),因此 Total Score 值越大,配体与受体结合越稳定[6],再通过PyMol进行受体配体的相互作用模式分析。
2 结果
2.1 决明子蒽醌类成分的收集及靶点的整理 通过TCMSP数据库与文献检索[6-7],共获得35种决明子蒽醌类成分,经筛选,共有27个活性成分符合条件,作为候选化合物纳入研究,见表1。筛选得到成分相关靶点2 711个,设置筛选条件Probability≥0.05,删除无效重复的靶点,最终得到决明子蒽醌类有效活性成分的靶点349个[7-8]。

表1 决明子中27个蒽醌类成分信息
2.2 疾病靶点的预测 通过Gene Cards数据库获得肝损伤靶点1 399个,CooLGeN数据库获得1 895个,结合已获得的决明子蒽醌类成分的作用靶点,应用Venny2.1.0,制作成分靶点与疾病靶点的韦恩图,共得到103个交集靶点,作为决明子蒽醌类成分抗5-Fu致肝损伤保护作用潜在的靶点,见图1。
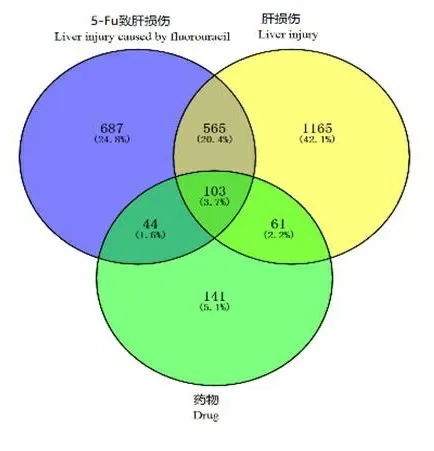
图1 决明子蒽醌类成分靶点与疾病靶点的交集靶点
2.3 靶点蛋白PPI网络的构建与分析 将“2.2”项下得到的103个交集靶点导入String数据库中,选择物种“Homo sapiens”,得到成分与靶点的蛋白互作网络,见图2。PPI网络中,共103个节点,1 383条边,其中节点代表目标蛋白,每条边代表蛋白-蛋白相互作用。在网络中,每个节点的度表示连接到该靶点的数量,因此,程度越大,该节点对应的目标蛋白在网络中的作用就越强,表明该目标蛋白在整个相互作用网络中起着重要的作用,将它们作为核心靶点[9]。下载其“TSV”格式的网络信息,导入Gephi 0.9.2软件,利用其统计分析功能对网络节点中的度值进行计算,筛选核心靶点。如图3展示了GAPDH、AKT1、STAT3、MAPK1、EGFR、TP53、HSP90AA1、SRC、CASP3等度值较高的前二十位核心靶点,现代研究表明,这些靶点多是参与细胞增殖、分化、凋亡、分裂、新陈代谢、氧化还原、免疫调节和癌症发展等过程[10-13]。
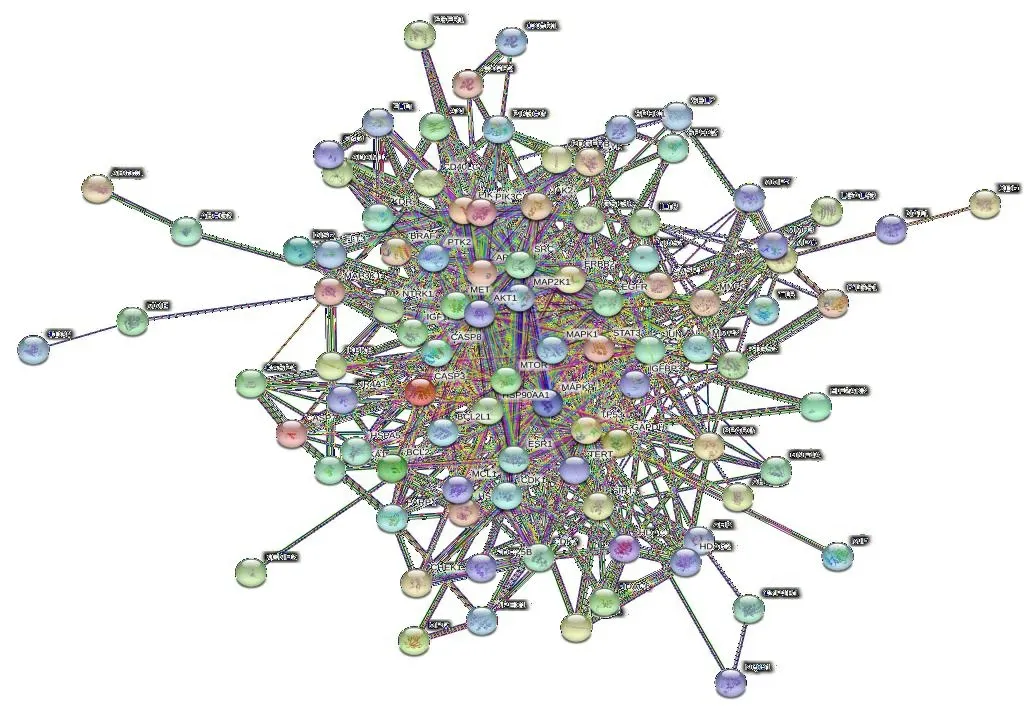
图2 决明子蒽醌类成分与疾病靶点的PPI网络

图3 PPI中degree值较高的靶点
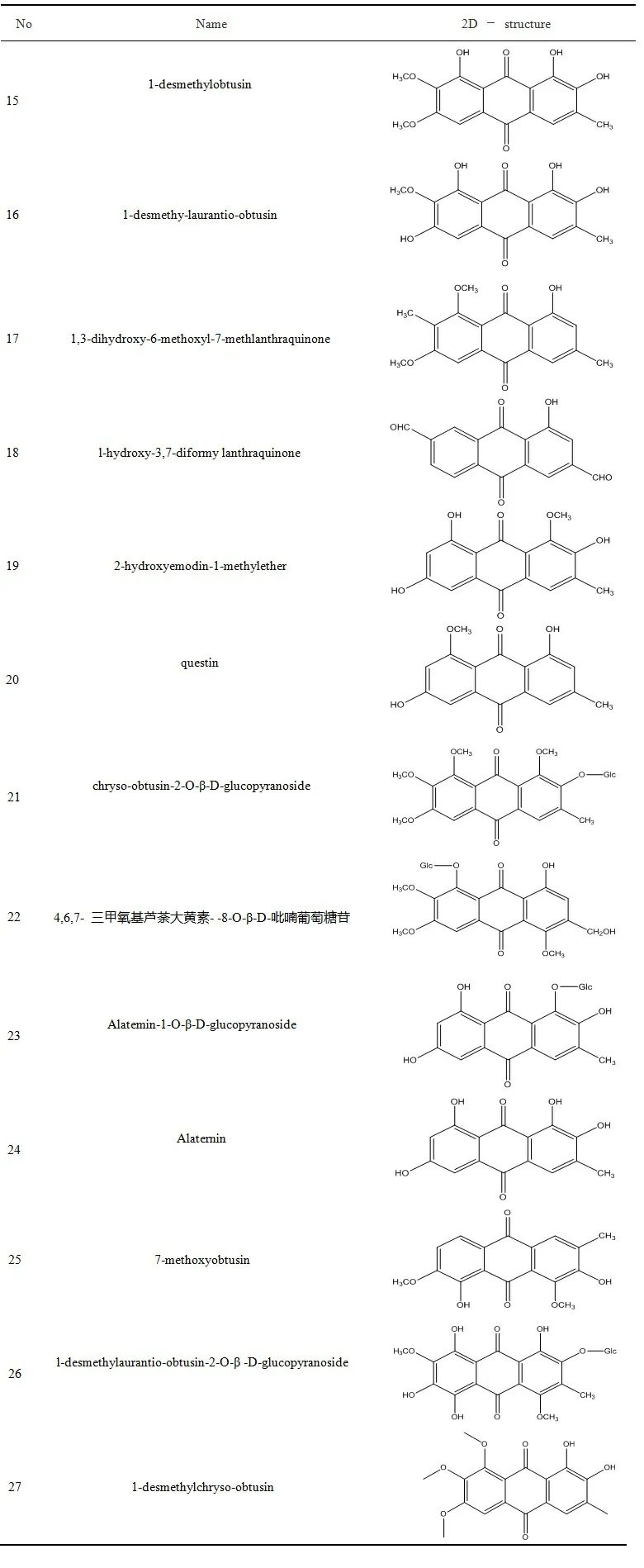
表1(续) 决明子中27个蒽醌类成分信息
2.4 目的蛋白GO功能注释和KEGG通路分析 对103个关键靶点进行细胞学组分、分子功能与生物学过程及信号通路富集分析。设置筛选条件(P<0.05),由GO富集结果得到共有77条生物学功能,其中有37条涉及生物学过程,决明子蒽醌类成分主要参与蛋白质自身磷酸化,跨膜受体蛋白酪氨酸激酶信号通路,凋亡过程的负调控,细胞增殖调节,磷脂酶C活性正调控,凋亡信号通路的负调控,神经元凋亡过程的负调控,肽基苏氨酸磷酸化,ERK1和ERK2级联的正调节,负性调节等生物学过程,表明决明子蒽醌类成分主要参与涉及细胞凋亡、细胞增殖、炎症途径、细胞信号传导、调节和控制蛋白质活力和功能等反应。细胞成分富集了17条,主要参与质膜细胞质侧的外源成分、胞质、细胞外基质、受体复合体、磷脂酰肌醇3-激酶复合物、细胞质、细胞外间隙等。分子功能共富集了23条,主要参与ATP结合、跨膜受体蛋白酪氨酸激酶活性、激酶活性、金属内肽酶活性、非跨膜蛋白酪氨酸激酶活性、蛋白酪氨酸激酶活性、血红素结合、蛋白质丝氨酸/苏氨酸激酶活性等生物功能,见图4。由KEGG富集分析得到92条通路(P<0.05),得知决明子蒽醌类成分主要涉及癌症的途径、前列腺癌、PI3K-Akt信号通路、癌症的中枢碳代谢、癌症中的蛋白多糖、HIF-1信号通路、胰腺癌、乙型肝炎、ErbB信号通路、肿瘤坏死因子信号通路、大肠癌、神经营养素信号通路等多种重要通路,对KEGG前二十条重要通路进行可视化分析,见图5。PI3K-Akt 信号通路作为前三的核心通路,与肝损伤密切相关,因此将此信号通路作为决明子蒽醌类成分抗5-Fu致肝损伤保护作用的通路之一,具体通路见图6,红色代表靶点作用的部位,可知决明子蒽醌类成分抗肝损伤作用涉及多条通路,且多个靶点在不同通路中发挥作用,如EGFR、AKT1、MAPK1在前十的通路中涉及7个以上的通路,这些通路主要关于细胞增殖、迁移、凋亡与分化、癌症的途径、炎症反应等生物功能。

图4 关键靶点的GO富集分析
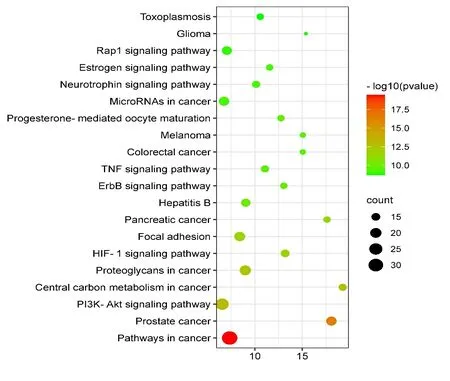
图5 关键靶点的 KEGG 通路富集分析
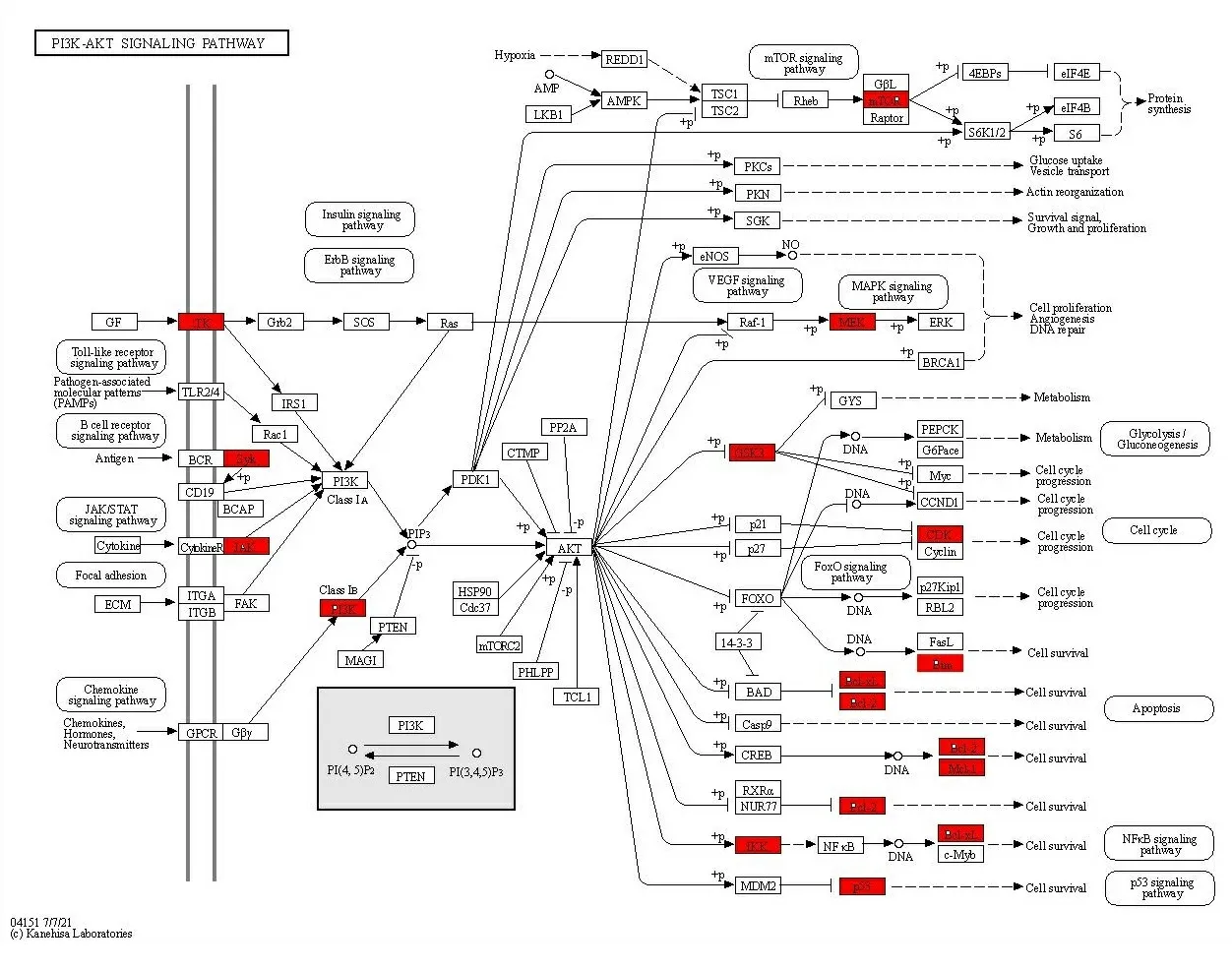
图6 PI3K-Akt 信号通路
2.5 化学成分-靶点蛋白-通路网络的构建 利用Gephi 0.9.2 软件构建活性成分-靶点蛋白-通路网络(见图7)。在网络交互中,存在154个节点,881条边,点表示药物、疾病、靶点、成分和通路,边表示彼此的交互。基于网络模型图,初步探索疾病中活性成分和靶点的作用。
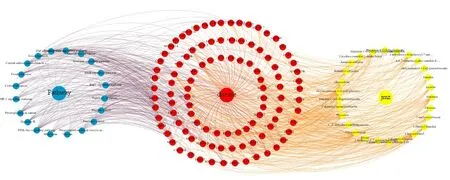
图7 决明子蒽醌类成分(黄色)-靶点(红色)-通路(蓝色)网络
2.6 分子对接结果 利用SYMBL软件,将PPI网络中排名前十的核心靶点与其对应的化学成分进行分子对接,并通过Total Score值评价靶点与化学成分的结合能力,Total Score值>5,表明该成分分子与相应蛋白靶点有较强的相互作用,Total Score值>7则表明成分与靶点的相互作用强烈[14]。对接结果显示,决明子蒽醌类成分Alatemin-1-O-β-D-glucoovranoside与AKT1有较好的结合能力,4,6,7-三甲氧基芦荟大黄素-8-O-β-D-吡喃葡萄糖苷与MAPK1有较好的结合活性,1-去甲基钝叶决明素与EGFR有较好的结合活性,通过PyMol绘制其靶点与成分分子对接模式图进行分析。Alatemin-1-O-β-D-glucoovranoside-AKT1通过Ser-205氨基酸残基发挥作用(见图8),4,6,7-三甲氧基芦荟大黄素-8-O-β-D-吡喃葡萄糖苷-MAPK1的结合位点为Lys-54、Gln-105、Ser-153、Lys-151氨基酸残基(见图9),1-去甲基钝叶决明素与EGFR结合位点为Lys-721、Met-769氨基酸残基(见图10)。
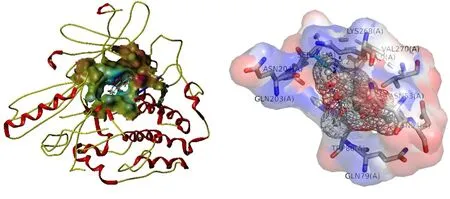
图8 AKT1与Alatemin-1-O-β-D-glucoovranoside对接模式(Total Score值=7.3062)
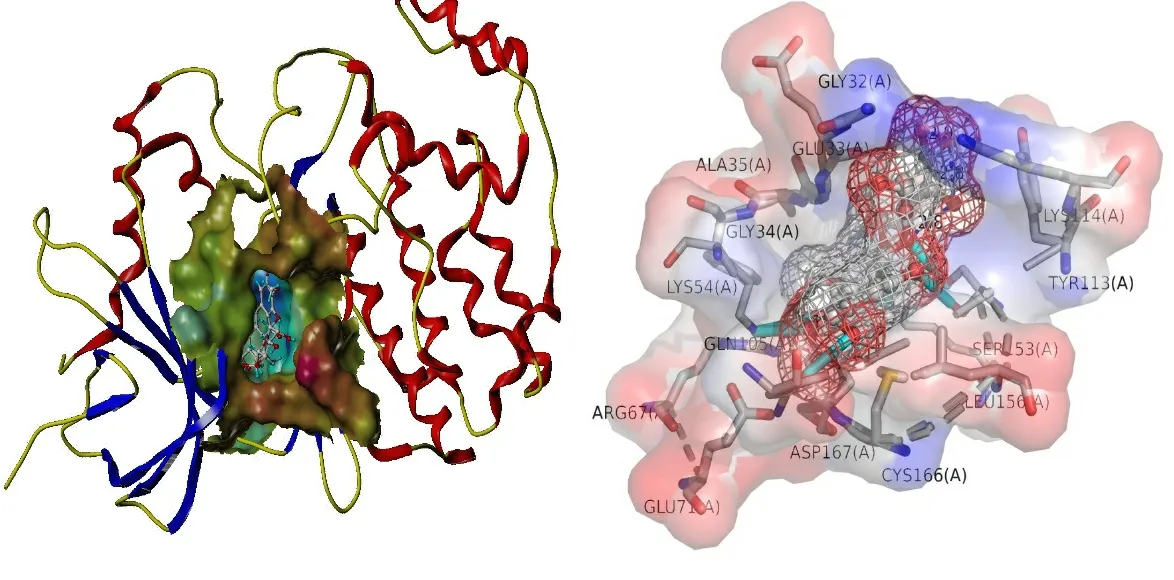
图9 MAPK1与4,6,7-三甲氧基芦荟大黄素-8-O-β-D-吡喃葡萄糖苷对接模式(Total Score值=8.0385)
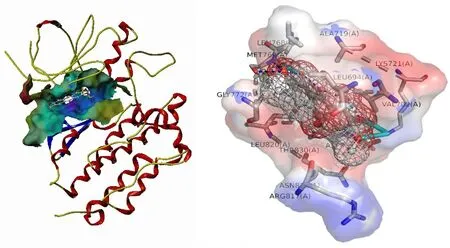
图10 EGFR与1-去甲基钝叶决明素对接模式(Total Score值=7.1642)
3 讨论
现代研究发现,蒽醌类成分是决明子抗肝损伤的主要活性成分[15-16],通过调节肝细胞增殖和凋亡,从而促进肝组织的再生修复[17],本文经文献资料查询,发现橙黄决明素(aurantio-obtusin)、芦荟大黄素(aloe-emodin)、大黄酸(rhein)、大黄素(emodin)、大黄素甲醚(physcion)、大黄酚(chrysophanol)、决明素(obtusin)等27种具有潜在抗肝损伤的蒽醌类成分,其治疗机制与炎症反应、细胞凋亡、代谢的调控等密切相关[18]。
以PPI网络互作图中度值前二十的靶点为核心靶点,作为决明子蒽醌类成分治疗氟尿嘧啶致肝损伤的主要靶点,并通过文献资料查询,对GAPDH、AKT1、STAT3、MAPK1、EGFR、HSP90AA1等度值较大的靶点进行分析。现有研究表明,AKT1抑制肝细胞和肝星状细胞(HSC)的纤维化,同时在药理学上阻断AKT1和AKT2可以抑制纤维化前标志物的表达和纤维化的进展,表明Akt亚型在炎症、细胞增殖、迁移和纤维形成中发挥独特的作用[19-20],且AKT1在肝细胞癌(HCC)细胞中异常表达,并与细胞行为(包括增殖、生存、代谢和肿瘤发生)高度相关[21]。丝裂原活化蛋白激酶1(MAPK1)的高表达促进了细胞的增殖、迁移和侵袭,与肝细胞癌和肝脏脂肪变性有关,长链非编码RNA CRNDE通过miR 217/MAPK1轴促进肝癌细胞增殖、迁移和侵袭,MAPK1激活可增加自噬通量和ATG7水平,对肝脏脂肪变性中由ATG7依赖的自噬介导起有益作用[22-23]。EGFR信号轴已被证明在急性和慢性肝损伤后的肝脏再生以及肝硬化和肝细胞癌(HCC)中发挥关键作用,表皮生长因子受体(EGFR)主要控制增殖、分化和生存,可保护肝细胞凋亡,从而发挥作用,也可作为肝脏再生的有用标志物,强调了EGFR在肝病发展中的重要性[24]。热休克蛋白90AA1(HSP90AA1)可诱导ALD并调节促炎细胞因子、肿瘤坏死因子α和IL-6,和NLRP3炎性小体基因在酒精性肝病中存在正相关关系,抑制HSP90可以降低NLRP3炎性小体活性从而减少炎症因子的分泌,促进酒精性肝硬化的恢复[25]。综上所述,所选择的核心靶点与肝损伤密切相关,决明子蒽醌类成分可能通过这些靶点起到治疗作用。
由KEGG通路分析得到药物的靶点主要富集在癌症信号通路(pathways in cancer)、癌症蛋白多糖信号通路(proteoglycans in cancer)、ErbB信号通路(ErbB signaling pathway)、乙型肝炎病毒信号通路(hepatitis B)、癌症MicroRNAs信号通路(MicroRNAs in cancer)、PI3K-Akt信号传导通路(PI3K-Akt signaling pathway)等信号通路,这些通路与肝损伤的形成与发展密切相关,其中PI3K-Akt通路调控广泛的细胞活动,包括细胞存活、增殖、代谢、血管生成等[26],是同时具有蛋白激酶活性和脂类激酶活性的胞内磷脂酰肌醇激酶[27],研究证明[28],抑制PI3K-Akt信号传导可以降低氧化应激和炎症因子水平,起到抑制活化的肝星状细胞的作用,从而阻止肝纤维化的发生,因此以该通路为切入点进一步挖掘决明子蒽醌类成分抗氟尿嘧啶致肝损伤的作用靶标。
本文基于网络药理学与分子对接的方法,构建药物-疾病-通路网络图显示了决明子多成分、多靶点和多信号通道协同发挥抗氟尿嘧啶致肝损伤的保护作用,确定决明子蒽醌类成分的药效物质,探讨了蒽醌类成分发挥抗肝损伤的作用机制,并通过分子对接技术,初步验证了靶点预测的可靠性,为后续深入研究决明子蒽醌类成分抗肝损伤的作用机制提供了理论依据。

