利奈唑胺治疗革兰阳性菌重症感染新生儿的血药浓度监测与疗效评价
许邦礼,赵青赞,王颖源,冯磊,金志鹏*
1 河南省儿童医院/ 郑州儿童医院,郑州 450018;2 郑 州 大 学 基 础 医 学 院, 郑 州450001
革兰阳性菌为新生儿感染的主要病原菌之一,是临床常见的致病菌。若不及时治疗,新生儿感染革兰阳性菌后可能会进一步加重病情,甚至危及患儿的生命安全[1-2]。然而,近年来随着抗生素的广泛应用,细菌耐药性逐渐变强,增加了临床抗菌治疗工作的难度,也给临床抗菌药物的选择带来严峻挑战。对于重症感染患者,临床常采用万古霉素进行治疗,虽然取得一定疗效,但该药易导致肾毒性,安全性较低。因此,选择抗菌效果好且安全性高的抗菌药物具有重要意义。利奈唑胺是一种 唑烷酮类抗生素,组织穿透力强,作用于细菌蛋白质合成的起始阶段,对多种革兰阳性球菌(如金黄色葡萄球菌、链球菌、耐青霉素肺炎链球菌等)均具有较好的抗菌活性[3-4]。研究表明[5-6],利奈唑胺治疗早期革兰阳性菌重症感染,可有效控制病情及缩短住院时间,对新生儿耐药革兰阳性菌感染治疗效果显著,安全性高,尤其对于耐甲氧西林金黄色葡萄球菌感染危重患者的效果较好。目前,关于利奈唑胺治疗新生儿革兰阳性菌感染的疗效研究较少。本研究通过考察利奈唑胺的血药浓度及临床疗效,以期为新生儿革兰阳性菌感染的治疗提供新思路。
1 资料与方法
1.1 一般资料
选取2017 年5 月~2020 年5 月本院收治的102 例接受利奈唑胺治疗的革兰阳性菌重症感染新生儿的临床资料进行回顾性分析。其中,新生儿败血症43 例,新生儿肺炎28 例,新生儿坏死性小肠结肠炎19 例,其他12 例;男性58 例,女性44 例;日龄10~22 天,平均日龄(16.26±4.27)天;体重1500~3000g,平均体重(2205.17±684.25)g;合并基础病28 例;孕周28~38 周,平均孕周(32.72±3.15)周。本研究经本院医学伦理委员会批准通过(伦理批号:20170322),符合《世界医学协会赫尔辛基宣言》。
纳入标准:①根据临床体征及体外细菌学培养确诊为革兰阳性菌重症感染的新生儿。②临床资料完整者。
排除标准:①对本研究所用药物过敏者。②合并严重肝肾功能障碍者。③使用过其他抗革兰阳性菌药物者。
1.2 治疗方法
新生儿接受利奈唑胺片(Pharmacia & Upjohn Company,注册证号H20181089,规格 600mg)治疗72h 后,由临床医师每日评定初始治疗效果,疗程14 天。利奈唑胺片的用法用量:口服,10mg/kg,tid。
1.3 观察指标
1.3.1 新生儿病原学
采用BacT/ALERT 3D 全自动细菌培养仪(法国梅里埃公司)进行病原菌的培养;使用VITEK 2 Compact 全自动微生物鉴定系统(法国梅里埃公司)进行菌株鉴定;药敏试验依据美国临床和实验室标准化协会(2014 年)标准。
1.3.2 血药浓度
新生儿连续给药6 天至利奈唑胺血药浓度达稳态后,在第7 天给药前30min 取静脉血1ml,采用荧光偏振免疫分析法测定利奈唑胺血药浓度。检测仪器为AxSYM 全自动化学发光免疫分析仪(美国雅培公司);试剂为AxSYM 配套利奈唑胺试剂盒(深圳振强生物技术有限公司)。
1.3.3 临床疗效
根据《抗菌药物临床应用指导原则》[7],抗菌药物疗效分为痊愈、显效、进步、无效4 级。痊愈:症状、体征、实验室检查和细菌学检查均恢复正常;显效:上述指标有1 项未完全恢复正常;进步:病情好转,但不明显;无效:用药72h 后病情无明显好转甚至加重。总有效率=(痊愈例数+显效例数)/总例数×100%。
革兰阳性菌清除:治疗后血培养转阴。未清除:治疗后血培养仍为阳性或转为其他类型革兰阳性菌。
1.3.4 血清指标
于给药前和给药后抽取新生儿静脉血3ml,3000r/min 离心30min,获取血清检验样本,冷冻保存待测。采用7060 全自动生化分析仪(日本日立公司)检测血清肌酐(creatinine,Cr)、总胆红素(total bilirubin,TBIL)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)水平。
1.3.5 不良反应
统计治疗期间新生儿呕吐、腹泻、皮疹、血小板减少(血小板计数<100×109/L)等不良反应发生情况。
1.4 统计学处理
采用SPSS 22.0 软件分析处理数据。计数资料以n(%)表示,行χ2检验;计量资料以x±s表示,行t检验。P<0.05 表示有统计学差异。
2 结果
2.1 新生儿病原学
102 例革兰阳性菌重症感染新生儿中,共检出革兰阳性菌63 株(27 株耐药)。其中,无乳链球菌28 株、金黄色葡萄球菌23 株、表皮葡萄球菌6 株、溶血性葡萄球菌6 株。药敏结果显示均对利奈唑胺敏感。
2.2 血药浓度
给药后,新生儿平均利奈唑胺谷浓度为8.41μg/ml。利奈唑胺血药浓度监测结果见表1。

表1 新生儿利奈唑胺血药浓度监测结果
2.3 临床疗效
治愈57 例,显效35 例,进步6 例,无效4 例,总有效率90.20%;革兰阳性菌清除率92.06%。见表2。
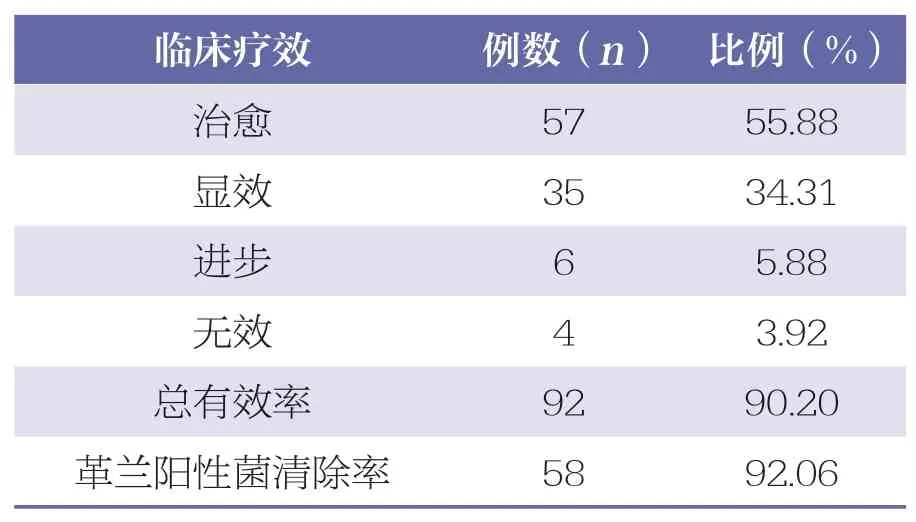
表2 利奈唑胺治疗新生儿革兰阳性菌重症感染的疗效分析
2.4 血药浓度与临床疗效的关系
利奈唑胺血药浓度5~10μg/ml 的新生儿治疗总有效率高于血药浓度<5μg/ml 者(χ2=10.293,P=0.001)、与 血 药 浓 度11~20μg/ml 和>20μg/ml者 比 较 无 统 计 学 差 异(χ2=0.596,P=0.440 和χ2=3.717,P=0.054)。见表3。

表3 利奈唑胺血药浓度与临床疗效的关系 n(%)
2.5 血清指标
给药后,新生儿血清Cr、TBIL、AST、ALT水平低于给药前(P<0.05)。见表4。

表4 给药前和给药后新生儿血清指标变化 n=102,x±s
2.6 不良反应
共出现17 例药物不良反应,总发生率16.67%。其中,呕吐1 例、腹泻8 例、皮疹3 例、血小板减少5 例。给药后的第5 天和第6 天均有4 例新生儿出现腹泻,服用蒙脱石散和双歧杆菌三联活菌散治疗3 天后好转。给药后的第5~11 天出现5 例血小板减少,3 例静脉滴注丙种球蛋白、2 例输注血小板,治疗2~5 天后好转。1 例呕吐和3 例皮疹未行特殊干预处理,停药后自行消失。
3 讨论
3.1 革兰阳性菌感染
近年来,随着革兰阳性菌的增多,感染的概率也越来越高。在新生儿感染性疾病中,革兰阳性菌为主要病原菌。革兰阳性球菌是一种易引发新生儿重症感染的致病菌,也是引发社区和院内感染的重要病原菌。抗生素的大量使用导致耐药菌株的数量急剧增多,细菌耐药情况日趋严重,耐甲氧西林金黄色葡萄球菌、耐青霉素肺炎链球菌等病原菌的临床检出率也逐年升高,严重影响抗菌药物的治疗效果,甚至会引起革兰阳性菌重症感染,对患儿生命健康造成严重威胁[8-9]。临床常采用万古霉素作为抗菌治疗药物,但易出现肾毒性,安全性较低。因此,选择抗菌效果好且安全性高的抗菌药物具有重要意义。
3.2 利奈唑胺的抗菌效果
利奈唑胺是一类新型化学合成抗菌药,也是第1 批被用于临床的抗菌药物,其相对分子质量较小,组织穿透力强,对多种革兰阳性菌及耐药革兰阳性球菌均具有抗菌活性。利奈唑胺抑菌效果较强,通过作用于细菌蛋白质合成的起始阶段,抑制细菌蛋白质的合成,从而达到清除革兰阳性球菌的目的[10-11]。利奈唑胺可抑制大部分革兰阳性菌,治疗新生儿感染疗效显著,特别是治疗耐甲氧西林金黄色葡萄球菌感染的危重患者效果较好,具有较高的细菌清除率,可作为临床用药选择[12-14]。
3.3 利奈唑胺的血药浓度监测及疗效评价
利奈唑胺用于治疗新生儿革兰阳性菌重症感染的血药浓度及疗效研究仍相对较少。本研究中,总有效率90.20%,革兰阳性菌清除率92.06%。表明利奈唑胺治疗新生儿革兰阳性菌重症感染的临床疗效较好,细菌清除率较高。相关研究证实,利奈唑胺治疗革兰阳性球菌重症感染,可缩短药物起效时间和住院时间,革兰阳性球菌清除率93.02%,安全性高[15]。本研究中,给药后新生儿平均利奈唑胺谷浓度为8.41μg/ml。利奈唑胺血药浓度5~10μg/ml者的总有效率高于血药浓度<5μg/ml 者(P<0.05),表明药物浓度是保证临床疗效的重要条件。
3.4 利奈唑胺的不良反应
相关研究表明,利奈唑胺谷浓度对临床疗效具有较高的预测价值,通过监测血药浓度制定个体化给药方案,可提高临床治愈率,但利奈唑胺易引发呕吐、腹泻、皮疹、血小板减少等不良反应[16-18]。因此,在应用利奈唑胺的过程中,应严密监测患儿的血液学指标,积极预防和避免药物不良反应的发生。本研究中,给药后新生儿血清Cr、TBIL、AST、ALT 水平均降低。102 例新生儿中,共出现17 例药物不良反应,总发生率16.67%。新生儿腹泻服用蒙脱石散和双歧杆菌三联活菌散治疗3 天后好转;血小板减少经静脉滴注丙种球蛋白或输注血小板治疗2~5 天后好转;呕吐和皮疹未行特殊干预处理,停药后自行消失。表明利奈唑胺能改善新生儿肝功能指标,且未出现严重不良反应,安全性较高。季文媛等[16]研究结果亦表明,利奈唑胺治疗新生儿耐药革兰阳性球菌败血症的疗效显著,且不会增加不良反应的发生率,值得临床推广应用。
综上所述,利奈唑胺治疗新生儿革兰阳性菌重症感染疗效较好,可改善肝功能指标,且安全性较好。目前关于利奈唑胺治疗新生儿革兰阳性菌重症感染的血药浓度及疗效评价的研究较少,仍需要大样本研究进一步评估其在新生儿感染中的治疗效果及安全性。同时,监测血药浓度对于确保疗效、用药安全与合理等具有重要的临床意义,可作为后期临床研究中的重点研究方向。

