脂肪酸酰胺水解酶在不同癌症中的表达及其与预后和免疫微环境的关系
马寒素 陈韵 刘玉琛 曾乐立 许宇智 方烁 陈昱 潘逸航
中山大学附属第七医院精准医学中心(广东深圳 518107)
癌症是全球范围内人类死亡的第二大原因,晚期、转移型及复发型癌症的药物敏感及耐药问题使得癌症治疗成功率非常低[1-3],亟需运用预后标志物进行精细的分子分型并开发整合治疗方案以实现癌症的精准治疗。因此,深入挖掘更加精准、有效的临床分子分型和预后预测标志物具有非常重要的现实意义。泛癌分析是指通过对各种类型癌症中转录本表达、蛋白表达、基因变异、基因拷贝数变化以及甲基化等表观遗传学修饰变化展开多组学分析,旨在阐明癌症的共同特征、探索异质性的产生机制不同癌症中发生发展及构建分子分型体系[4-5],对全面了解癌症发生发展的机制以及指导临床治疗具有重要的作用和意义。
FAAH 基因编码的脂肪酸酰胺水解酶(fatty acid amide hydrolase,FAAH)是一类能够水解生物活性信号分子脂肪酸酰胺(FAAs),进而终止信号传导的膜结合型丝氨酸水解酶[6]。该酶属于丝氨酸水解酶家族,参与调节多种内源性大麻素与各种疾病相关的功能,包括疼痛、炎症、神经退行性变、抑郁、焦虑等因素[6]。目前,关于FAAH 的研究主要集中于应用FAAH 抑制剂如URB597、JZL195、JNJ-1661010、PF-04457845 等提高人体内内源性大麻素水平以治疗疼痛、炎症和情绪障碍等多种疾病[7-10]。尽管FAAH 的抑制剂已经广泛应用,但是FAAH 基因在癌症中的表达、作用、生存预后相关性及免疫微环境调节等方面能尚不明确。
因此,本研究拟利用TCGA 癌症数据库联合GTEx 正常组织数据库中的转录组及生存预后数据,运用生物信息学分析方法,探究FAAH 在人类癌症中的表达谱及其与癌症预后的关系。此外,运用CIBERSORT 算法和Pearson 相关性分析FAAH 表达与肿瘤免疫微环境之间的关系,为进一步明确FAAH 作为预后标志物及治疗靶点提供理论依据。
1 资料与方法
1.1 资料来源 本研究使用加州大学圣克鲁兹分校(UCSC)癌症基因组数据网站(https://tcga.xenahubs.net,2021年9月访问)获得了TCGA(The Cancer Genome Atlas)数据库(https://portal.gdc.cancer.gov/)中33 种癌症11 160 例癌症患者的癌和非癌样本的转录组数据集以及相应的临床病理数据,同时结合GTEx(Genotype-Tissue Expression)数据库(https://portal.gdc.cancer.gov/)生前健康的人体各器官组织尸检样本RNA 测序数据集。(1)TCGA数据库转录组数据集包括:肾上腺皮质癌(ACC)92 例,膀胱移行细胞癌(BLCA)412 例,浸润性乳腺癌(BRCA)1 097例,宫颈鳞状细胞癌(CESC)307例,胆管癌(CHOL)45 例,结肠癌(COAD)459 例,弥漫性大B 细胞淋巴瘤(DLBC)48 例,食管癌(ESCA)185 例,多形性成胶质细胞瘤(GBM)596 例,头颈部鳞状细胞癌(HNSC)528 例,肾嫌色细胞癌(KICH)113 例,肾透明细胞癌(KIRC)537 例,肾乳头状细胞癌(KIRP)291 例,急性髓性白血病(LAML)200例,脑低级别胶质瘤(LGG)515 例,肝脏肝细胞癌(LIHC)377 例,肺腺癌(LUAD)522 例,肺鳞状细胞癌(LUSC)504 例,间皮瘤(MESO)87 例,卵巢浆液性囊腺癌(OV)587 例,胰腺癌(PAAD)185 例,嗜铬细胞瘤和副神经节瘤(PCPG)179 例,前列腺腺癌(PRAD)500 例,直肠腺癌(READ)170 例,肉瘤(SARC)261例,皮肤黑色素瘤(SKCM)470例,胃腺癌(STAD)443 例,睾丸生殖细胞肿瘤(TGCT)134 例,甲状腺癌(THCA)507 例,胸腺瘤(THYM)124 例,子宫内膜癌(UCEC)548例,子宫癌肉瘤(UCS)57例,葡萄膜黑素瘤(UVM)80 例。(2)GTEx 数据库转录组数据集包括:肾上腺(AdrenalGland)161 例,膀胱(Bladder)13 例,血液(Blood)595 例,血管(Blood-Vessel)753 例,骨髓(BoneMarrow)102 例,脑(Brain)2852 例,乳房(Breast)221 例,子宫颈(CervixUteri)11 例,结肠(Colon)384 例,食管(Esophagus)805 例,输卵管(FallopianTube)7,心脏(Heart)493 例,肾脏(Kidney)38例,肝脏(Liver)141例,肺(Lung)762例,肌肉(Muscle)478例,神经(Nerve)335例,卵巢(Ovary)112,胰腺(Pancreas)203 例,前列腺(Prostate)122 例,唾液腺(SalivaryGland)71 例,皮肤(Skin)977 例,小肠(SmallIntestine)106 例,脾脏(Spleen)121 例,胃(Stomach)209 例,睾丸(Testis)208 例,甲状腺(Thyroid)366 例,子宫(Uterus)93 例。本研究仅使用了开放获取的数据,无需获得伦理委员会的批准。
1.2 FAAH 的泛癌表达分析 (1)为了比较癌组织和癌旁组织基因的表达水平,本研究从33 种TCGA 癌症类型中提取了FAAH 基因转录组表达数据,利用R 语言环境将癌组织、癌旁组织和正常组织RNA 数据整合成一个表达矩阵。(2)为评估不同肿瘤分期中FAAH 基本表达水平的变化,对提取到的TCGA 临床分期StageⅠ、StageⅡ及StageⅢ或StageⅣ患者的FAAH 表达数据进行比较。
1.3 FAAH与生存预后的关系 以FAAH中位表达水平将患者分为FAAH 高表达组和低表达组[11-12],利用患者ID 匹配表达矩阵和临床生存随访信息,比较患者总生存期(overall survival,OS)、疾病特异性生存期(disease Free survival,DSS)、无进展间期(disease free survival,PFI)和无病间期(progression free survival,DFI)等预后指标的差异。不同类型癌症FAAH 中位数表达水平数值(Log2TPM)如下:ACC=3.195,BLCA=3.702,BRCA=3.679,CESC=3.013,CHOL=3.803,COAD=4.383,DLBC=1.554,ESCA=2.788,GBM=2.286,HNSC=2.490,KICH=3.058,KIRC=3.549,KIRP=4.094,LAML=3.279,LGG=3.237,LIHC=3.583,LUAD=3.306,LUSC=2.655,MESO=2.017,OV=2.944,PAAD=3.309,PCPG=2.554,PRAD=5.977,READ=4.432,SARC=1.725,SKCM=1.442,STAD=3.021,TGCT=3.055,THCA=3.932,THYM=3.319,UCEC=3.917,UCS=2.77,UVM=2.034。
1.4 FAAH 与肿瘤免疫微环境的关系
1.4.1 FAAH 与肿瘤免疫细胞的关系 首先利用CIBERSORT 网 站(https://cibersort.stanford.edu/)分析TCGA 数据库33 种不同癌症患者的转录组数据,比较FAAH 高、低表达两组患者肿瘤组织中免疫细胞组成的差异,计算log2FC 并作图,变化倍数(FC)=每一种免疫细胞的低表达组均值/高表达组均值。
1.4.2 FAAH 与肿瘤免疫抑制基因的关系 选取TCGA 数据库33 种癌症转录组数据中的47 个免疫抑制基因,将其与FAAH 基因进行相关性分析,并绘制相关性热图。免疫抑制基因包括:BTLA、CD200、TNFRSF14、NRP1、LAIR1、TNFSF4、CD244、LAG3、ICOS、CD40LG、CTLA4、CD48、CD28、CD200R1、HAVCR2、ADORA2A、CD276、KIR3DL1、CD80、PDCD1、LGALS9、CD160、TNFSF14、IDO2、ICOSLG、TMIGD2、VTCN1、IDO1、PDCD1LG2、HHLA2、TNFSF18、BTNL2、CD70、TNFSF9、TNFRSF8、CD27、TNFRSF25、VSIR、TNFRSF4、CD40、TNFRSF18、TNFSF15、TIGIT、CD274、CD86、CD44 和TNFRSF9。
1.5 统计学方法 数据分析均采用R 语言(版本4.0.3)。癌组织与癌旁组织FAAH 的表达、FAAH 高表达组和低表达组免疫细胞差异比较用Wilcoxon秩和检验。不同肿瘤分期癌组织中FAAH 的表达差异比较用多重t检验。生存分析采用Kaplan-Meier 曲线和log-rank 检验。分析基因关系采用Pearson 相关性分析。以P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 FAAH 的泛癌表达分析 (1)相对于癌旁正常组织样本,在7 种癌症中FAAH 显著高表达(P<0.05),包 括BRCA、COAD、LAML、PRAD、READ、THYM 和UCEC;与此相反,在包括ACC、DLBC、ESCA、GBM、KICH、KIRP、LGG、LIHC、LUAD、LUSC、PAAD、SKCM、STAD、TGCT 及THCA在内的15 种癌组织中,FAAH 基因表达显著降低(P<0.05),见图1A。(2)TCGA 临床分期数据分析显示,在BLCA、KICH 和THCA 等癌症晚期中FAAH 表达下调,在STAD 等癌症晚期中表达稳定(图1B)。其中,与正常甲状腺组织相比,THCA早、晚期肿瘤中FAAH 基因表达依次显著下调。
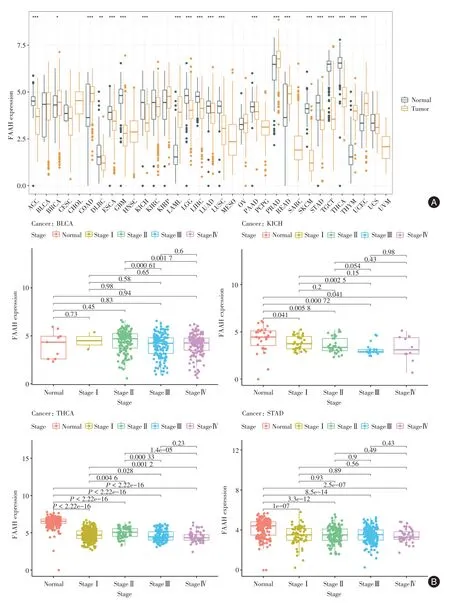
图1 FAAH 在不同癌症和分期中的表达水平Fig.1 FAAH expression profiles in different cancers and stages
2.2 FAAH 与生存预后的关系 (1)与FAAH 低表达组相比,在KIRP、KIRC、LUAD、THYM、STAD 和UCEC 等癌症中FAAH 高表达组OS 更长,差异有统计学意义(P<0.05),STAD 和KIRC 结果见图2A。(2)在KIRP、KIRC、LUAD、STAD(P=0.020)和UCEC(P= 0.001)等癌症中,FAAH 高表达组DSS 优于FAAH 低表达组,差异有统计学意义(P<0.05),STAD 和KIRC 结果见图2B。(3)在STAD、KIRC、LUAD 和KICH 等癌症中,FAAH 高表达组比低表达组比PFI 更长,预后更好(P<0.05),STAD 和KIRC结果见图2C。(4)在STAD 中,FAAH 高表达组DFI优于低表达组(P=0.008),见图2D。

图2 胃腺癌STAD 和肾透明细胞癌KIRC 中FAAH 表达与生存时间的关系Fig.2 Relationship between FAAH expression and survival time in gastric adenocarcinoma STAD and renal clear cell carcinoma KIRC
2.3 FAAH 与肿瘤免疫微环境的关系
2.3.1 FAAH与肿瘤免疫细胞的关系 (1)在KIRC中,FAAH 高表达组和低表达组CD8+T 细胞(Tcells CD8)、CD4 记忆T 细胞激活(T cells CD4 memoryactivated)、滤泡辅助性T细胞(T cell follicular helper)、γδT 细胞(T cells gamma delta)、NK 静息细胞(NK cells resting)、NK 激活细胞(NK cell sactivated)、单核细胞(monocytes)、M0 巨噬细胞(macrophages M0)、静息态树突状细胞(dendritic cells resting)、肥大细胞静息(mast cells resting)差异有统计学意义(P<0.05)。其中,CD4 记忆T 细胞激活、γδT 细胞、M0 巨噬细胞在FAAH 低表达组中聚集显著增多;NK 静息细胞和静息态树突状细胞等聚集显著下降(图3A)。(2)在STAD 中,FAAH 高表达组和低表达组的CD4 记忆T 细胞激活、NK 激活细胞、单核细胞、M0 巨噬细胞和肥大细胞静息差异有统计学意义(P<0.05)。其中,FAAH低表达组单核细胞和肥大细胞静息富集显著上调;CD4 记忆T 细胞激活、NK 激活细胞和M0 巨噬细胞富集显著减少(图3B)。
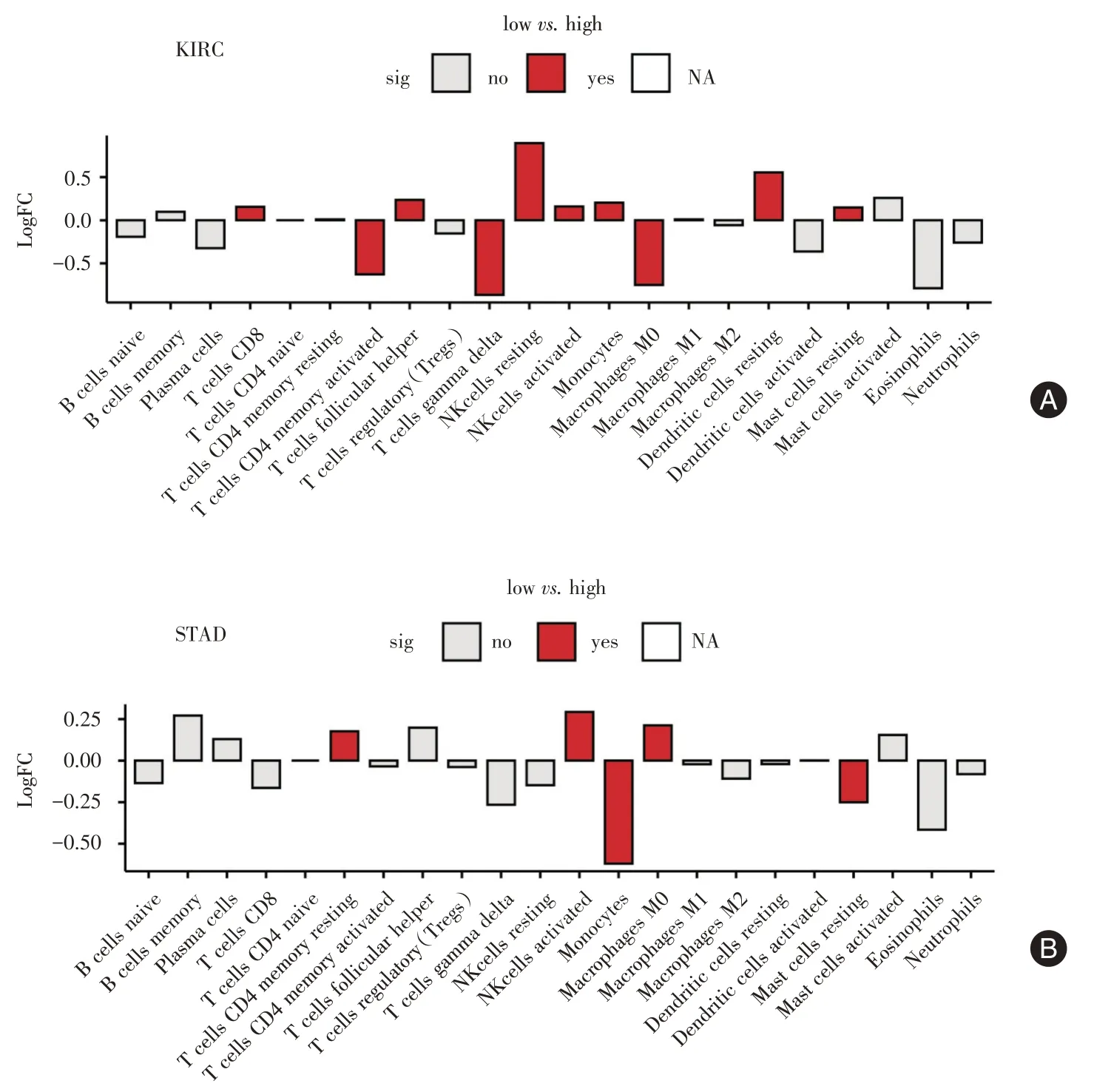
图3 KIRC 和STAD 中FAAH 与肿瘤浸润免疫细胞的关系Fig.3 Relationship between FAAH and tumor-infiltrating immune cells in KIRC and STAD
2.3.2 FAAH 与肿瘤免疫抑制基因的关系 在BLCA、BRCA、COAD、LGG、LIHC、LUAD 和STAD等多种肿瘤中,FAAH 的表达与TIGIT、BTLA、CD 244、ICOS、CD 40、CD 48、CD 28、CD 200R1、TMIGD 2 和PDCD 1 等基因表达水平呈负相关(图4)。

图4 FAAH 与肿瘤免疫抑制基因的相关性Fig.4 Correlation between FAAH and tumor immunosuppressive genes
3 讨论
本研究对FAAH 在各种癌症中与预后相关性及其与免疫微环境调控的关系进行了探讨。首先,在表达水平上的分析发现FAAH 在癌症中广泛存在表达改变,并且在胰腺癌(PAAD)、肺腺癌(LUAD)、胃腺癌(STAD)等多种癌症中的表达普遍下调。在分期差异表达分析中,膀胱移行细胞癌(BLCA)、KICH、THCA 和STAD 等少数肿瘤的分期与FAAH 的表达存在紧密联系。在这些肿瘤的
晚期(StageⅢ或Ⅳ)中,FAAH 表达水平显著下调。这些结果表明,FAAH 可能参与调控上述癌症的进展。其次,应用Kaplan-Meier 进行的生存分析,发现在KIRC、LUAD、STAD、KIRP 等癌症中FAAH高表达的患者预后更好。该结果提示,FAAH在这些癌症中可能充当保护因子的作用。
内源性大麻素系统(endocannabinoid system,ECS)是生物体内重要的调节系统,可以调节神经活动、控制心血管张力、能量代谢、免疫以及生殖等生理活动[13]。然而,ECS 在癌症当中的作用尚未阐明。FAAH 是内源性大麻素系统的重要组成,主要负责水解花生四烯酰乙醇酰胺(arachidonoyl ethanol amide,AEA)。大麻素是当前被研究最多的ESC 成分。有研究显示大麻素及其衍生物能够缓和化疗引起的恶心、呕吐和疼痛等癌症相关症状,并且抑制肿瘤恶化[14]。然而,最新的研究表明,AEA 发挥抗肿瘤免疫抑制的作用,并且血清中高AEA 水平的癌症患者生存率较差[15]。有研究表明,FAAH 基因缺失或用FAAH 抑制剂处理的小鼠会导致内源性AEA 水平的升高[16-17]。XIONG 等[15]最新的研究发现,大麻素的主要成分Δ9-四氢大麻酚(THC)具有降低PD-1 阻断的疗效,AEA 可以阻碍抗肿瘤免疫,表明内源性大麻素系统(ECS)具有免疫抑制作用。这些结果都表明,FAAH 作为AEA 的主要水解酶或通过干预免疫微环境参与调控肿瘤进程。然而,具体的机制仍需要进一步研究探明。
在癌症的发生和发展过程中,肿瘤不断进化并可能呈现出各种机制来逃避肿瘤免疫监视及抑制抗肿瘤免疫反应。肿瘤免疫逃逸的一个主要机制就是免疫检查点通路的参与[18-19]。免疫检查点(immune check point)是一类由免疫细胞表达的免疫抑制分子,能够调节免疫激活程度,对防止自身免疫作用的发生具有重要作用。免疫检查点分子的表达和功能异常是很多疾病发生的重要原因[20-23]。在本研究中,相关性分析也证明了FAAH表达水平与癌症免疫相关。CIBERSORT 是基于线性支持向量回归(linear support vector regression)以不同免疫细胞亚型的表达矩阵对组织或细胞RNA 表达矩阵进行去卷积后计算22 种白细胞相对比例的工具[24]。本研究利用CIBERSORT 分析发现,在KIRC 和STAD 中FAAH 表达水平与CD4+T细胞、CD8+T 细胞、B 细胞、中性粒细胞、巨噬细胞和树突状细胞的浸润程度显著相关。肾透明细胞癌中FAAH 低表达组中CD4+T 记忆细胞与γδT 细胞显著减少(P<0.05),胃腺癌中FAAH 低表达组浸润显著较少的单核细胞(P<0.05),这些免疫抑制表现与低表达组生存预后较差相一致。此外,FAAH 与40 多个常见的免疫抑制相关基因的相关性分析发现,在BLCA、BRCA、COAD、LGG、LIHC、LUAD 和STAD等多种肿瘤中,FAAH的表达与TIGIT、BTLA、CD 244、ICOS、CD 40、CD 48、CD 28、CD 200R1、TMIGD 2 和PDCD 1 等基因表达水平呈负相关。在低表达预后较差的肾透明细胞癌、胃腺癌中,FAAH 低表达组与包含免疫检查点基因在内的多个免疫抑制相关基因的表达升高相关,提示FAAH 可能通过影响免疫抑制基因表达来调控免疫微环境形成,这方面内容需要进一步的分子生物学及细胞生物学实验验证。肿瘤微环境的抑制性变化及异质性对肿瘤发生发展、疗效差别及耐药性有巨大影响[25-29]。这提示,FAAH 可能通过调节特异性免疫检查点基因的表达水平来调节肿瘤的免疫模式。
综上所述,本研究表明FAAH 在多种肿瘤中差异表达并与预后显著相关,可作为包括膀胱移行细胞癌、肾透明细胞癌、肺腺癌及胃腺癌在内的多种恶性癌症的潜在预后生物标志物,并与免疫浸润有关,可作为癌症免疫治疗的潜在靶点。

