金属酚醛/两性离子聚合物涂层聚丙烯补片的制备及其抗蛋白吸附性能
王 茜,乔燕莎,王君硕,李 彦,3,王 璐,3
(1.东华大学 纺织学院,上海 201620;2.东华大学 纺织面料技术教育部重点实验室,上海 201620;3.东华大学 纺织行业生物医用纺织材料与技术重点实验室,上海 201620)
人体组织或器官通过薄弱或缺损的部位向外形成突起,称为疝气。据流行病学资料统计,疝气在全球范围内的发病率高达5%,无张力疝修补术已经成为普外科最常见的手术之一[1-2]。聚丙烯(PP)补片作为临床使用最广泛的一类疝修补片[3],由于其材料本身缺乏足够的生物相容性,植入人体后会引发过度的异物反应,阻碍组织与血管的正常新生,导致黏连、感染、慢性疼痛等并发症的发生。据不完全统计,在开放或腹腔镜腹股沟疝修补术后,约有10%~12%的患者会产生慢性疼痛[4],植入材料引起的异物反应极大影响了患者的术后愈合。
植入物引起的异物反应可归纳为蛋白质吸附、急性炎症、慢性炎症和纤维化包封4个阶段[5]。其中,非特异性蛋白吸附被认为是引发机体免疫应答的重要步骤[6]。两性离子聚合物(ZPs)是一类在同一单体单元中同时包含带负电荷和带正电荷基团的亲水聚合物。近年来,利用ZPs构建亲水防污表面已被证明是降低蛋白质吸附的有效手段,ZPs中的正负电荷通过静电作用与水分子结合,为蛋白在材料表面的吸附筑成能量壁垒[7]。为实现两性离子与疏水材料的结合,通常采取可逆加成断裂链转移[8-10]和原子转移自由基聚合[11-13]的方式对两性离子进行表面接枝;然而,上述方式制备过程繁琐复杂、耗时较长且涉及到引发剂的残留[14],因此,亟需一种简便高效且生物温和的方式将ZPs与植入式医疗器械的惰性表面相结合。
受茶渍黏附机制的启发,本文利用单宁酸(TA)与金属三价铁离子(Fe3+)的配位作用在PP补片表面经由层层自组装(LBL)搭建金属酚醛网络(MPN),之后凭借TA与ZPs间的氢键和阳离子-π键等多重作用,将ZPs——聚羧酸甜菜碱甲基丙烯酸酯(PCBMA)固定在PP补片上,探究涂层补片的抗蛋白吸附性能及细胞毒性。
1 实验部分
1.1 材料与仪器
材料:聚丙烯(PP)补片,常州市润源医疗用品科技有限公司;丙酮、三氯化铁(FeCl3)、三羟甲基氨基甲烷(Tris)、盐酸(HCl)、过硫酸铵(APS)、亚硫酸氢钠(SBS),国药集团化学试剂有限公司;单宁酸(TA),文冬化工有限公司;3-((2-(甲基丙烯酰氧)乙基)二甲基铵)丙酸酯(CBMA),上海易恩化学技术有限公司;磷酸缓冲溶液干粉(PBS),索莱宝科技有限公司;牛血清白蛋白(BSA)、异硫氰酸荧光素(FITC)、细胞计数试剂盒(CCK-8),上海翊圣生物科技有限公司。
仪器:DXS-10ACKT型扫描电子显微镜,日本日立株式会社;Avance3HD600 MHz型全数字化核磁共振谱仪,瑞士布鲁克公司;Spectrum Two型傅里叶变换红外光谱仪,美国珀金埃尔默股份有限公司;Escalab 250Xi型X射线光电子能谱仪(XPS)、Multiskan Sky型全波长酶标仪,美国赛默飞世尔科技有限公司;OCA15EC型接触角测量仪,德国Data Physics公司;NANO ZS型Zeta电位及粒径分析仪,英国马尔文仪器;YG(B)026G型纺织品多功能强力仪,浙江大荣纺织仪器有限公司。
1.2 涂层聚丙烯补片的制备
1.2.1 单宁酸-金属酚醛涂层的制备
将PP补片先后置于丙酮和去离子水中,分别使用超声波清洗15 min,干燥;在60 ℃下将PP补片置于0.3 mol/L APS溶液中水浴处理6 h,将PP补片亲水预活化,干燥后待用。
将预活化后的PP补片先浸入10 mg/mL的FeCl3溶液浸泡5 min,清洗干燥,再浸入10 mg/mL的TA溶液中5 min,清洗干燥,以此为1个循环,共循环处理10次;随后将补片置于Tris-HCl缓冲溶液(0.05 mol/L,pH=8.5)中浸渍30 min。反应结束后,用去离子水充分清洗,干燥,将最终得到的补片记为Fe/TA-PP。
1.2.2 两性离子聚合物的制备
在0.1 g/mL的CBMA水溶液中加入2%的APS和0.5%的SBS,在室温下搅拌反应12 h,反应结束后加入乙醇,分离提纯得到聚合物PCBMA。
1.2.3 两性离子聚合物涂层的制备
配制2 mg/mL PCBMA的Tris-HCl(0.05 mol/L,pH=8.5)溶液,将Fe/TA-PP补片浸渍于其中,在37 ℃、60 r/min的恒温摇床中反应12 h。反应结束后,使用去离子水充分清洗、干燥,所得补片标记为PCBMA-Fe/TA-PP。
1.3 性能测试与表征
1.3.1 微观形貌观察
将PP、Fe/TA-PP和PCBMA-Fe/TA-PP补片固定于样品台,真空镀金后在扫描电子显微镜(SEM)下对补片单丝表观形貌进行观察。
1.3.2 理化性能表征
用氘代水(D2O)溶解PCBMA,采用全数字化核磁共振谱仪对其核磁共振氢谱(1H NMR)进行扫描,评估PCBMA的组成和化学结构;采用X射线光电子能谱仪对PCBMA-Fe/TA-PP的X射线光电子能谱(XPS)进行扫描,采用傅里叶变换红外光谱仪对PP、Fe/TA-PP和PCBMA-Fe/TA-PP进行傅里叶变换红外光谱(FT-IR)扫描分析,表征补片的表面化学组成与结构。
将PP、Fe/TA-PP和PCBMA-Fe/TA-PP固定于接触角测量仪样品台上,采用液滴法测试PP的水接触角,采用气泡法测试Fe/TA-PP和PCBMA-Fe/TA-PP的水接触角,表征其亲疏水性。将PP、Fe/TA-PP和PCBMA-Fe/TA-PP固定于Zeta电位及粒径分析仪样品台上,浸没于示踪粒子溶液中,对其表面电位进行测试。
1.3.3 力学性能测试
参照ASTM D5035—2011 (R2019)《织物断裂强力和伸长率的标准试验方法(条样法)》对PP和PCBMA-Fe/TA-PP补片进行单轴拉伸测试。分别沿横向与纵向裁剪成25 mm×75 mm的条形试样,标距设为50 mm,在样品条的夹持方向与受力方向平行时,以200 mm/min的速度拉伸试样直至样品断裂。若测试过程中样品条滑移或在夹头夹持处发生断裂,则该数据无效。每个方向重复测试5次,取平均值。
1.3.4 抗蛋白吸附性能测试
选用BSA模拟补片体内使用环境中的蛋白质,测试补片的抗蛋白吸附性能。将PP、Fe/TA-PP和PCBMA-Fe/TA-PP补片裁剪成1 cm×1 cm规格,分别浸没于10 mg/mL的BSA溶液中,溶剂为PBS溶液(0.01 mol/L,pH=7.4),将样品浸泡12 h后用去离子水清洗,采用1 mg/mL FITC荧光标记BSA,避光标记4 h后,用PBS溶液(0.01 mol/L,pH=7.4)清洗、干燥,在倒置荧光显微镜下观察蛋白质的吸附情况。
1.3.5 细胞毒性测试
采用CCK-8测试PCBMA-Fe/TA-PP补片的细胞毒性。以1×104个/孔的密度将小鼠成纤维细胞(L929)接种在24孔细胞培养板中,稳定贴附后加入灭菌的PP和PCBMA-Fe/TA-PP补片,设置空白对照样,每个样品设置3个平行样。培养24 h后,将CCK-8染液加入24孔板孵育2 h,测试其在450 nm波长下的吸光度值,取平均值(l1、l2分别为样品和对照样品的吸光度值)。利用下式计算相对细胞活力:
R=l1/l2×100%
2 结果与讨论
2.1 补片涂层的微观形貌分析
图1示出补片在SEM下的微观形貌照片。由图1(a) 和(b)可以看出,由Fe3+和TA构成的MPN层在PP单丝上呈现均匀涂覆,因而PP与Fe/TA-PP在形貌上未表现出显著差异。通过对涂层形成过程进行分析可知,Fe3+与TA的配位过程受到反应环境的影响。一方面,MPN是由TA解离后产生的氧负离子与Fe3+发生配位反应而形成的,溶液pH值会影响TA的解离程度,不同的解离程度会生成不同含量的氧负离子,其与Fe3+的配比差异过大就会导致TA-Fe3+颗粒状聚集体的出现,适宜的酸碱环境可促进MPN网络的均匀形成;另一方面,若基材与TA和Fe3+的混合溶液共孵育,TA会瞬间聚集在Fe3+周围,生成的配合物沉积到基材上会呈现出明显的颗粒状凸起,而层层自组装的多步组装法可将基材表面未发生配位反应的TA和Fe3+洗脱,避免了TA-Fe3+聚集体的形成,使得配合物均匀地分布于基材表面[15],故据此推断,补片单丝表面的MPN涂层所具有的均匀形态主要归因于其分子级组装结构。
图2示出CBMA聚合反应产物的核磁共振氢谱图。可知,其化学位移(δ)在1.98处出现了CBMA聚合后产生的2H峰。PCBMA沉积固定后,补片单丝的表观形貌仍呈现出均匀的涂层状(见图1(c)),此时是聚合物将单丝包覆,PCBMA与MPN层通过非共价键力结合,具有一定黏度的聚合物均匀铺展在补片单丝表面,单丝交界处未显示出过度沉积。这种温和的二步沉积涂层方式可较为完整地保留PP补片的原始形貌。

图2 PCBMA的核磁共振氢谱图Fig.2 1H NMR spectra of PCBMA
2.2 表面理化性能分析
为进一步验证功能性涂层在PP表面的成功构建,对补片的元素组成进行表征,结果如图3所示。可以看出,在PCBMA-Fe/TA-PP的XPS图像中出现了LBL层的Fe2s峰以及PCBMA涂层的N1s峰,证明了金属酚醛/两性离子聚合物涂层疝修补片的成功制备。

图3 PCBMA-Fe/TA-PP的X射线光电子能谱图Fig.3 XPS spectra of PCBMA-Fe/TA-PP

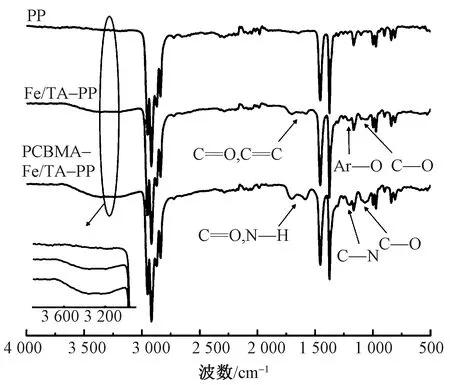
图4 PP、Fe/TA-PP和PCBMA-Fe/TA-PP的红外光谱图Fig.4 FT-IR spectra of PP,Fe/TA-PP and PCBMA-Fe/TA-PP
TA中的酚羟基一方面能通过氢键和静电力等多重作用与基材黏合;另一方面,也能够为基材带来更好的表面润湿性[17]。图5示出处理前后补片水接触角的变化。可知:MPN将疏水的PP表面改性为亲水表面;PCBMA作为ZPs,其聚合物链中的正负离子能够与水分子在静电作用力下结合,形成致密的水合层[18],进一步改善了补片的表面浸润性,使补片的水接触角降至37°。

图5 改性前后补片的水接触角变化Fig.5 Change in water contact angle of meshes before and after modification
图6示出处理前后补片的表面电位变化。原始PP补片表面呈电负性,Fe/TA-PP补片的表面电位由原始的-55.7 mV变为-47.9 mV,Fe/TA涂层提高了PP补片的表面电位,这归因于Fe3+的存在;最终,PCBMA-Fe/TA-PP补片的表面电位提高至-5.14 mV,这是因为PCBMA的电中性能够中和补片表面的一部分电荷。
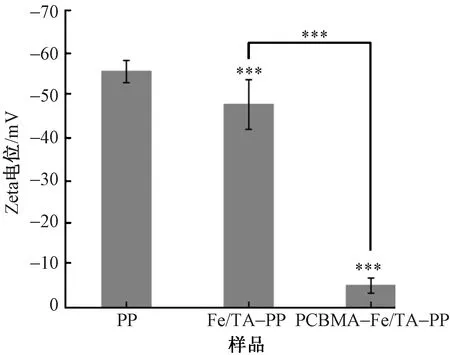
图6 改性前后补片的表面Zeta电位变化Fig.6 Change in surface Zeta potential of meshes before and after modification
2.3 力学性能分析
表1示出改性前后补片的力学性能指标。研究表明:人体腹壁可承受的最大张力为16 N/cm;临床上通常要求合成补片力学强度大于 32 N/cm[5]。涂层在PP单丝表面的附着可能会对补片的力学性能产生影响,如果涂层的加入会显著改变补片的力学强度,那么以牺牲补片力学性能换取补片抗蛋白吸附性能的方式是得不偿失的,因此,对改性前后补片的单向拉伸性能进行了分析。
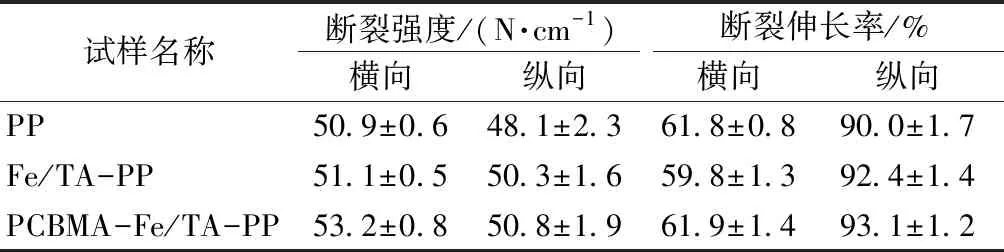
表1 改性前后补片的力学性能Tab.1 Mechanical properties of meshes before and after modification
对表1力学性能结果进行显著性分析可知,制备PCBMA-Fe/TA涂层的二步沉积法并没有使补片单向拉伸性能产生显著性变化;同时,PCBMA-Fe/TA-PP补片仍然满足疝修补片的临床力学需求,可为腹壁提供较好的力学支撑。利用这种二步沉积法制备PCBMA-Fe/TA涂层的方式是一种较为温和的改性方式。
2.4 抗蛋白吸附性能分析
据资料显示,白蛋白是血液中最丰富的血浆蛋白,在与补片表面的初始相互作用中起主导作用[19],因此,本文选用FITC标记的BSA对补片的蛋白吸附性能进行定性观察结果见图7。图中白色高亮处为吸附的BSA。由图可以看出:原始PP补片表面出现了大面积的荧光,吸附了较多蛋白质;而PCBMA-Fe/TA-PP补片表面几乎没有荧光标记。研究表明,亲/疏水表面都能发生蛋白质的非特异性吸附,但疏水表面与蛋白质的结合力更强、黏附牢度更大;通常认为亲水性表面可赋予材料更优异的抗生物污染性能[20]。补片改性后,Fe/TA基底赋予了补片一定的亲水性,加之ZPs超强的表面水合能力,PCBMA使得改性补片表面形成了致密水合层,增强了补片的防污性能,减少了补片表面吸附的BSA,因此改性后的补片呈现出几乎没有荧光标记的状态。

图7 BSA-FITC标记的补片荧光图像Fig.7 Fluorescence images labeled by BSA-FITC of meshes
2.5 细胞毒性分析
通过小鼠成纤维细胞(L929)与材料共培养 24 h 的状况可反映改性补片的细胞毒性。表2示出L929在与补片材料共培养24 h后使用CCK-8测试的吸光度。计算可得,PP和PCBMA-Fe/TA-PP补片的相对细胞活力分别约为96%和89%,结果表明,PCBMA-Fe/TA涂层补片不具有细胞毒性。

表2 小鼠成纤维细胞在24 h的CCK-8吸光度Tab.2 CCK-8 absorbance value of L929 at 24 h
3 结 论
1)通过Fe3+和单宁酸(TA)层层自组装,在聚丙烯(PP)补片表面构建了金属酚醛网络(MPN),利用分子间作用力在其上固载聚羧酸甜菜碱甲基丙烯酸酯(PCBMA),通过一种简便高效的方式制备了PCBMA-Fe/TA-PP补片。测试结果表明,二步沉积法可成功实现惰性PP与亲水性两性离子聚合物的有效结合。
2)PCBMA-Fe/TA涂层在保留了补片力学强度的基础上,将疏水PP表面的水接触角降低至37°,使补片呈现出优异的抗蛋白吸附效果。
3)细胞毒性测试结果表明,这种抗生物污染表面具有良好的生物相容性,有望被应用于医疗器械领域的抗污改性。
FZXB

