可光降解聚羟基丁酸酯/聚己内酯基抗菌纤维膜的制备及其性能
渠 赟,马 维,刘 颖,任学宏
(生态纺织教育部重点实验室(江南大学),江苏 无锡 214122)
人类每时每刻都在接触着无处不在的微生物,如细菌、霉菌、真菌,它们繁殖迅速,存活能力极强,可以通过空气流动、直接接触等方式传播。微生物腐蚀每年在工业生产、食品安全以及医疗卫生等多个领域造成巨大的损失。传统材料,如聚乙烯、聚丙烯和聚苯乙烯等,难以在自然条件下降解从而导致白色污染。而生物可降解材料在一定的环境条件下,能被自然界微生物如细菌、真菌等作用而发生降解[1],因此,开发一种环境友好的可降解抗菌材料进而应用于包装或生物材料领域是十分必要的[2]。
聚羟基丁酸酯(PHB)是聚羟基脂肪酸酯(PHA)中的一种典型代表[3],其分子结构规整,较高的结晶度(5%~80%)导致其硬而脆。PHB熔点(180 ℃)接近分解温度(190~200 ℃),导致其加工温度范围较窄,限制了应用范围[4]。聚己内酯(PCL)结晶度约为45%,具有优异的链柔性[5]。将PHB与PCL共混,可得到一种力学性能优异的复合材料[7-8]。同时,PHB与PCL都拥有优异的生物相容性及生物降解性,常应用于组织工程及敷料,可有效促进与生物组织细胞的增殖与分化。
无机抗菌剂有较高的耐热能力,释放作用时间长,具有广谱抗菌性。ZnO是一种半导体材料,在抗菌、催化、食品包装等方面有广泛应用[9],但较低浓度的ZnO往往不具备高效的抗菌能力,可通过金属/非金属掺杂、半导体耦合以及负载有机抗菌剂等方法对ZnO进行改性[10-11]。银(Ag)作为一种被广泛使用的贵金属,可负载于不溶性硅酸盐、钙盐、金属氧化物以及石墨烯等材料上以改善材料的抗菌性或光催化效果[12]。Ag与ZnO界面建立的肖特基势垒可使电子转移的效率加快,进而促进抗菌及光降解性能[13]。Vaiano等[14]通过光沉积法制备了银质量分数为0.88%的Ag-ZnO掺杂材料,具有高效光催化性能,可在紫外光下降解苯酚。Panchal等[15]通过生物介导法合成Ag-ZnO复合材料,具有良好的抗菌性及优异的染料光降解能力。因此,本文拟通过用Ag与ZnO掺杂制备复合颗粒,提高杀灭细菌与光催化降解的效率。同时,在成本低廉的ZnO颗粒中掺杂少量Ag,可减少二者用量而不降低使用效果,克服ZnO和Ag这2种材料的局限性而制备出具有高效光催化及抗菌效率的复合材料,具有一定的现实意义[16]。
目前,将银掺杂ZnO颗粒应用于抗菌高分子膜材料的研究相对较少。将纳米颗粒混入静电纺丝液是制备复合纤维膜材料的良好手段,因此为拓宽其应用范围,本文将制备的Ag-ZnO抗菌剂添加入PHB/PCL纺丝液中,采用静电纺丝技术制备出具有高效抗菌和光降解性能的可生物降解抗菌聚酯膜,并进行一系列表征测试,探究其性能及应用前景。
1 实验部分
1.1 实验材料
乙醇(分析纯),国药集团化学试剂有限公司;聚羟基丁酸酯(PHB,相对分子质量为3万),天津国韵生物材料有限公司;聚己内酯(PCL,相对分子质量为8万),SIGMA-ALDRICH有限公司;三氯甲烷(化学纯)、硝酸银(分析纯)、抗坏血酸(分析纯)、氢氧化钠(分析纯)、亚甲基蓝、磷酸盐缓冲溶液(PBS)速溶颗粒,国药集团化学试剂有限公司;二水合乙酸锌(纯度为99.99%),阿拉丁试剂有限公司。
1.2 实验仪器
UV-2450型紫外分光光度仪,岛津(上海)实验器材有限公司;VGT-2013QTD型超声波清洗器,GT SONIC有限公司;TM3030型扫描电子显微镜,日本株式会社日立高新技术公司;NICOLET NEXUS IS5型傅里叶红外变换光谱仪,Thermo电子仪器公司;D8 Advance X型射线衍射仪,德国布鲁克AXS公司;CEL-500/350 汞灯光源,北京中教金源科技有限公司;JZB-1800D型双道注射泵,费森尤斯卡比健源医疗科技有限公司;Zetasizer Nano-ZS型激光纳米粒度Zeta电位仪,英国马尔文仪器有限公司;HAAKE MARS型旋转流变仪,赛默飞世尔科技有限公司;3385H-电子万能材料试验机,美国Instron Inc公司;FC型酶标仪,赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 Ag-ZnO颗粒的制备
称取0.1 g硝酸银溶解在100 mL无水乙醇中,充分搅拌使其溶解,加入0.1 g抗坏血酸,充分搅拌。称取1.9 g二水合乙酸锌,加入硝酸银溶液中,在电磁搅拌器上室温搅拌30 min,将反应液全部转移至高压釜中,100 ℃反应24 h后取出,离心后用无水乙醇清洗2~3次,再用去离子水清洗1~2次。取出产物,于80 ℃烘箱中干燥12 h,研磨成粉末备用。氧化锌颗粒的制备方法同上。
1.3.2 Ag-ZnO-PHB/PCL纤维膜的制备
分别称取PHB和PCL(质量比为40∶60)于具塞锥形瓶中,加入三氯甲烷,PHB/PCL的总质量分数为10%,混合均匀后放入超声波振荡机中,于 35 ℃ 超声波处理2 h,充分溶解后,放在电磁搅拌器室温搅拌24 h。用注射器吸取纺丝液,安装在注射泵上,用铝箔纸作为承接表面。电压设置为20 kV,针头到滚筒的距离为20 cm,注射速度为1.0 mL/h,滚筒转速为500 r/min,收集20 h。按照Ag-ZnO 颗粒质量分数为1%、2%、3%、4%的梯度配制纺丝液。称取相应质量的Ag-ZnO颗粒,超声波分散于三氯甲烷之中,再加入PHB/PCL继续超声波分散 2 h,充分溶解后,放在电磁搅拌器室温搅拌 24 h。ZnO-PHB/PCL膜制备同上。
1.4 测试与表征
1.4.1 样品表征
使用傅里叶红外变换光谱仪测试颗粒及纤维膜样品半反射红外光谱,扫描范围为4 000~400 cm-1。
样品喷金后,使用扫描电子显微镜在15 kV的电压下观察Ag-ZnO及Ag-ZnO-PHB/PCL纤维膜形貌。
使用X射线衍射仪表征样品结晶状态,设置步长为0.05°,角度范围为10°~80°。
使用热重分析仪测试样品的热质量损失,升温速率20 ℃/min,温度设定范围为50~800 ℃。
使用激光纳米粒度Zeta电位仪表征样品粒径分布。将样品分散在无水乙醇中,超声10 min使其形成均匀的悬浮液用于测定样品粒径。
使用旋转流变仪测试纺丝液的黏度。设置温度为25 ℃,圆盘间隙为0.050 mm,取少量纺丝液均匀涂抹在圆盘之间,待其旋转稳定后读取黏度数值。
1.4.2 强力测试
将含有不同质量分数Ag-ZnO颗粒的Ag-ZnO-PHB/PCL和纯PHB/PCL纤维膜,分别剪取100 mm × 20 mm 大小的待测样5份,于45 ℃干燥24 h,在恒温(20 ℃)、恒湿(65%)的条件下,使用电子万能材料试验机测试样品拉伸性能,夹持距离为5 mm,拉伸速度为50 mm/min。每个样品测5次,取平均值。
1.4.3 抗菌测试及生物被膜测试
根据AATCC 100—2004《纺织品材料上耐细菌整理:评定》中改良实验方法来检测样品的抗菌性能。选用革兰氏阴性大肠杆菌O157:H7(ATCC 43895)和革兰氏阳性金黄色葡萄球菌(ATCC 6538)作为测试菌种,对空白对照样品纯PHB/PCL膜,ZnO-PHB/PCL 膜和Ag-ZnO-PHB/PCL膜进行抗菌测试,每个试样大小为2.54 cm × 2.54 cm。首先将2种细菌悬浮在磷酸盐缓冲溶液中,配制出测试所需浓度的菌液。取一片纤维膜在中心滴加25 μL菌液,再取另一片纤维膜覆盖在上面,将无菌砝码置于上方,确保2个试样与菌液的充分接触。接触时间设置为10、30、60 min,达到接触时间后,用磷酸盐缓冲溶液将所得上清液进行一系列浓度梯度的稀释,并接种在培养基中。于37 ℃恒温培养24 h后,记录细菌菌落数,评价其抗菌效果。抑菌率计算方法如下:
式中:R为抑菌率,%;A为实验组菌落数量,CFU;B为对照组菌落数量,CFU。
选取同上大肠杆菌菌种,配制107~108CFU/mL的细菌悬浮液备用,分别准备1 cm2的纯PHB/PCL膜和Ag-ZnO-PHB/PCL膜样品,投入装有10 mL菌液的离心管中。到达设置的黏附时间(30、120 min) 后取出样品,用PBS冲洗3次,放入装有 5 mL 营养肉汤的摇菌管中,在空气摇床(37 ℃,12 h) 中振荡培养。取出样品,用PBS充分清洗后,将其剪半,一半放入盛有10 mL PBS的离心管中,超声波振荡10 min,再涡旋2 min,对其进行一系列梯度稀释后点板。另一半样品在3%戊二醛溶液中固定(-4 ℃,24 h)。采用体积分数分别为30%、50%、70%、90%的乙醇水溶液对样品上附着的大肠杆菌进行梯度脱水处理,干燥后使用扫描电镜观察样品上生物被膜的生长情况。
1.4.4 光降解测试
采用亚甲基蓝(MB)变色评估方法。将待测样品纯PHB/PCL膜和Ag-ZnO-PHB/PCL纤维膜分别剪成2 cm × 2 cm的方块在45 ℃条件下干燥24 h备用。配制质量分数为0.01%的亚甲基蓝水溶液,将膜样品置于平坦表面,固定滴定管到试样表面的距离高度为1 cm,滴下1滴(约为50 μL)MB 溶液,静置吸收3 min。在CEL-M500汞灯光源下照射,功率为500 W,距离为18 cm。分别在0、5、12 min时拍下试样上亚甲基蓝颜色变化情况[17]。
1.4.5 体外细胞毒性测试
基于ISO 10993-5《医疗器械生物学评价 第5部分:体外细胞毒性试验》实验方法,即3,3′-(1-(苯氨酰基)-3,4-四氮唑)-二(4-甲氧基-6-硝基)苯磺酸钠(XTT)细胞毒性测试方法,通过L-929(ATCC CCL-1) 小鼠成纤维细胞在样品提取液的存活率来评价样品的体外细胞毒性。将小鼠细胞传代培养3~5次,稀释液接种于96孔板,添加杜氏改良Eagle培养基(DMEM)后将培养基转移至5% CO2细胞培养箱(37 ℃,24 h)。分别取用空白培养基、100 μL样品浸取液代替上述培养基。孵育8 h后,向孔中分别添加50 μL XTT/吩嗪硫酸甲酯(PMS)溶液,在37 ℃下避光保存4 h,用酶标仪测定 490 mn 下的光密度(OD值)来评价细胞增殖情况。
2 结果与讨论
2.1 Ag-ZnO-PHB/PCL的形貌结构
图1示出Ag-ZnO的电镜照片和粒径分布曲线。可以看出,Ag-ZnO呈现颗粒状。经测试,Ag-ZnO的平均粒径约为785 nm(粒径的多分散指数PDI为0.237)。

图1 Ag-ZnO的电镜照片及粒径分布Fig.1 SEM image(a) and size distribution(b) of Ag-ZnO
图2为Ag-ZnO表面Zn和Ag的能谱分析图。可以看出,Zn与Ag元素均有高密度分布。

图2 Ag-ZnO表面的能谱分析图Fig.2 EDS mapping images of different elements in Ag-ZnO
图3示出Ag-ZnO颗粒质量分数为0%~4%时Ag-ZnO-PHB/PCL 纤维膜的电镜照片,可以清晰地看到Ag-ZnO颗粒存在。添加有颗粒的纤维与纯 PHB/PCL 纤维相比形态发生一定变化。由于粒子的尺寸小,较高的表面活性易导致其吸附团聚,随着Ag-ZnO颗粒质量分数的增加,发生团聚现象。实验测得颗粒质量分数为0%~4%纺丝液的黏度分别为724.2、785.4、801.3、818.6、881.7 mPa·s。纺丝液的黏度随着Ag-ZnO颗粒质量分数的增加而增大。在1%~2%范围内,当电压不变时,黏度越高,则射流在电场中被拉伸受到的阻力越大,因而直径较大。另外,推测由于Ag是导体,ZnO为半导体,当Ag-ZnO颗粒质量分数增大到一定量时,纺丝液的介电常数会大大提高,注射器针头处液滴将产生更多感应电荷,进而在静电场中更加充分地拉伸[18];当质量分数为3%时,纤维直径减小;当含量继续增加至4%,纺丝液黏度过高,纤维变粗,并且直径分布变得不均,出现大量细丝。

图3 不同质量分数Ag-Zn颗粒Ag-ZnO-PHB/PCL纤维膜电镜照片Fig.3 SEM images of Ag-ZnO-PHB/PCL membranes with different content of Ag-ZnO particle
2.2 Ag-ZnO-PHB/PCL的力学性能
图4示出纯PHB/PCL膜(Ag-ZnO质量分数为0%)和Ag-ZnO质量分数为1%、2%、3%、4%的纤维膜的断裂强力和断裂伸长率。纯PHB/PCL纤维膜强力较差,断裂伸长率较低,在添加Ag-ZnO颗粒之后,纤维强力与断裂伸长率整体均有所提高。Ag-ZnO-PHB/PCL 纤维膜的强力呈现先上升后下降的趋势,添加质量分数为3%时,纤维的强力有较大的改善。原因可能是加入的Ag-ZnO提高了纤维膜的刚性,使得纤维膜经受外力拉伸时承受更大的作用力而不致断裂。

图4 PHB/PCL与Ag-ZnO-PHB/PCL的断裂强力与断裂伸长率Fig.4 Breaking strength and elongation at break of PHB/PCL and Ag-ZnO-PHB/PCL membranes
Ag-ZnO-PHB/PCL纤维膜的断裂伸长率有大幅度提升,呈现先上升后下降的趋势,添加质量分数为2%时达到最大值183%。当颗粒的添加量增加到一定程度,由于微粒的团聚效应导致颗粒尺寸增大,进而影响纤维结晶,受外力作用时,纤维膜中分子链的活动受到了限制,导致断裂伸长率下降。综合断裂强力与断裂伸长率,选择颗粒质量分数为3%为最优值。
2.3 Ag-ZnO-PHB/PCL的结构组成
图5示出ZnO和Ag-ZnO、PHB/PCL和Ag-ZnO-PHB/PCL纤维膜的红外光谱。ZnO的红外光谱中,490 cm-1处的吸收带归因于Zn—O的作用。在890 cm-1处观察到的低峰可归因于烯烃组的C—H平面外弯曲作用。1 380 cm-1处的峰归因于产物表面氢氧化锌的羟基发生桥联[19]。Ag-ZnO光谱中出现的2 915 cm-1处的吸收峰,则是来源于NO3-中的N—O键振动。3 520 cm-1处为O—H键的伸缩振动峰。因为常温大气条件下,ZnO纳米粒子表面易吸收水分子,生成结合水,难以完全干燥,这些水分子最终往往发生解离,生成吸附的羟基。相较于ZnO,Ag-ZnO颗粒有较强的O—H的振动峰,表面增加的大量羟基可能在Ag协同ZnO的过程中起到关键作用[20]。纯PHB/PCL和Ag-ZnO-PHB/PCL纤维膜的图谱表明,在2 920、2 860、1 720、1 170、1 041 cm-1处都有较为明显的吸收峰,1 170~1 041 cm-1范围内的特征峰由C—O—C键引起,1 720 cm-1处的峰为酯键中的羰基的伸缩振动引起,2 860 cm-1处由PHB中的甲基—CH3的伸缩振动引起,2 920 cm-1处的特征峰对应着饱和亚甲基—CH2—[21]。添加了Ag-ZnO颗粒之后各个基团的位置并未发生较大变化。
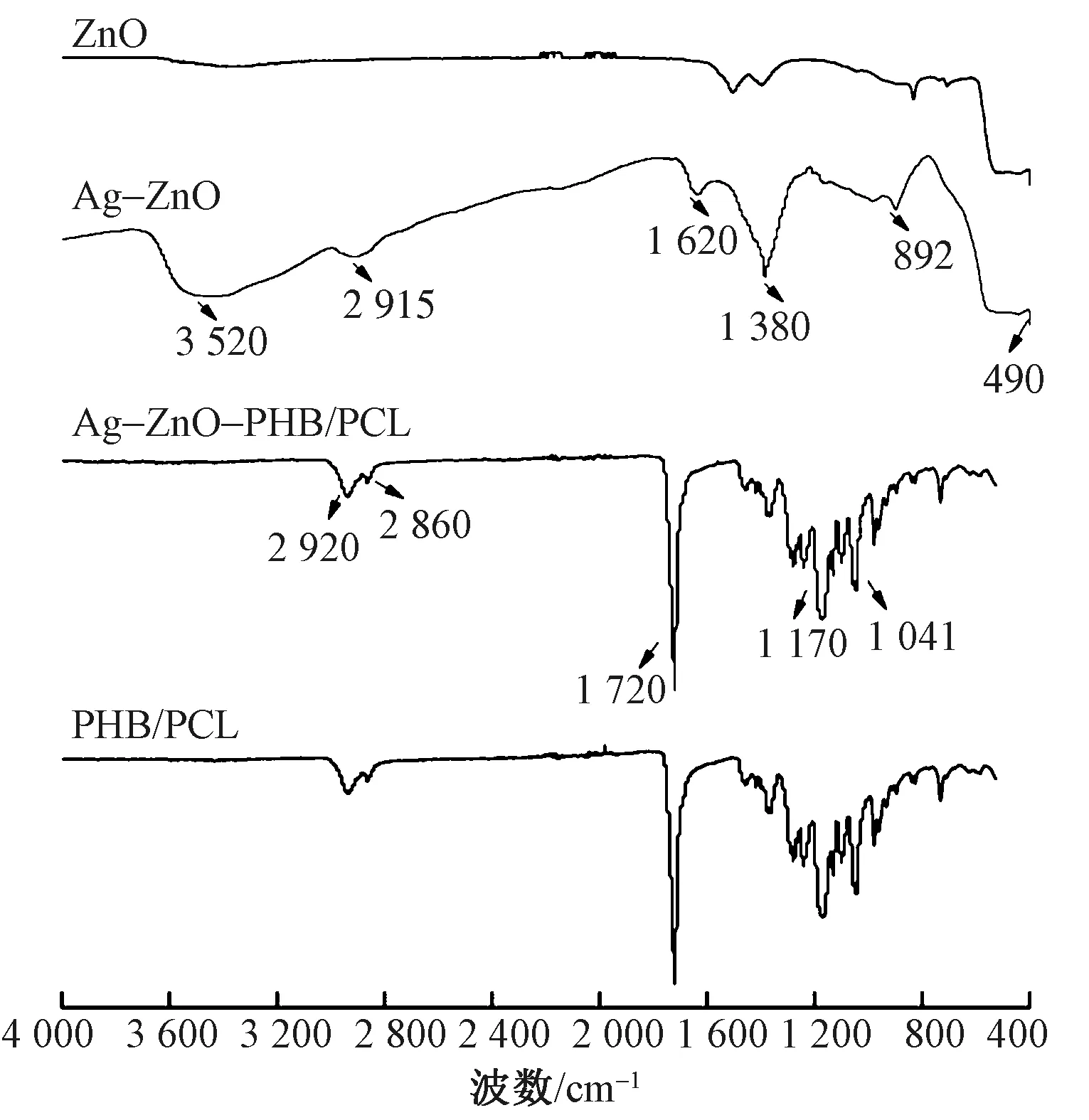
图5 ZnO,Ag-ZnO,PHB/PCL和Ag-ZnO-PHB/PCL的红外光谱图Fig.5 FT-IR spectra of ZnO,Ag-ZnO,PHB/PCL and Ag-ZnO-PHB/PCL membranes
为进一步描述Ag-ZnO、Ag-ZnO-PHB/PCL等的晶型结构,对样品进行XRD分析,结果如图6所示。可知纳米ZnO在31.60° 、34.49°、36.0°、47.28°、56.89°、67.81°等位置出现了尖锐的衍射峰,并各自对应(100)(002)(101)(102)(110)(103)(112)晶面,说明样品是纤锌矿型的ZnO,而且谱图中未出现其他物质的衍射峰,证明制备的ZnO纯度较高。Ag-ZnO衍射谱图发生明显变化,在38.02°,44.18°,64.35°位置出现了3处新的衍射峰,分别对应Ag的(111)(200)(311)晶面,未出现其他物质的衍射峰,说明Ag-ZnO纯度较高[22]。而ZnO对应的衍射峰位置并没有发生偏移,说明Ag的引入并未明显影响ZnO晶体原有晶型,但是可明显观测到ZnO的衍射峰强度较原来减弱,表明Ag会影响ZnO晶体结构的生长。Ag-ZnO-PHB/PCL的图谱中可观察到较微弱的Ag-ZnO颗粒的峰,分别在31.5°,34.4°和36.0°的位置上,说明颗粒混入PHB/PCL且未改变PHB/PCL晶型。

图6 ZnO,Ag-ZnO,PHB/PCL和Ag-ZnO-PHB/PCL的X射线衍射谱图Fig.6 XRD spectra of ZnO,Ag-ZnO,PHB/PCL and Ag-ZnO-PHB/PCL membranes
2.4 Ag-ZnO-PHB/PCL的热学性能
图7(a)示出PHB/PCL和Ag-ZnO-PHB/PCL纤维膜的TG曲线。PHB/PCL纤维膜曲线中间出现1个热降解台阶,Ag-ZnO-PHB/PCL纤维膜降解曲线光滑,无明显阶梯出现。第1阶段为PHB的降解,其质量损失发生在220~280 ℃之间;第2阶段为PCL的降解,其质量损失温度范围为280~420 ℃,纤维膜中的PHB和PCL均达到最大分解温度[23]。PHB/PCL、Ag-ZnO-PHB/PCL纤维膜的质量保留率分别为1.142%、5.284%;Ag-ZnO-PHB/PCL纤维膜的最终残留质量为碳和Ag-ZnO颗粒。
图7(b)示出PHB/PCL和Ag-ZnO-PHB/PCL的DTG曲线。可看出,PHB/PCL在温度为257.7、419.2 ℃时出现最大热分解速率,Ag-ZnO-PHB/PCL的最大热分解速率出现在283.6、318.1 ℃温度处。Ag-ZnO颗粒的加入使材料的初始热降解温度从209.9 ℃提高到了239.1 ℃,整体热降解结束对应的温度从431.0 ℃降低到了351.6 ℃。加入颗粒后,纤维中大分子链的排列受到影响。受热后纤维大分子链发生运动,由于颗粒的限制,分子链需要吸收更多的热量才能克服束缚发生移动进而降解,从而提高了热稳定性。
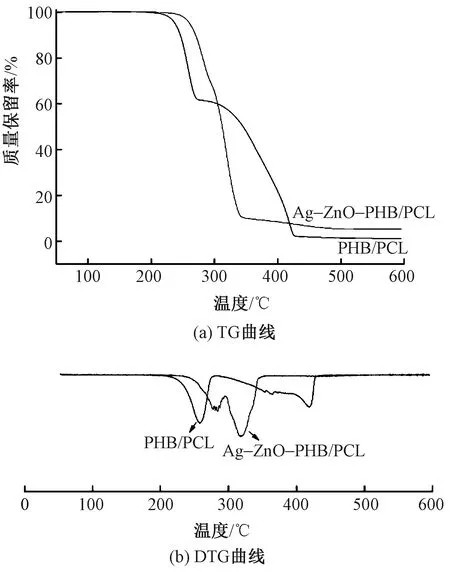
图7 PHB/PCL和Ag-ZnO-PHB/PCL的TG和DTG曲线Fig.7 TG(a) and DTG(b) curves of PHB/PCL and Ag-ZnO-PHB/PCL membranes
2.5 Ag-ZnO-PHB/PCL的抗菌性能
表1示出PHB/PCL,ZnO-PHB/PCL和Ag-ZnO-PHB/PCL的抗菌性能。PHB/PCL本身没有抗菌能力,对大肠杆菌和金黄色葡萄球菌接触 60 min 后的抑菌率却达到了75.66%和45.44%。由于PHB/PCL纤维膜孔隙率较高,有一定的亲水性能,会吸附一定量的菌液,平板计数法点板时采用的是被测样品的涡旋溶液,导致对照样在数值上表现出一定的抑菌率[24-25]。由表1可得,Ag-ZnO-PHB/PCL对大肠杆菌和金黄色葡萄球菌的抑菌率在60 min 时分别达到84.12%和97.99%。而ZnO-PHB/PCL对大肠杆菌、金黄色葡萄球菌接触60 min时的抑菌率为78.12%和71.67%,明显低于Ag-ZnO-PHB/PCL的抗菌效果,可推测Ag的引入增强了抗菌效果。该材料对金黄色葡萄球菌的抑菌率优于大肠杆菌,可能原因为大肠杆菌为杆状结构,而金黄色葡萄球菌为球形结构,更加有利于吸附于纤维膜上并增大与其的接触面积,从而提高抑菌效率[26]。Ag+、Zn2+的溶出是Ag-ZnO颗粒能够发挥抗菌效果的重要机制之一,一般细菌在溶液中细胞壁表面带有负电荷,而颗粒释放出的金属离子带正电,易加快吸附细菌从而与其接触;金属离子可抑制细胞壁上肽聚糖的合成,细胞膜形态发生变化,内容物流出进而死亡;金属离子也可与细菌细胞膜上的磷脂分子层上带负电的磷酸根及一些膜蛋白相结合,破坏细胞膜的选择通过性使其无法发挥正常功能;Ag和ZnO可诱导细菌体内产生过量活性氧,如过氧化氢和羟基自由基等,会造成细菌的新陈代谢紊乱,使其DNA损伤并随之凋亡[27-28]。大肠杆菌(ATCC 43895)为革兰氏阴性菌,金黄色葡萄球菌(ATCC 6538)为革兰氏阳性菌,研究表明,革兰氏阳性菌对氧化锌更加敏感[29],原因为2类细菌的结构不同,革兰氏阳性菌细胞壁为肽聚糖、磷壁酸与脂磷壁酸,而革兰氏阴性菌的细胞壁的组成更加复杂,肽聚糖较少,但具有脂多糖且表面覆有一层膜,可有效阻止活性氧的渗透,所以对金黄色葡萄球菌的杀灭更高效快速。
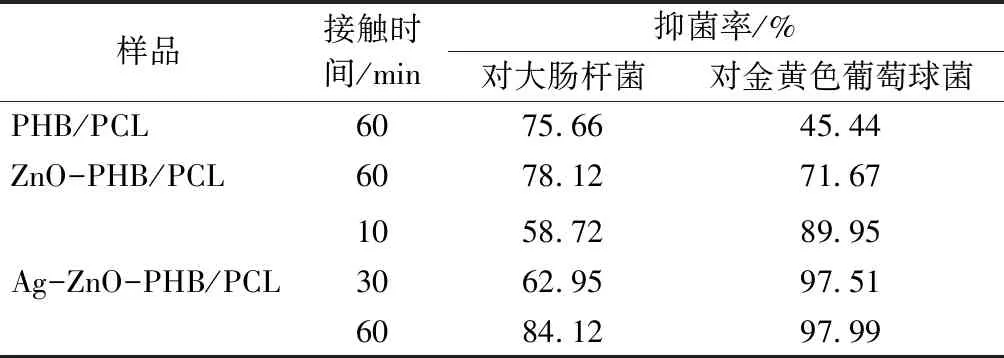
表1 PHB/PCL,ZnO-PHB/PCL和Ag-ZnO-PHB/PCL的抗菌性能Tab.1 Antibacterial property of PHB/PCL,ZnO-PHB/PCL and Ag-ZnO-PHB/PCL
以大肠杆菌为例,探究Ag-ZnO-PHB/PCL膜对细菌生物被膜的抑制作用,结果如表2所示。经30 min初始黏附、24 h培养后,PHB/PCL纤维膜表面的大肠杆菌菌落数量为3.88×106CFU/cm2,而Ag-ZnO-PHB/PCL膜表面的大肠杆菌菌落数量为5.60×105CFU/cm2;当接触时间为120 min时,Ag-ZnO-PHB/PCL 膜表面的菌落数量下降至4.01×104CFU/cm2,表明其对细菌生物被膜的形成有一定的抑制作用。

表2 大肠杆菌生物被膜作用测试Tab.2 Biofilm test for E. coli bacterial
图8示出30和120 min时PHB/PCL和Ag-ZnO-PHB/PCL表面细菌的附着状态。可以看出,纯PHB/PCL纤维膜表面有大量大肠杆菌菌体聚集并覆盖,而Ag-ZnO-PHB/PCL膜表面虽仍有少量细菌黏附,但较为干净,无明显的膜状聚集体。且随着初始黏附时间的增长,对照样表面细菌数量有明显增加,而Ag-ZnO-PHB/PCL膜仍无明显聚集。

图8 大肠杆菌生物被膜作用的电镜照片Fig.8 SEM images of bacterial biofilm (E. coli)
2.6 Ag-ZnO-PHB/PCL的光降解性能
采用亚甲基蓝溶液在紫外光下的降解实验评价该材料的光降解性能,结果如图9所示。可以看出,自然光下的对照样颜色几乎无变化,紫外光照射下的空白膜其褪色程度较小。根据结果,Ag-ZnO-PHB/PCL在紫外光下照射8 min后可使亚甲基蓝溶液大部分颜色褪去,12 min时接近完全降解试样上的亚甲基蓝污渍。可见,Ag-ZnO颗粒可在紫外光条件下将大分子有机物降解成无色的小分子产物,表明制备的Ag-ZnO-PHB/PCL具有一定的光降解有机物大分子的效果。

图9 亚甲基蓝溶液光降解测试照片Fig.9 Photos of Methylene Blue solution degradation test
2.7 Ag-ZnO-PHB/PCL的体外细胞毒性
通过L-929小鼠成纤维细胞在样品浸出液的存活率来评价样品的体外细胞毒性。经PHB/PCL纤维膜样品浸出液处理后,细胞存活率为(92±5)%;而经Ag-ZnO-PHB/PCL样品浸出液处理后,细胞存活率为(76±4)%。根据ISO/EN 10993-5∶2009《医疗器械生物学评价 第5部分:体外细胞毒性试验》标准显示,当细胞存活率≥70%时可判定样品安全无毒,因此,Ag-ZnO-PHB/PCL抗菌膜具有作为生物相容性抗菌材料使用的潜力。
3 结 论
本文通过静电纺丝工艺将Ag-ZnO引入聚羟基丁酸酯/聚己内酯(PHB/PCL)纤维膜中,成功地制备了Ag-ZnO-PHB/PCL纤维膜,主要得出如下结论。
1)Ag-ZnO的添加提高了PHB/PCL纤维膜的热稳定性;当质量分数为3%时,对纤维膜的力学性能有较佳的改善效果。
2)Ag-ZnO-PHB/PCL在60 min内对金黄色葡萄球菌的抑菌率达到97.99%,并且在针对大肠杆菌的生物膜作用测试中,对细菌生物膜形成有明显的抑制作用。
3)Ag-ZnO-PHB/PCL对有机物大分子具有一定的降解作用,可在短时间内将亚甲基蓝溶液降解至无色。体外细胞毒性实验结果表明其具有较好的生物相容性。
4)制备的Ag-ZnO-PHB/PCL具有良好的抗菌及抑制细菌生物膜的效果、较好的力学性能、光降解性能以及生物相容性,在包装和生物医用材料等领域有一定的应用潜力。
FZXB

