原发性不孕合并原发性色素结节性肾上腺皮质病的遗传生殖探讨
赵鑫,邓姗
(1.秦皇岛市妇幼保健院妇科,秦皇岛 066000;2.中国医学科学院 北京协和医学院 北京协和医院妇科内分泌与生殖中心,国家妇产疾病临床医学研究中心,北京 100730)
病例资料
患者郭女士,39岁,G0,以“未避孕未孕3年”为主诉就诊于北京协和医院妇科内分泌与生殖中心。
患者15岁初潮,平素月经规律,4~5 d/28~30 d,量中,痛经(-)。3年前结婚,未避孕未孕至今,性生活无异常。男方精液检查:精子浓度80.6×106/ml,a级29.2%、b级23.3%。2021年4月女方激素水平(月经第2天):卵泡刺激素(FSH)7.5 U/L、黄体生成素(LH)9.4 U/L、雌二醇(E2)131 pmol/L、孕酮(P)0.93 nmol/L、泌乳素(PRL)0.88 nmol/L、睾酮(T)0.69 nmol/L,抗苗勒管激素(AMH)3.77 ng/ml;经前9天性激素水平:FSH 4.0 U/L、LH 2.57 U/L、E2893 pmol/L、P 37.4 nmol/L、PRL 0.88 nmol/L、T 0.3 nmol/L;基础体温(BBT)双相。超声造影提示右侧输卵管通而不畅,左侧输卵管积液。2021年11月盆腔超声提示子宫左后壁低回声,直径约1.0 cm,左附件区管状无回声,范围约5.0 cm×3.4 cm×1.8 cm,走行迂曲。
既往史:25岁时因脸圆、痤疮、体重增加、高血压、骨质疏松等症状就诊我院内分泌科,诊断为库欣综合征。双侧肾上腺大结节性增生,行左侧肾上腺部分切除术,术中见肾上腺黄褐色结节直径约5~30 mm。术后上述症状有缓解,病理为肾上腺皮质结节性增生。5年前再次出现高血压、库欣综合征等相关表现,结合血皮质醇节律紊乱、大/小剂量地塞米松抑制试验(-)及肾上腺CT示右肾上腺多发结节,考虑复发,行右侧肾上腺全部切除,术中见肿瘤剖面大量色素沉着,术后病理示肾上腺皮质结节性增生(图1)。回顾患者临床表现,患者起病年龄早,起病时24岁,大剂量地塞米松抑制试验呈反常性升高(24 h 尿游离皮质醇:对照326.4 μg/24 h;大剂量抑制后461.3 μg/24 h),符合原发性色素结节性肾上腺皮质病表现。修订诊断:原发性色素结节性肾上腺皮质病。此次术后上述症状再次缓解,长期口服氢化可的松5 mg bid至今。否认其他特殊病史,否认药敏史。
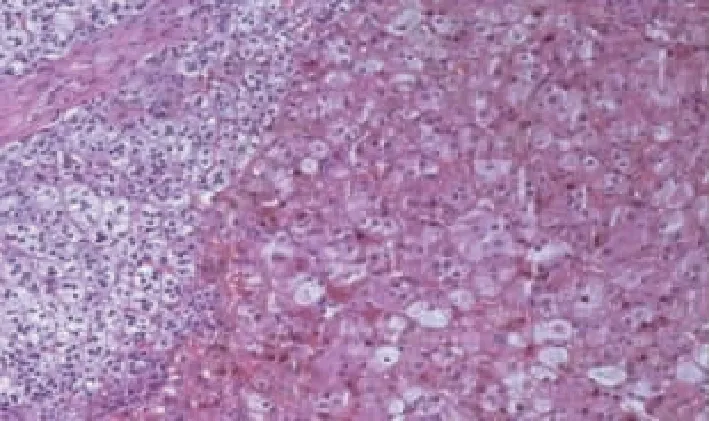
肾上腺皮质小结节样增生,结节内含有嗜酸性细胞质和脂褐素,结节间皮质萎缩。图1 右侧肾上腺病理图(HE ×100)
家族史:父母体健,有一哥哥及一双胞胎姐姐,均体健,生子。
查体:一般情况可,身高156 cm,体重47 kg,体质量指数(BMI)19.3 kg/m2,面部及口唇可见多发色素沉着样雀斑,无痤疮,乳周无长毛,无泌乳,脐下无长毛。
妇科查体:宫颈光滑,子宫、双附件未及异常。
入院诊断:(1)原发性不孕;(2)左侧输卵管积水?(3)子宫肌瘤;(4)原发性色素结节性肾上腺皮质病;(5)双侧肾上腺手术史。
诊疗经过:入院后择期行不孕宫腹腔镜探查。术中见:子宫常大,表面光滑,未见明显外凸瘤结节;双卵巢未见异常;左侧输卵管全程走行迂曲伴增粗,最宽处直径约2.5 cm,末端系膜可见少许伞样结构,与输卵管不相连,通液远端梗阻(图2A);右侧输卵管略迂曲,通液虽有不畅,但可见美兰溢出(图2B);左侧骶韧带可见紫蓝色结节,直径约0.5 cm(图2C)。行左侧输卵管切除术+盆腔子宫内膜异位灶电灼术。宫腔镜未见特殊(图2D)。术后病理:(左侧输卵管)输卵管组织,部分管腔扩张;(宫腔刮出物)增殖期子宫内膜。患者术后恢复平顺,建议辅助生殖助孕并考虑移植前诊断,但患者希望自己试孕。
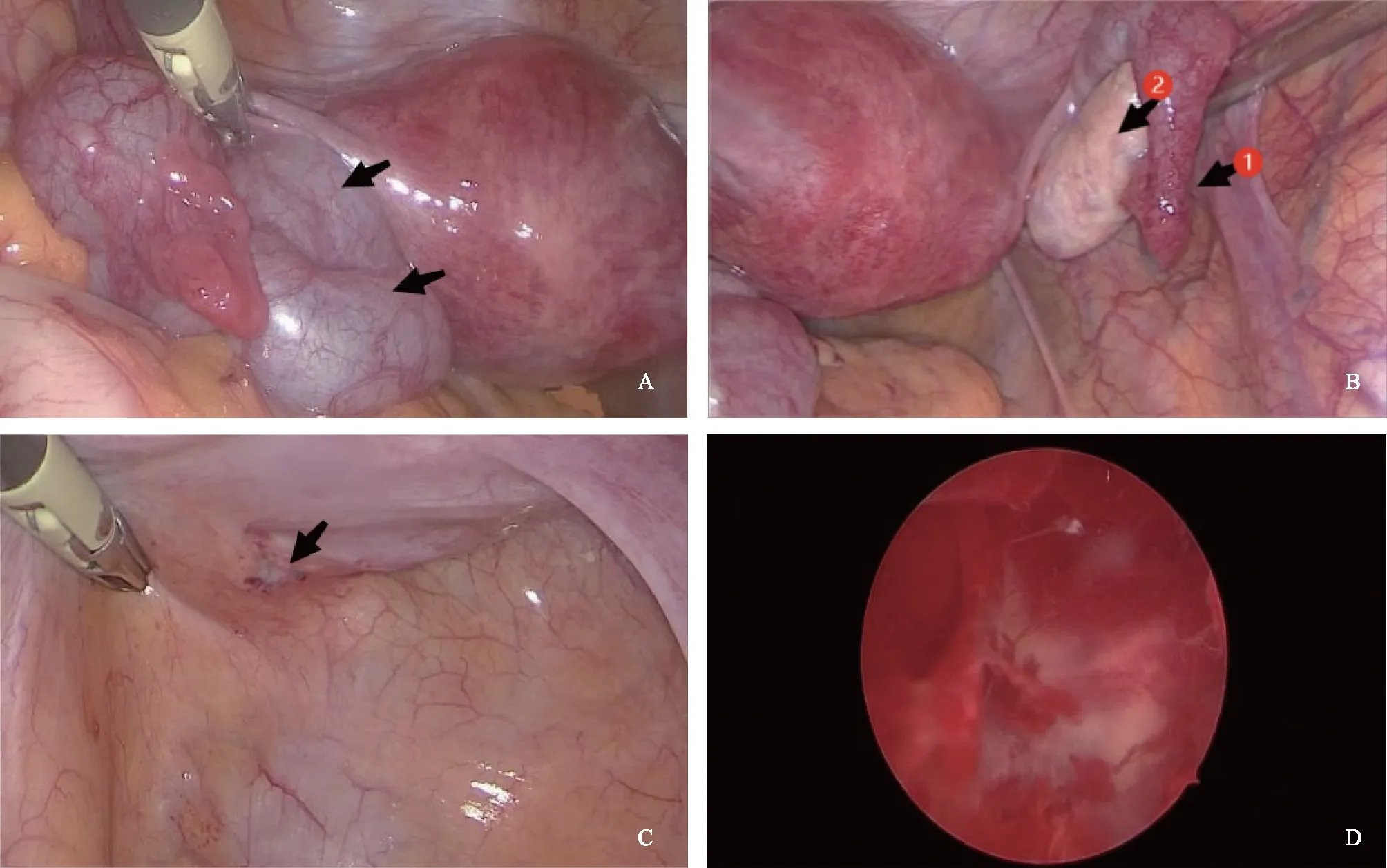
A:左侧输卵管积水:全程走行迂曲伴增粗,最宽处直径约2.5 cm,末端系膜可见少许伞样结构,通液时未见美兰液流出(箭头示);B:右输卵管走行略迂曲,伞端可见美兰液流出(箭头1示),右卵巢外观未见异常(箭头2示);C:左侧骶韧带紫蓝色结节样内膜异位灶(箭头示);D:宫腔未见明显异常。图2 宫腹腔镜联合检查图像
临床讨论
一、关于原发性色素结节性肾上腺皮质病
原发性色素结节性肾上腺皮质病(Primary pigmented nodular adrenocortical disease,PPNAD)是一种罕见的非促肾上腺皮质激素依赖性库欣综合征的病因,所占比例不足库欣综合征病因的1%[1]。该病具有遗传异质性,属于常染色体显性遗传,大约50%的患者有明显的家族史[2],但也存在散发性病例,发病的高峰年龄为20~30岁,以女性多见[3]。其临床表现主要为满月脸、水牛背、痤疮、多毛、多血质、紫纹、皮肤菲薄等典型的库欣综合征表现,也可表现为继发性闭经、高血压、骨质疏松等内分泌代谢症状。实验室检查多表现为:高皮质醇血症,皮质醇昼夜节律消失;促肾上腺皮质激素(ACTH)下降,24 h尿游离皮质醇升高;大/小剂量地塞米松抑制试验不能被抑制,或大剂量地塞米松抑制试验后尿皮质醇反常升高[4]。CT或MRI多可见肾上腺增粗或小结节影,部分病例也可能无明显特异性表现[5]。术后病理及免疫组化是该病的诊断金标准,大体标本肾上腺大多大小正常或轻度增大,皮质可见多发黑褐色结节,结节多在4 mm以下,较大者可达30~50 mm,结节周围肾上腺皮质萎缩[6]。
PPNAD的标准治疗方案是双侧肾上腺切除以及术后长期激素替代治疗。对于部分症状较轻患者,可行单侧肾上腺切除+对侧肾上腺次全切除,症状也可得到长期缓解,并且可以预防肾上腺危象的发生[7]。术后高皮质醇血症缓解,库欣综合征临床表现逐渐消失,可以作为评判手术成功标准。
多数PPNAD患者作为Carney综合征(Carney complex,CNC)的部分表现而发病。CNC是一种常染色体显性遗传的多发性肿瘤综合征[8],其特征包括皮肤点状的色素沉着,如雀斑或蓝痣,常见的内分泌肿瘤包括PPNAD、睾丸支持细胞瘤、生长激素分泌型垂体腺瘤、甲状腺瘤、甲状腺癌等,非内分泌肿瘤包括皮肤粘液瘤、乳腺导管腺瘤、心房粘液瘤、黑色素性神经鞘瘤、软骨粘液瘤等。至少符合以上两种主要表现才能诊断CNC。目前已经分离出的CNC的3个基因位点分别位于17q22-24(CNC1)、17p12-13.1以及2p16(CNC2),已经识别出的4种致病基因包括蛋白激酶A调节亚基1-α(PRKAR1A)、磷酸二酯酶11A(PDE11A)、磷酸二酯酶8B(PDE8B)以及肌球蛋白重链基因(MYH8)[9-10]。其中PRKAR1A是一种重要的抑癌基因,该基因突变可导致PKA活性增加从而引起肿瘤的发生及发展。一项纳入353例CNC或PPNAD的基因研究显示,73%的患者共携带80种不同的PRKAR1A突变,但如果仅研究先证者,该比例则为62%[11]。本例患者结合既往病史和生化指标,先后两侧肾上腺切除手术史及术后病理结果,PPNAD诊断基本成立;查体面部及口唇多发色素沉着样雀斑,高度可疑存在CNC。术后曾多次建议其本人及家庭成员行基因检测,因种种原因患者未遵医嘱,故无法明确是否存在以上几种基因突变。针对于其本人,目前病情控制稳定,后续应每年定期行相关检查尽早发现甲状腺、乳腺、心脏等相关脏器肿瘤的发生。
二、关于胚胎植入前遗传学筛查
胚胎植入前遗传学筛查(PGS)是通过从胚胎中活检少量细胞进行基因分析,将检测出的染色体数目正常的整倍体胚胎行IVF,提高胚胎种植率,降低流产率,从而增加活产率。随着PGS技术的不断发展,目前植入前遗传学检测(PGT)包括3种类型:(1)单基因疾病的植入前遗传学检测(PGT-M):用于如父母双方或其中一方携带已知的遗传基因突变,则需要筛选没有受到特定遗传特征影响的胚胎进行移植,以避免子代再次患病;(2)染色体结构重排的植入前遗传学检测(PGT-SR):用于鉴定胚胎染色体有无结构性异常,如缺失、异位等;(3)非整倍体的植入前遗传学检测(PGT-A):就是以往所谓的PGS,用于鉴别非整倍体胚胎从而改善胚胎种植,减少流产及相关并发症的发生[12]。
目前临床上,PGS主要用于检测染色体数目、结构的异常以及常染色体显性遗传、常染色体隐性遗传或X连锁遗传疾病等的单基因遗传疾病。对于高龄、多次不良孕史、反复IVF失败、既往有过染色体异常妊娠或子女以及存在家族性遗传疾病的人群,符合PGS指征。而本例患者虽然是一种常染色体显性遗传疾病,但存在遗传异质性,而且没有基因诊断证据,故“先证者”的遗传变异并不明确,并不能保证PGS能够有明确帮助。此外,PPNAD这一罕见病并不具有显著的致死致残性,也不属于明确需要筛查的疾病,患者自身并无基因诊断和遗传咨询的意愿,即便日后需要人工助孕,也需要尊重其个人和家庭的选择。
基因诊断的时代虽然已经来临,但与生育相关的遗传咨询比我们想象的要复杂得多,尤其是具有遗传异质性的多基因病变,常规的检测并非一定能带来获益,就目前认为指征明确的PGS,通过随机对照研究也证实对提高活产率没有显著助益[13-14],更提醒我们不要盲目崇信所谓“新技术”,只有实践才是检验真理的唯一途径。基因信息的一知半解有时候比“无知者无畏”更有害,增加了无确定答案的恐慌,也浪费了很多金钱和精力。医学问题的探索总是难免有曲折,但循证医学给我们最大的告诫就在于:在没有获得充分证据的前提下,不宜过早地把临床研究转化为常规诊疗项目。

