肠道菌群相关短链脂肪酸的研究进展
0 引言
肠道微生物群对人体肠道健康起着重要作用,其受到饮食物的调节,特别是人体可利用的碳水化合物.碳水化合物的微生物分解是一个厌氧过程,称为发酵.现阶段有研究表明,膳食中的多糖,包括淀粉和非淀粉多糖(膳食纤维),在人体小肠中无法消化,可能会由生活在盲肠和结肠中的厌氧菌发酵,产生短链脂肪酸(short-chain fatty acids,SCFAs)作为其主要的最终产物,可以为肠道微生物的生长和维持肠道细胞功能提供能量,对人体多个器官和代谢产生较大的影响,对人类健康至关重要.饮食对肠道微生物群的组成和短链脂肪酸的浓度也有着深远的影响.近年大量研究发现,SCFAs具有维持水电解质平衡、调节肠道菌群平衡、改善肠道功能、抗炎、抗肿瘤和调控基因表达等重要作用.
1 SCFAs概述
1.1 SCFAs的来源和组成 SCFAs又称挥发性脂肪酸(volatile fatty acids,VFA),是由1-6个碳原子组成的有机脂肪酸,是肠道菌群的重要产物之一,主要是由胃消化吸收的食物残渣中的碳水化合物(膳食纤维、抗性淀粉、低聚糖等)经结肠内厌氧菌酵解产生,少量来自于蛋白质(膳食蛋白和内源性蛋白)降解和氨基酸发酵(表1
),主要包括乙酸盐、丙酸盐和丁酸盐等.
无源远程传感系统包括一个掺铒光纤激光器,其中一个谐振腔镜是由光纤环形镜构成的,光纤环形镜具有高反射率和宽反射带宽的特点;另外一个谐振腔镜由布拉格光纤光栅构成,设计中为了同时保证低阈值和较高的激光输出功率,光栅的反射率做了优化。

SCFAs的主要产生部位在结肠,其在结肠内的浓度为(20-140) mmol/L[其中远端结肠的浓度约为(20-70)mmol/L,近端结肠的浓度约为(70-140) mmol/L]
.SCFAs的浓度取决于肠道微生物组成、肠道传递时间、SCFAs的宿主-微生物代谢通量和宿主饲料中的纤维含量
,在近端结肠和盲肠中SCFAs的浓度最高.在一项为期4 wk的人类干预研究中,每天补充抗性淀粉30 g,餐后全身乙酸盐和丙酸盐浓度分别增加到280 μmol/L和13 μmol/L
.人体内肠道菌群主要分为四大类:厚壁菌门(Firmicutes,占肠道菌群总量的60%)、拟杆菌门(Bacteroidetes,占肠道菌群总量的20%)、变形菌门(Proteobacteria,占肠道菌群总量的5%-10%)和放线菌门(Actinobacteria,占肠道菌群总量的3%),其中Firmicutes和Bacteroidetes是产生SCFAs的两门优势菌
,在结肠中,乙酸盐、丙酸盐和丁酸盐的含量约占SCFAs总量的90%左右
,且三者比例固定,约为60:20:20
.细菌连续的代谢活动导致结肠内仅存在极微量的氧,进而形成一个适合厌氧微生物繁衍的环境.复杂的碳水化合物经过连续水解成简单的糖,并受到菌群进一步代谢,最终成为多种发酵产物,如SCFAs、甲烷、氢、二氧化碳及其他有机酸等.
设计意图:学生结合问题进行交流活动的过程,是对植物分类问题进行思考和整理的过程。而植物分类图解是学生难以理解的一个疑难点,教师适时进行讲解、解惑的同时,也帮助学生实现了对植物分类的方法和依据的整体感悟。另外,学生也体会到生物学最核心的思想——进化思想和生态学思想,“有助于摈弃人类中心主义及极端功利型的价值观”,有助于人们形成积极向上、珍爱生命同时又顺应自然的人生观,进而树立正确的世界观、价值观。
1.2 SCFAs的合成和分布 SCFAs可由肠道菌群通过不同的代谢途径产生.在结肠中普遍存在的厌氧条件下,碳水化合物将优先在近端结肠中被微生物水解成单糖,然后通过Embden Meyerof途径发酵成磷酸烯醇丙酮酸,然后将磷酸烯醇丙酮酸中间体通过不同的反应生成SCFAs
.乙酸盐可由大量的肠道厌氧菌通过乙酰辅酶A,或通过Wood-Ljungdahl途径生成;丙酸可以通过琥珀酸、丙烯酸酯或丙二醇途径产生;丁酸通常是由两个乙酰辅酶A分子通过丁酸激酶或丁基辅酶A:乙酸辅酶A转移酶缩合而成;乙酸盐与其他SCFAs相比,一般在结肠中达到最高水平
.
4.3 低聚糖 又称寡糖,由2-10个单糖通过糖苷键连接形成,包括果寡糖、低聚乳糖、异麦芽糖、乳果糖、大豆寡糖、龙胆寡糖等,分为普通型和功能型低聚糖.普通型低聚糖能够被机体消化吸收,而功能型低聚糖由于在机体内缺乏对应的水解酶而不能被消化吸收,最终被肠道厌氧菌发酵进而产生短链脂肪酸.母乳喂养的婴儿产乙酸盐占96%左右,接近于总SCFAs,几乎不产丁酸盐,故而和母乳喂养状态最接近的被认为益生作用最好,秦雪梅
通过实验研究表明,小鼠服用低聚果糖后,肠道内有益菌双歧杆菌、乳酸菌明显增加,且低聚糖组代谢产物的乙酸盐含量较高,丁酸盐含量较少,与母乳喂养接近,进一步验证低聚糖对婴儿的益生作用.李艳莉
通过体外发酵实验表明,灌胃低聚糖溶液后小鼠回肠中乳酸盐和乙酸盐含量均有所增加,故而低聚糖的添加能促进肠道菌群酵解代谢,且培养基中低聚果糖或低聚半乳糖的添加较未添加的培养基对婴儿肠道益生菌的生长繁殖效果更好.
在盲肠、升结肠或横结肠吸收的SCFAs进入肠系膜上静脉,在降结肠和乙状结肠吸收的SCFAs进入肠系膜下静脉,后进入门静脉和肝脏;在乙状结肠和直肠吸收的SCFAs也可以通过盆腔丛绕过肝脏,流入下腔静脉,从而直接进入体循环
.
1.3 影响SCFAs生成的因素 影响SCFAs生成的因素主要包括:肠道微生物种类和数量、底物的来源、底物利用率、肠道内pH环境、在肠道内转运时间长短、肠道气体的产生、宿主自身因素等.不同微生物作用产生的SCFAs的数量和类型均不相同.微生物的生长需要一定的温度、pH环境:在肠道内,不同微生物适宜生长的pH环境不同,进而影响SCFAs产生,而肠道pH会随着SCFAs的产生而变化;宿主机体温度升降与否影响着微生物的生长与繁殖,最终影响微生物发酵的终产物,温度还可影响微生物合成的方向
.实验研究表明
,碳水化合物底物的不同,发酵产生的SCFAs比例和生理作用也不同.肠道中各种气体在发酵过程中会产生各种化学反应,进而影响SCFAs的生成
.
2 SCFAs的种类及作用
微生物发酵后产生的SCFAs参与人体内不同器官的代谢并发挥各自的功效.发酵基质的数量、种类、降解速率、降解程度以及肠道菌群和宿主生理状态等因素都会影响SCFAs的种类和数量.结肠细菌的种类或培养条件,对SCFAs的类型数量有很大的影响(表2)
.
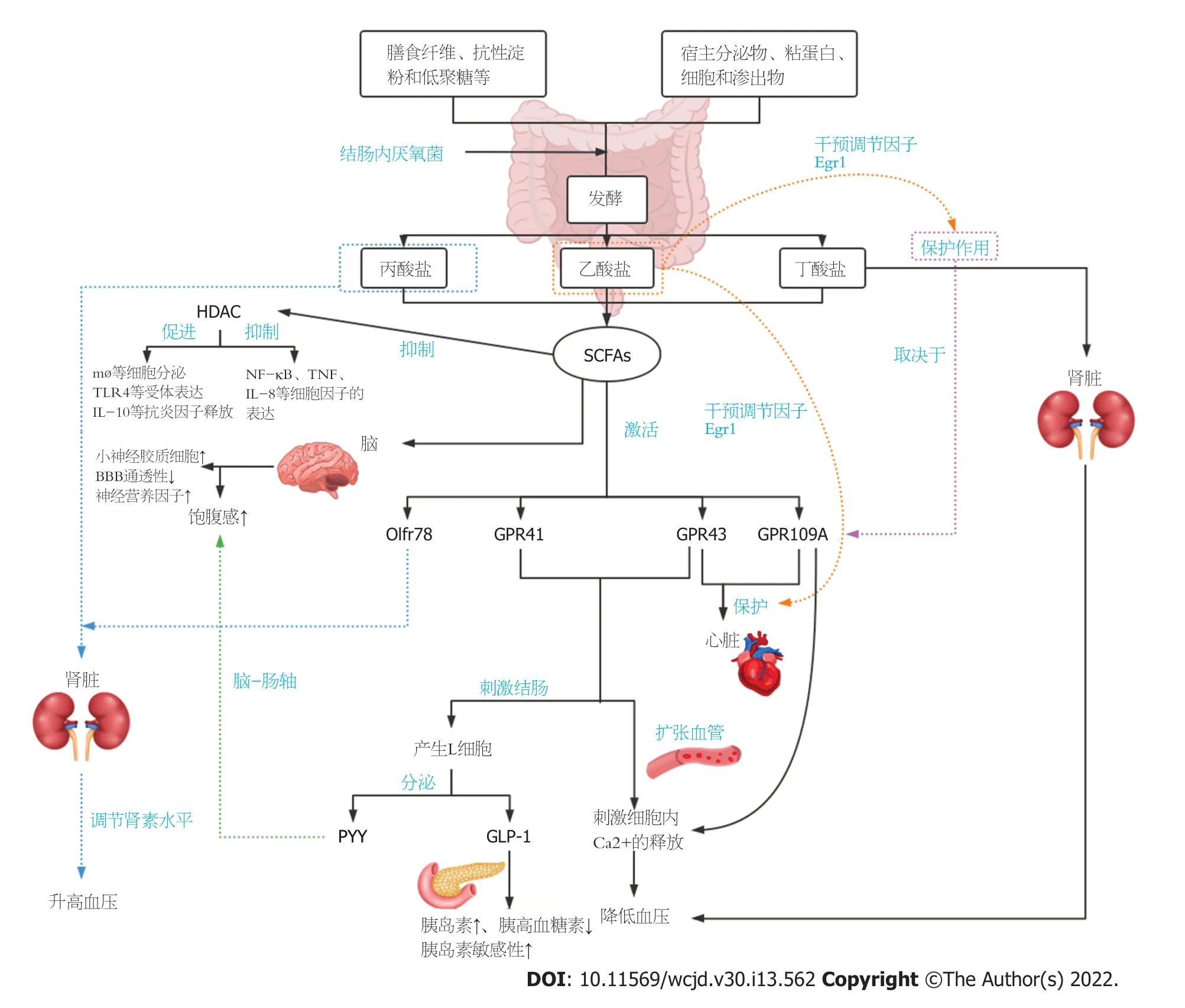
3.2 作用机制 SCFAs主要通过以下两种机制调节肠道功能:抑制组蛋白去乙酰化酶(histone deacetylase,HDAC)来调节基因表达,结合SCFAs受体来影响肠道功能.在结肠中,SCFAs受体主要包括G蛋白偶联受体(G protein-coupled receptors,GPRs)41、GPR42、GPR43、GPR109A、GPR164等.GPR41主要由丙酸激活,其次是丁酸和乙酸;GPR43被乙酸、丙酸、丁酸以相似的速率激活;在肠道上皮细胞、脂肪细胞和免疫细胞中表达的GPR109A被发现对丁酸有反应
.GPR41和GPR43识别乙酸盐、丁酸盐和丙酸盐的亲和力在物种间存在差异,而只有丁酸盐激活GPR109A,丙酸盐和丁酸盐激活GPR41和丁酸激活GPR109A会抑制环磷酸腺苷的积累以及蛋白激酶A和丝裂原活化蛋白激酶的激活
.SCFAs抑制HDAC,一方面促进巨噬细胞(Macrophages,mø)等细胞的分泌,Toll样受体(toll-like receptor,TLR)4等受体的表达、白介素(interleukin,IL)-10等抗炎因子的释放
;另一方面抑制核因子-κB(nuclear factor-κB,NF-κB)、肿瘤坏死因子(tumor necrosis factor,TNF)、IL-8等细胞因子的表达
.
2.2 丙酸 丙酸盐经结肠吸收后,通过门静脉进入肝脏,随后由肝细胞代谢,参与丙酮酸逆转化为葡萄糖的过程.肝脏是胆固醇体内合成的主要场所,HMG-CoA还原酶是肝细胞合成胆固醇过程中的限速酶,催化生成甲羟戊酸,抑制HMG-CoA还原酶能阻碍胆固醇合成
.屠友金等
将丙酸钠添加到肥育猪饲料中,研究其胆固醇代谢,结果显示,丙酸盐的添加能够降低血清中胆固醇的含量,同时还能显著降低肝脏中HMG-CoA还原酶的活性.
2.3 丁酸 丁酸盐能被结肠上皮细胞吸收利用,是肠道主要能源,多存在于结肠和盲肠中,为分离的结肠细胞提供约60%-70%的能量需求
.丁酸盐还能维持结肠黏膜的完整性、调节基因表达、抑制肿瘤细胞的增殖分化、维持肠道内环境稳定,对结肠炎和结肠癌起到预防作用.韩蕊蕊
通过检测HT-29及Caco-2细胞株中丁酸钠对miR-203和NEDD9表达水平的影响,得出丁酸盐可通过miR-203/NEDD9通路抑制直肠癌细胞增殖,诱导细胞凋亡,抑制细胞侵袭作用.
3 SCFAs在肠道中的转运和作用机制
3.1 在肠道中的转运 SCFAs主要依靠单羧酸转运蛋白1(monocarboxylate transporter 1,MCT1)和钠偶联的单羧酸转运蛋白1(sodium-coupled monocarbixylate transporter 1,SMCT1)在肠道中进行转运.MCT1是一种H
偶联的低亲和力转运蛋白,在结肠基底外侧膜和结肠上皮顶膜中表达,发生电性的SCFA-H
共转运
,也能以质子相互依赖的方式转运乳酸和丙酮酸
;SMCT1是一种Na
偶联的高亲和力转运蛋白,仅在结肠上皮顶膜表达,发生电性的SCFA-2Na
的共转运
,SMCT1优先转运丁酸盐,并以较慢的速度运输丙酸盐和乙酸盐
,转运后,SCFAs可自由地从结肠上皮细胞流入管腔或从管腔流入细胞
.
2.1 乙酸 在机体内,乙酸盐是结肠内多数厌氧菌发酵小肠未消化吸收的碳水化合物产生的主要代谢产物,也是胆固醇合成的主要底物,可提供人体日总能量的10%,是细菌为宿主提供能量的主要来源
.除未消化吸收的碳水化合物,乙酸盐也是结肠内蛋白质降解和氨基酸发酵后的主要产物.在肠道厌氧菌作用下,谷氨酸、组氨酸、赖氨酸、半胱氨酸、蛋氨酸、脯氨酸、甘氨酸和丝氨酸都可以通过氨基酸脱氨基作用生成乙酸盐
.乙酸盐通过门静脉进入肝脏,在肝脏中的代谢较少,故而小部分留在肝脏,大部分系统地释放到体循环中,随血液运输到各个组织
,与丙酸(1-13) μmol/L和丁酸(1-12)μmol/L相比,乙酸盐在肝脏中吸收最多,并达到最高的外周浓度(19-160) μmol/L
.
4 底物对SCFAs产生的影响
人类肠道微生物群在食物的直接摄入中起着重要作用,同时在哺乳动物的营养系统中也起着重要作用.大多数食物的吸收和消化发生在胃肠道,肠道微生物群的组成部分共生菌在其中发挥着非常重要的作用,其在蛋白质、脂质和更重要的碳水化合物代谢中也发挥着作用.这些共生菌将碳水化合物(主要是宿主不易消化的碳水化合物,如非淀粉多糖、抗性淀粉、低聚糖等)发酵成CO
、H
和CH
,以及主要是乙酸、丙酸和丁酸的SCFAs.在肠道中产生的大多数SCFAs随后被宿主吸收,并为其提供能量.
盲襻综合征是指小肠襻的内容物淤滞,且因SCFAs含量升高,肠道内pH值下降,酸性环境下耐酸菌种(如乳酸杆菌)大量繁殖,产生D,L-乳酸(D,L-乳酸被吸收入血,导致体内D,L-乳酸浓度明显升高),致使肠道环境发生改变,从而造成的吸收不良综合征
.谭力等
通过建立盲襻综合征大鼠模型进行实验得知,实验组血浆D,L-乳酸和SCFAs水平随着时间的延长而显著上升,且在第4周使显著高于对照组,肠液菌落4周后达到1.1×10
/mL,能较好地反映肠液菌群的增殖程度,以达到调节肠道正常菌群平衡的目的.
6.2 调节肠道微生态平衡(调节肠道内的pH值) 在肠道内,大肠杆菌、葡萄球菌、沙门菌等致病菌或条件致病菌适宜生长的pH环境为6.0-7.0,当处于pH环境低于4.0时基本失活,而乳酸菌等益生菌最适宜生长的pH环境为3.0-4.5;SCFAs主要以阴离子(SCFA
)的形式存在于肠道环境中,当肠道内SCFAs浓度升高时,可释放出H
降低肠道酸碱度,进而降低肠道内的pH值,从而促进肠道内益生菌的生长增殖,抑制大肠杆菌、链球菌、沙门菌等致病菌或条件致病菌的生长
.在肠道pH环境下,质子化形式的SCFAs可通过扩散作用进入病原微生物细胞内解离出H
,使膜内外pH差值缩小,从而影响细菌细胞的正常生理活动
.综上,SCFAs可以在一定程度上降低肠道pH(主要是通过释放H
),进而抑制病原微生物的活力来促进肠道微生态平衡.
南京大学中文系葛桂录教授认为比较文学冲决了曾经是人为的界限,能使学生“在多元的文化语境中重新认识自己,为自己提供一种认识自身的他者眼光。它能启发我们在阅读和分析作品时,要具有世界文学和世界文化的宏阔视野,不断尝试更换一种角度理解作品,才能有新的发现、新的启示。这对于打破既有的思维框框和认识局限,扩大学生的知识视野与信息容量,更新知识结构,培养一种触类旁通的辩证比较思维能力,都有很大的现实意义”。[10]
4.1 非淀粉多糖 非淀粉多糖(non-starch polysaccharides,NSP)是由若干个单糖通过糖苷键连接而成的多聚体,包括纤维素、果胶、半纤维素、树胶、β-葡聚糖、果聚糖以及半乳糖等,是大多膳食纤维的主要组成部分,主要存在于谷物的皮壳、蔬菜和水果中.不同碳水化合物会影响肠道中不同菌群的发酵能力,故而不同的多糖发酵可以产生不同总量和比例的SCFAs.王金全等
通过试验发现在肉仔鸡日粮中添加小麦NSP作为微生物发酵底物对肉仔鸡肠道微生物,特别是厌氧菌微生物产生了增殖效应,而却抑制了其他微生物的生长,造成肠道内微生物结构发生改变,从而改善肠道微生物平衡状态.燕麦β-葡聚糖的添加可使小鼠肠道和粪便中的双歧杆菌和乳酸杆菌增殖
.白俊英
通过研究燕麦β-葡聚糖对肠道菌群代谢的影响,测定粪便样品中SCFAs含量,得出补充β-葡聚糖能显著逆转因葡聚糖硫酸钠处理导致的小鼠肠道中乙酸、丙酸和丁酸含量的降低,进而缓解葡聚糖硫酸钠诱导的小鼠结肠炎症.易中华等
以玉米、小麦、豆粕、小麦麸等的NSP提取物进行体外发酵试验,试验得出以上NSP提取物均在不同程度上提高了SCFAs的产量(尤其是乙酸,随着发酵时间增加丁酸比例也逐渐增加)以及产生速率.
4.2 抗性淀粉 抗性淀粉(resistant starch,RS)被定义为淀粉中不被小肠降解和吸收,并到达大肠用作发酵底物的部分,又称抗酶解淀粉及难消化淀粉,可被结肠的菌群酵解为SCFAs,主要存在于谷类、豆类及香蕉等水果中,特别是高直链淀粉的玉米淀粉含抗性淀粉高达60%.利用人类粪便接种物进行体外发酵研究的数据表明,淀粉发酵有利于SCFAs的产生,可能有利于宿主的生长.增加SCFAs的产量,特别是丁酸,通常对人体健康有益.SCFAs可以降低结肠中的pH值,从而防止致病菌的过度生长
.张铁涛等
模拟大肠的微生物环境,以健康成人和婴儿新鲜粪便提取物对青香蕉抗性淀粉进行发酵,随着发酵时间的延长,发酵产物中SCFAs的总量及丁酸含量逐渐增加(丁酸含量增加显著),且婴儿新鲜粪便提取物发酵产生的SCFAs总量明显高于同等条件下成人新鲜粪便提取物的发酵产物,进一步验证了抗性淀粉在肠道内的发酵特性.He等
采用体外发酵系统,通过添加不同水平的玉米抗性淀粉,研究玉米抗性淀粉对猪大肠蛋白发酵特性的影响.研究结果表明,玉米抗性淀粉的加入提高了产气量和SCFAs的浓度,降低了盲肠和结肠的pH值(SCFAs浓度的增加是pH降低的主要原因).添加玉米抗性淀粉可促进体外发酵,增强体外发酵的效果,在盲肠和结肠培养12 h和24 h时,总短链脂肪酸、乙酸、丙酸和丁酸浓度均有所增加,因此,添加玉米抗性淀粉可改变发酵模式,有利于营养物质的消化.
在被保护的一次设备未发生故障的前提下,包括继电保护装置在内的控制跳闸的二次回路(硬件和接线)意外偶然接通或断路器机构故障而导致跳闸,称其为第一类误动,也以指数分布模型表示其概率:
5 SCFAs吸收及代谢
SCFAs生成后大部分被结肠细胞迅速且几乎完全吸收,或通过门静脉进入肝脏,或进入体循环,只有一小部分(约5%-10%)通过粪便排出.正常生理状况下,SCFAs大多数以阴离子(SCFA
)形式存在于肠腔内,吸收需要肠腔内的阳离子,机体对SCFAs的吸收主要有分子弥散性吸收和离子转运吸收2种
,故而SCFAs在肠内吸收的主要途径为:(1)分子弥散性形式吸收:在近端结肠通过Na
/H
交换,把细胞内的H
泵到肠腔,同时刺激肠腔中Na
的吸收;在远端结肠与K
-H
交换耦联.丁酸可通过向肠道上皮细胞供能以增加细胞内CO
的量,再经碳酸酐酶作用进而产生H
,以促进Na
/H
交换的进行
;(2)离子转运吸收:主要以SCFA
/HCO
-交换为主
.三种不同的SCFAs在结肠不同节段吸收率不同,乙酸在盲肠与近端结肠吸收最高,丁酸在远端结肠吸收最高.
SCFAs在不同的位置被吸收然后被机体利用,三种SCFAs在体内代谢途径不同:(1)乙酸主要在肌肉、肝脏、心脏、脑内代谢;少量的乙酸被肌肉细胞利用以供能,50%-70%的乙酸被肝脏吸收利用;(2)丙酸主要被肝脏吸收,参与糖异生作用,能够抑制胆固醇的合成;肝细胞利用丙酸和丁酸合成糖类物质;(3)丁酸利用率最高,主要参与糖异生、酮体生成及三酰甘油合成等,间接影响糖类和脂类的代谢;盲肠和结肠上皮细胞利用丁酸提供能量
.
6 SCFAs在肠道中发挥的生理功能及其作用机制
6.3 改善肠道功能(保护肠道黏膜屏障) 王艳梅等
通过实验研究表明,老龄小鼠的肠内容物SCFAs水平及反映肠粘膜细胞正常功能的钠葡萄糖共转运载体-1表达水平明显低于成年小鼠,而血浆内毒素和D-乳酸水平均明显高于成年小鼠,内毒素和D-乳酸易位入血增加,说明肠屏障功能出现障碍,其机制与肠道内低水平SCFAs降低肠黏膜细胞的正常功能有关.完全胃肠外营养是临床营养支持的重要手段,但该手段对肠黏膜有直接的抑制作用,且导致肠功能下降,丁亚萍等
通过建立完全胃肠外营养和结肠吻合的大鼠模型,研究表明化疗组结肠粘膜细胞增殖期百分比以及增殖指数均显著低于对照组和SCFAs组,从而得出添加SCFAs的完全胃肠外营养能促进术后化疗大鼠结肠粘膜细胞的增殖.也有实验研究证实,低浓度的SCFAs对维持肠黏膜屏障的完整性有益,但高浓度的SCFAs却能通过破坏肠黏膜屏障从而导致胃肠道损伤
.
6.1 维持水电解质平衡(促进肠道电解质平衡和对水的吸收) 水和电解质平衡主要指机体每日摄取和排出的水量以及钠量(细胞外液主要的电解质)是否保持平衡和如何保持平衡.SCFAs都属于弱酸,在消化道pH正常的情况下,发酵产生的95%以上的SCFAs主要以离子(SCFA
)形式存在于肠道环境中.机体对SCFAs的吸收主要有分子弥散性吸收和离子转运吸收2种,因乙酸和丙酸具有水溶性,故认为乙酸和丙酸大多以离子交换吸收为主.而丁酸具有水溶性和脂溶性,认为丁酸以离子交换吸收多,但以分子弥散性吸收为首选
.SCFAs对水和钠吸收有着重要作用,其中丁酸在肠道中主要以HSCFA形式吸收,而SCFAs以分子弥散性形式吸收时,需要通过Na
/H
交换,把细胞内的H
泵到肠腔,同时刺激肠腔中Na
的吸收.同时丁酸可通过向肠道上皮细胞供能来增加细胞内CO
的量,再经碳酸酐酶作用进而产生H
,以促进Na
/H
交换的进行;由于离子状态的SCFAs吸收主要以SCFA
/HCO
交换为主,故而与丁酸相比,乙酸和丙酸促进水钠吸收的作用就稍弱些
.综上,SCFAs两种形式的吸收促进了HCO
的分泌和Na
、水的吸收,对维持肠道水电解质平衡起着重要作用.
此外,利用NFC还可提供直接读取身份证的数据,减少驾驶人员注册环节的手动输入操作。绿通治理人员在对驾驶人员的信息进行补录时,同样可基于该技术减少手动录入操作,提高绿通治理的效率。
Rabbani等
通过为家兔灌注SCFAs后观察到,SCFAs能显著减少家兔结肠中水分的分泌,其中丁酸对家兔结肠中水分分泌量的减少最显著,其次是丙酸、乙酸.该实验结果表明,丁酸能显著减少家兔体内Na
、K
和Cl
的分泌;丙酸可减少家兔体内HCO
-的分泌;乙酸能显著抑制Na
和Cl
的分泌,但其抑制K
、HCO
分泌的程度与对照组无差异.故而SCFAs能减少由霍乱毒素诱导的家兔近端结肠中水和电解质的分泌,进而有利于维持家兔机体中水电解质的平衡.
由于大肠近端碳源尤其是易消化的碳水化合物消耗快,当残留物向肠道远端移动时,细菌对底物利用率逐渐减少
(SCFAs在直肠和近端结肠的浓度最高,在远端结肠的浓度下降).大量实验研究表明,碳水化合物底物的不同,酵解产生的SCFAs的总量和比例不同,对肠道的生理作用也不同.秦雪梅等
通过体外培养,分析低聚果糖、低聚半乳糖和聚葡萄糖对婴儿肠道菌群的益生作用,通过测定不同时间代谢产物的pH来判断低聚糖和水溶性膳食纤维的抗发酵能力和被降解速率,分析代谢产物中SCFAs含量,发现3种碳源的SCFAs总量和比例各不相同,SCFAs含量都有所增加,其中聚葡萄糖组的丁酸盐含量很少.姚圣蜜等
通过对受试者进行氢呼气试验,分析不同底物发酵后的气体和SCFAs变化情况,分别以底物低聚果糖、低聚半乳糖、木糖醇进行体内发酵2 h,测得各底物血浆总SCFAs的含量和比例各不相同,其中摄入木糖醇后2 h的丁酸浓度较基础浓度升高.
1.2 入选与排除标准 入选标准 ①需使用气压止血带的四肢手术患者。②年龄18~59周岁。③意识清楚,思维正常;心、肝、肾、肺功能正常;麻醉方式为连续硬膜外麻醉;手术时间在60~120 min。所有患者均签署知情同意书。排除标准:①排除止血带缚扎部位有破损、炎症。②有血管、淋巴管疾患、严重挤压伤等气压止血带禁忌证的患者。
近年大量研究发现,SCFAs对肠道不仅具有氧化功能作用,还具有维持水电解质平衡、调节肠道菌群平衡、改善肠道功能、抗炎、抗肿瘤和调控基因表达等重要作用.
采用NSGA-II优化算法对混合储能设备的容量配比进行选型,首先要确定优化设备参数量。表 4和表 5分别是磷酸铁锂电池和超级电容的备选参数,遗传算法中优化变量的相关参数见表6。
6.4 抗炎作用(对肠道炎症的抑制作用) 内皮细胞活化是炎症反应的一个重要特征,内皮细胞的活化会促使免疫细胞黏附分子(E-选择素、细胞间黏附分子-1,和血管细胞黏附分子-1等)基因的表达,从而导致白细胞黏附血管内皮,向组织中转移,进而扩大炎症反应.近年来研究表明,SCFAs可通过促进组蛋白乙酰化或激活GPRs
、激活过氧化物酶体增殖物激活受体
、抑制NF-κB信号通路
、促进T细胞凋亡
、促进抗菌肽的产生
以及信号传导及转录活化因子-3表达下调
来抑制炎症因子的表达或缓解炎症
.
自我国高校扩招政策实施以来,我国多数高校录取的学生数量不断上升,学生的学习水平以及能力之间的差异十分明显,虽然部分大学生出现学业不良问题是由其自身因素造成,但也有很多学生是由于一些外部原因的影响。近年来,国内高校出现退学、留级、无法毕业、未被授学位等情况比比皆是,这引起了人们对高校教育的深入思考,也有不少研究者对学业不良大学生的成因进行了深入分析,但在实践的教育中,还需要进一步的改善,以促进我国高校教育的教学质量得到进一步提升。笔者综合自己的教育经验以及相关研究者的文献研究,对学业不良大学生的成因及教育转化策略进行探讨,希望为我国高校教育质量的提升尽绵薄之力。
6.5 抗肿瘤作用(对癌细胞的抑制作用) 傅红等
以人高分化结肠癌Caco-2为模型,分析SCFAs对人结肠癌细胞增殖、分化与转移的影响,结果表明3种SCFAs均显著延长肿瘤细胞倍增时间,增强癌细胞分化标志物组蛋白酶的表达,并明显抑制癌细胞的转移,从而得出:SCFAs通过抑制癌细胞的增殖、分化和转移而起到抗肿瘤的作用.Kobayashi等
研究发现,丙酸盐和铂化合物协同作用,能通过激活GPR41信号通路减少HDAC,增加自分泌TNF-α的表达,从而显著诱导肝癌细胞凋亡.Hague等
研究发现,生理浓度下,乙酸、丙酸、丁酸均能诱导细胞凋亡,抑制结直肠肿瘤细胞的生长增殖,其中丁酸诱导的效果最好;实验中发现4株癌细胞株中有2株对丁酸诱导的细胞凋亡具有较强的耐药性,说明有一些癌细胞可能进化出了保护细胞不受丁酸诱导凋亡的机制.
6.6 调控基因表达 SCFAs对宿主的代谢、分化、增殖有广泛的影响,主要是由于其对基因调控的影响.SCFAs可通过抑制HDAC直接影响基因的转录和表达.研究表明
,丁酸盐调节了5%-20%的人类基因的表达.在细胞内,丁酸盐和丙酸盐对赖氨酸和HDAC活性具有很强的抑制能力,其中丁酸盐比丙酸盐更强
.此外,丁酸盐被代谢为乙酰辅酶A,乙酰辅酶A通过进一步增强组蛋白乙酰化来刺激组蛋白乙酰转移酶.
丁酸盐调节许多转运蛋白的表达,包括MCT1和SMCT1,因此可能会增加电解质交换和自身的转运.丁酸通过抑制Na-K-2Cl共转运蛋白的表达来阻断Cl
的分泌,并通过HDAC的抑制和一种特异性蛋白依赖途径来增加Na
/H
转运蛋白NHE3的表达
.
7 SCFAs对机体各器官的影响
GPR41与GPR43作为SCFAs受体被激活后可促进细胞内Ca
释放,进而降低血压
.丁酸盐通过保留肾小球基底膜足细胞和减轻肾小球硬化和组织炎症改善蛋白尿.GPR109A在足细胞中表达,通过小鼠实验表明丁酸酯的保护作用取决于GPR109A的表达,GPR109A的激活最终导致Ca
通量进入细胞质,增加细胞内Ca
水平,Ca
平衡的调节对于维持足细胞功能和细胞骨架组织至关重要,同时也可降低血压
.丁酸盐和GPR109A在肾脏疾病的发病机制中发挥作用,并为饮食、肠道菌群和肾脏疾病之间提供重要的分子连接之一.低纤维西化饮食的不利影响可能通过SCFAs不足和GPR43/GPR109A信号通路导致高血压,故而保持一个健康的、产生SCFAs的微生物群对心血管健康很重要.将SCFAs引入纤维耗尽的小鼠对高血压、心肌肥厚和纤维化的发展有保护作用,SCFAs的心脏保护作用通过同源SCFA受体GPR43/GPR109A介导
.Pluznick等
通过研究发现两个感觉受体:嗅觉受体78(olfactory receptor 78,Olfr78)和GPR41,是新型的血压调节器.Olfr78和GPR41均为SCFAs的受体,研究发现丙酸以Olfr78依赖的方式修饰肾素释放,并通过Olfr78和GPR41调节外周阻力(血管张力),从而影响血压,其中GPR41有助于丙酸的降压作用,相反,Olfr78拮抗丙酸的降压作用,即升高血压
.早期生长反应蛋白1(early growth response protein 1,Egr1)是参与心肌肥厚、心肾纤维化和炎症的主要心血管调节因子,高纤维和乙酸盐对心肾的保护作用伴随着心脏和肾脏调节因子Egr1的下调
.SCFAs能够激活GPR41和GPR43,刺激结肠内分泌胰高血糖素样肽-1(glucagonlike peptide-1,GLP-1)和酪酪肽(peptide tyrosine tyrosine,PYY)等肠道激素.GLP-1可以促进机体分泌胰岛素,降低胰高血糖素的分泌并增强机体对胰岛素的敏感性;PYY可以调节肠道运动减缓胃排空,产生饱腹感,减少机体摄入食物
.SCFAs可通过调控小胶质细胞、影响神经递质和神经营养因子浓度、血脑屏障(blood brain barrier,BBB)的结构完整性和功能的正常发挥以及HDCA对机体脑卒中进行保护
(图1).
定义7 设X为一非空集合,υ1=(A1,λ1),υ2=(A2,λ2)是定义在X上的两个智立方集,则υ1和υ2之间的可能度公式为
8 结论
SCFAs作为肠道厌氧菌发酵未消化碳水化合物的主要产物,是肠道菌群的重要代谢产物之一,对机体肠道具有维持水电解质平衡、调节肠道菌群平衡、改善肠道功能、抗炎、抗肿瘤、调节免疫和调控基因表达等重要作用,对高血压、炎症性肠病、肠易激综合征、结肠癌和非酒精性脂肪性肝病等疾病有着一定的治疗作用.
肠道健康受微生物群落组成和饮食成分的细菌代谢最终产物的影响,故调整并改善日常膳食结构进而调节肠道内SCFAs的产生,可维持肠道内环境稳定,使肠道微生态系统处于良好状态,维持机体的健康.通过继续进一步深入探究肠道SCFAs相关底物、作用机制及代谢机制,对今后开展相关研究具有一定指导意义,也可为临床治疗相关疾病提供研究方向.
1 陈燕,曹郁生,刘晓华.短链脂肪酸与肠道菌群.江西科学 2006;1:38-40+69 [DOI:10.13990/j.issn1001-3679.2006.01.010]
2 Cummings JH,Pomare EW,Branch WJ,Naylor CP,Macfarlane GT.Short chain fatty acids in human large intestine,portal,hepatic and venous blood.
1987;28:1221-1227 [PMID:3678950 DOI:10.1136/gut.28.10.1221]
3 Rooks MG,Garrett WS.Gut microbiota,metabolites and host immunity.
2016;16:341-352 [PMID:27231050 DOI:10.1038/nri.2016.42]
4 Robertson MD,Bickerton AS,Dennis AL,Vidal H,Frayn KN.Insulin-sensitizing effects of dietary resistant starch and effects on skeletal muscle and adipose tissue metabolism.
2005;82:559-567 [PMID:16155268 DOI:10.1093/ajcn.82.3.559]
5 费嘉,罗军涛,章小英,于晓巍,叶建平.短链脂肪酸在肠道菌群调节人体能量代谢中的作用.中华糖尿病杂志 2018;10:370-373
6 Garcia A,Olmo B,Lopez-Gonzalvez A,Cornejo L,Rupérez FJ,Barbas C.Capillary electrophoresis for short chain organic acids in faeces Reference values in a Mediterranean elderly population.
2008;46:356-361 [PMID:18055154 DOI:10.1016/j.jpba.2007.10.026]
7 Blaak EE,Canfora EE,Theis S,Frost G,Groen AK,Mithieux G,Nauta A,Scott K,Stahl B,van Harsselaar J,van Tol R,Vaughan EE,Verbeke K.Short chain fatty acids in human gut and metabolic health.
2020;11:411-455 [PMID:32865024 DOI:10.3920/BM2020.0057]
8 Canfora EE,Jocken JW,Blaak EE.Short-chain fatty acids in control of body weight and insulin sensitivity.
2015;11:577-591 [PMID:26260141 DOI:10.1038/nrendo.2015.128]
9 任傲,童勤,张彬.短链脂肪酸的生成及其吸收机制.广东饲料2015;24:28-29
10 秦雪梅,刘静,霍贵成.低聚糖与水溶性膳食纤维对婴儿肠道菌群益生作用研究.食品科技 2011;36:96-100 [DOI:10.13684/j.cnki.spkj.2011.06.038]
11 姚圣蜜.FODMAPs在健康人群体内外发酵的对比研究.浙江大学2017
12 Zheng L,Kelly CJ,Battista KD,Schaefer R,Lanis JM,Alexeev EE,Wang RX,Onyiah JC,Kominsky DJ,Colgan SP.Microbial-Derived Butyrate Promotes Epithelial Barrier Function through IL-10 Receptor-Dependent Repression of Claudin-2.
2017;199:2976-2984 [PMID:28893958 DOI:10.4049/jimmunol.1700105]
13 杭露,周盐,孟杨杨,冯雅,王殷姝,袁建业.短链脂肪酸与肠易激综合征关系的研究进展.世界华人消化杂志 2021;29:1102-1109[DOI:10.11569/wcjd.v29.i19.1102]
14 刘松珍,张雁,张名位,孙远明,魏振承.肠道短链脂肪酸产生机制及生理功能的研究进展.广东农业科学 2013;40:99-103 [DOI:10.16768/j.issn.1004-874x.2013.11.025]
15 陈福,何邵平,田科雄,贺建华.短链脂肪酸的生理功能及其在畜禽生产中的应用.动物营养学报 2019;31:3039-3048
16 Tan J,McKenzie C,Potamitis M,Thorburn AN,Mackay CR,Macia L.The role of short-chain fatty acids in health and disease.
2014;121:91-119 [PMID:24388214 DOI:10.1016/B978-0-12-800100-4.00003-9]
17 Kikuchi T,Nagata Y,Abe T.In vitro and in vivo antiproliferative effects of simvastatin,an HMG-CoA reductase inhibitor,on human glioma cells.
1997;34:233-239 [PMID:9258815 DOI:10.1023/a:1005753523949]
18 屠友金,胡彩虹.低聚果糖和丙酸钠对肥育猪胆固醇代谢的影响.中国粮油学报 2005;20:65-68
19 韩蕊蕊.丁酸钠上调miR-203抑制结直肠癌细胞增殖.郑州大学2017
20 Martin-Gallausiaux C,Marinelli L,Blottière HM,Larraufie P,Lapaque N.SCFA:mechanisms and functional importance in the gut.
2021;80:37-49 [PMID:32238208 DOI:10.1017/S0029665120006916]
21 王子花,申瑞玲,李文全.短链脂肪酸的产生及作用.畜牧兽医科技信息 2007;2:12-13
22 王金全,蔡辉益,周岩华,刘国华,张姝,印遇龙.小麦日粮非淀粉多糖和木聚糖酶对肉仔鸡肠道微生物区系的影响.畜牧兽医学报 2005;36:1014-1020
23 申瑞玲,王章存,姚惠源.燕麦β-葡聚糖对小鼠肠道菌群的影响.食品科学 2005;26:208-212
24 白俊英.肠道微生物代谢燕麦β-葡聚糖及对小鼠肠道炎症的影响.江南大学 2021 [DOI:10.27169/d.cnki.gwqgu.2021.001914]
25 易中华,朱年华,黎观红,宋小珍,潘珂,瞿明仁.鸡饲料中非淀粉多糖体外发酵特性评价的比较研究.饲料工业 2011;32:43-46
26 He X,Sun W,Ge T,Mu C,Zhu W.An increase in corn resistant starch decreases protein fermentation and modulates gut microbiota during in vitro cultivation of pig large intestinal inocula.
2017;3:219-224 [PMID:29767145 DOI:10.1016/j.aninu.2017.06.004]
27 张铁涛,徐云升,武天明.青香蕉抗性淀粉体外发酵特性研究.农产品加工(学刊) 2011;2:11-14
28 秦雪梅.低聚糖对婴儿肠道消化率的影响研究.东北农业大学,2011
29 李艳莉.低聚糖对婴儿肠道菌群的益生功能.东北农业大学,2012 30 赵怀宝,任玉龙.短链脂肪酸在动物体内的生理特点和功能.饲料研究 2016;3:29-32 [DOI:10.13557/j.cnki.issn1002-2813.2016.03.007]
31 耿珊珊,蔡东联.短链脂肪酸对结肠肿瘤细胞增殖分化的影响.肠外与肠内营养 2005;12:295-298
32 Rabbani GH,Albert MJ,Rahman H,Chowdhury AK.Shortchain fatty acids inhibit fluid and electrolyte loss induced by cholera toxin in proximal colon of rabbit in vivo.
1999;44:1547-1553 [PMID:10492131 DOI:10.1023/a:1026650624193]
33 何荣香,唐红艳,杨玲,马玉静,欧阳富龙,贺建华.短链脂肪酸在单胃动物肠道中的生理功能及其作用机制的研究进展.中国畜牧杂志 2020;56:1-5 [DOI:10.19556/j.0258-7033.20191212-03]
34 Fukuda S,Toh H,Hase K,Oshima K,Nakanishi Y,Yoshimura K,Tobe T,Clarke JM,Topping DL,Suzuki T,Taylor TD,Itoh K,Kikuchi J,Morita H,Hattori M,Ohno H.Bifidobacteria can protect from enteropathogenic infection through production of acetate.
2011;469:543-547 [PMID:21270894 DOI:10.1038/nature09646]
35 谭力,周济宏,王羽,赵小平,李幼生,刘放南.盲襻综合征大鼠D-,L-乳酸和短链脂肪酸的代谢.肠外与肠内营养 2007;14:201-204
36 王艳梅,韩易,王红.老龄小鼠肠短链脂肪酸对肠屏障功能的影响.上海医学 2008;31:352-355
37 丁亚萍,许勤,王建华,沈历宗,肇毅,王玲,吴文溪.添加短链脂肪酸的TPN对术后化疗大鼠结肠粘膜细胞增殖作用的研究.实用临床医药杂志 2006;10:38-41
38 侯龙龙,李仲荣.肠黏膜屏障及短链脂肪酸对其影响的研究进展.临床小儿外科杂志 2015;14:331-334
39 Cox MA,Jackson J,Stanton M,Rojas-Triana A,Bober L,Laverty M,Yang X,Zhu F,Liu J,Wang S,Monsma F,Vassileva G,Maguire M,Gustafson E,Bayne M,Chou CC,Lundell D,Jenh CH.Short-chain fatty acids act as antiinflammatory mediators by regulating prostaglandin E(2) and cytokines.
2009;15:5549-5557 [PMID:19938193 DOI:10.3748/wjg.15.5549]
40 Kinoshita M,Suzuki Y,Saito Y.Butyrate reduces colonic paracellular permeability by enhancing PPARgamma activation.
2002;293:827-831 [PMID:12054544 DOI:10.1016/S0006-291X(02)00294-2]
41 Lee C,Kim BG,Kim JH,Chun J,Im JP,Kim JS.Sodium butyrate inhibits the NF-kappa B signaling pathway and histone deacetylation,and attenuates experimental colitis in an IL-10 independent manner.
2017;51:47-56[PMID:28802151 DOI:10.1016/j.intimp.2017.07.023]
42 Ogawa K,Yasumura S,Atarashi Y,Minemura M,Miyazaki T,Iwamoto M,Higuchi K,Watanabe A.Sodium butyrate enhances Fas-mediated apoptosis of human hepatoma cells.
2004;40:278-284 [PMID:14739099 DOI:10.1016/j.jhep.2003.09.021]
43 Xiong H,Guo B,Gan Z,Song D,Lu Z,Yi H,Wu Y,Wang Y,Du H.Butyrate upregulates endogenous host defense peptides to enhance disease resistance in piglets via histone deacetylase inhibition.
2016;6:27070 [PMID:27230284 DOI:10.1038/srep27070]
44 Kanauchi O,Serizawa I,Araki Y,Suzuki A,Andoh A,Fujiyama Y,Mitsuyama K,Takaki K,Toyonaga A,Sata M,Bamba T.Germinated barley foodstuff,a prebiotic product,ameliorates inflammation of colitis through modulation of the enteric environment.
2003;38:134-141 [PMID:12640526 DOI:10.1007/s005350300022]
45 冉舒文,慕春龙,朱伟云.丁酸抑制溃疡性结肠炎分子机制的研究进展.世界华人消化杂志 2018;26:856-861 [DOI:10.11569/wcjd.v26.i14.856]
46 傅红,师英强,莫善兢.短链脂肪酸对人结肠癌Caco-2细胞增殖分化的影响与临床意义.中华消化杂志 2003;23:21-23
47 Kobayashi M,Mikami D,Uwada J,Yazawa T,Kamiyama K,Kimura H,Taniguchi T,Iwano M.A short-chain fatty acid,propionate,enhances the cytotoxic effect of cisplatin by modulating GPR41 signaling pathways in HepG2 cells.
2018;9:31342-31354 [PMID:30140374 DOI:10.18632/oncotarget.25809]
48 Hague A,Elder DJ,Hicks DJ,Paraskeva C.Apoptosis in colorectal tumour cells:induction by the short chain fatty acids butyrate,propionate and acetate and by the bile salt deoxycholate.
1995;60:400-406 [PMID:7829251 DOI:10.1002/ijc.2910600322]
49 Basson MD,Liu YW,Hanly AM,Emenaker NJ,Shenoy SG,Gould Rothberg BE.Identification and comparative analysis of human colonocyte short-chain fatty acid response genes.
2000;4:501-512 [PMID:11077326 DOI:10.1016/s1091-255x(00)80093-1]
50 Rada-Iglesias A,Enroth S,Ameur A,Koch CM,Clelland GK,Respuela-Alonso P,Wilcox S,Dovey OM,Ellis PD,Langford CF,Dunham I,Komorowski J,Wadelius C.Butyrate mediates decrease of histone acetylation centered on transcription start sites and down-regulation of associated genes.
2007;17:708-719 [PMID:17567991 DOI:10.1101/gr.5540007]
51 Donohoe DR,Collins LB,Wali A,Bigler R,Sun W,Bultman SJ.The Warburg effect dictates the mechanism of butyrate-mediated histone acetylation and cell proliferation.
2012;48:612-626 [PMID:23063526 DOI:10.1016/j.molcel.2012.08.033]
52 Candido EP,Reeves R,Davie JR.Sodium butyrate inhibits histone deacetylation in cultured cells.
1978;14:105-113[PMID:667927 DOI:10.1016/0092-8674(78)90305-7]
53 Sealy L,Chalkley R.The effect of sodium butyrate on histone modification.
1978;14:115-121 [PMID:667928 DOI:10.1016/0092-8674(78)90306-9]
54 Le Poul E,Loison C,Struyf S,Springael JY,Lannoy V,Decobecq ME,Brezillon S,Dupriez V,Vassart G,Van Damme J,Parmentier M,Detheux M.Functional characterization of human receptors for short chain fatty acids and their role in polymorphonuclear cell activation.
2003;278:25481-25489 [PMID:12711604 DOI:10.1074/jbc.M301403200]
55 Felizardo RJF,de Almeida DC,Pereira RL,Watanabe IKM,Doimo NTS,Ribeiro WR,Cenedeze MA,Hiyane MI,Amano MT,Braga TT,Ferreira CM,Parmigiani RB,Andrade-Oliveira V,Volpini RA,Vinolo MAR,Mariño E,Robert R,Mackay CR,Camara NOS.Gut microbial metabolite butyrate protects against proteinuric kidney disease through epigenetic-and GPR109amediated mechanisms.
2019;33:11894-11908 [PMID:31366236 DOI:10.1096/fj.201901080R]
56 Kaye DM,Shihata WA,Jama HA,Tsyganov K,Ziemann M,Kiriazis H,Horlock D,Vijay A,Giam B,Vinh A,Johnson C,Fiedler A,Donner D,Snelson M,Coughlan MT,Phillips S,Du XJ,El-Osta A,Drummond G,Lambert GW,Spector TD,Valdes AM,Mackay CR,Marques FZ.Deficiency of Prebiotic Fiber and Insufficient Signaling Through Gut Metabolite-Sensing Receptors Leads to Cardiovascular Disease.
2020;141:1393-1403 [PMID:32093510 DOI:10.1161/CIRCULATIONAHA.119.043081]
57 Pluznick J.A novel SCFA receptor,the microbiota,and blood pressure regulation.
2014;5:202-207 [PMID:24429443 DOI:10.4161/gmic.27492]
58 Marques FZ,Nelson E,Chu PY,Horlock D,Fiedler A,Ziemann M,Tan JK,Kuruppu S,Rajapakse NW,El-Osta A,Mackay CR,Kaye DM.High-Fiber Diet and Acetate Supplementation Change the Gut Microbiota and Prevent the Development of Hypertension and Heart Failure in Hypertensive Mice.
2017;135:964-977 [PMID:27927713 DOI:10.1161/CIRCULATIONAHA.116.024545]
59 王璐璇,刘玥宏,朱继开,钟煜,李利生,徐敬东.短链脂肪酸在疾病治疗中的研究进展.世界华人消化杂志 2017;25:1179-1186[DOI:10.11569/wcjd.v25.i13.1179]
60 刘环环,李瑞青,苏凯奇,袁洁,李琪,冯晓东.短链脂肪酸对脑卒中的保护作用机制及其与脑卒中后认知障碍关系的研究进展.中国全科医学 2022;25:380-386

