早期食管病变内镜黏膜下剥离术后辅助治疗人群的预测模型
0 引言
食管癌(esophageal cancer,EC)是消化系统常见的恶性肿瘤
,其早期患者多无症状,有症状而就诊时已发展至中晚期
,因此早诊早治是目前提高食管癌生存率、降低死亡率的有效途径.随着消化内镜学的不断发展,近年来对T1期食管癌及其癌前病变行内镜下治疗已成为趋势,研究显示其5年生存率可达85%-95%
,且与外科手术疗效相当
,具有创伤小、痛苦少、恢复快的优势.因此,目前只要是早期无明显转移或浸润的食管癌患者均首选内镜治疗.ESD是内镜下黏膜切除(endoscopic mucosal resection,EMR)基础上逐渐发展起来的新技术,可以对较大的病灶实现整体切除并进行精确的组织学检查,优于EMR
.但ESD术后非治愈性切除、复发、转移等不良事件的发生仍然是不可避免的
.
近期指南表明,ESD术后非治愈性切除者,应进一步追加外科根治术或放化疗等辅助治疗,从而预防复发或转移的发生
.然而,在临床工作中也常发现对这类患者进行补救外科手术治疗后经病理学评估证实无局部残留或淋巴结转移证据.因此,目前对于未达到治愈性切除的患者,其诊疗管理尚存在较大争议,是否需要追加治疗以及选择适合辅助治疗的人群是临床医师面临的主要问题.而且,结合患者一般情况、术中表现及术后病理结果来预测术后是否应该追加辅助治疗必要性的研究较少.
针对教材本课时中几个定理的推理范式的欠缺,笔者建议在再版时为几个定理配上相应的图形语言与符号语言,使之与原有的文字语言或图形语言互相印证,如,在“平行判定法”之后,我们结合图4和图6添加:
故本研究对73例T1期食管癌及癌前病变患者的临床病理特征情况进行了回顾性分析,并长期随访这些患者,建立了ESD术后需要进行辅助治人群的选择的预测模型,给临床医师提供参考依据.
1 材料和方法
1.1 材料 回顾性分析本中心自2014-06/2021-10行食管ESD手术,术后经病理证实为T1期食管癌及癌前病变的患者.纳入标准:(1)术前经超声内镜、放大内镜、组织活检等初步判断为符合内镜下切除的绝对或相对适应症;(2)经CT或B超考虑为cN0;(3)患者资料完整.排除标准:(1)既往有明确的胃癌或食管癌病史;(2)合并其他恶性肿瘤;(3)有淋巴结转移或远处转移(流程图见图1).

所有纳入本研究的患者术前均详细告知其ESD和传统外科食管全切术两种方法的利弊及可能发生的潜在风险、远期并发症等,所有患者均为自愿选择ESD治疗并签署知情同意书.
收集内容包括患者一般资料、病灶特征、病理结果、随访情况等,患者经门诊或电话进行随访,门诊随访以复查内镜检查为主,电话随访内容包括患者术后一般情况、复查情况(是否复发、转移)、是否追加手术或放化疗等情况.随访截止时间到2021-10.
1.2.3 变量定义:肿瘤浸润深度:肿瘤局限于黏膜层者称为M期癌,浸润至黏膜下层未达固有肌层者称为SM期癌.内镜下分型:根据早期食管癌巴黎分型可分为3种类型,即0-Ⅰ型(隆起型)、0-Ⅱ型(平坦型)、0-Ⅲ型(凹陷型).0-Ⅱ型又可分为0-Ⅱa型(浅表隆起型)、0-Ⅱb型(完全平坦型)型和0-Ⅱc型(浅表凹陷型).整块切除:病灶在内镜下被整块切除并获得单块标本.完全切除/R0切除:内镜下切除标本的侧切缘和基底切缘均无肿瘤残留.治愈性切除:(1)属于R0切除;(2)黏膜内癌或黏膜下层浸润深度不超过200 μm(SM1)的黏膜下癌;(3)无脉管浸润;(4)组织学类型为高、中分化.当不满足上述四项中的任意一项即可定义为非治愈性切除.残留:术后6 mo以内在原切除部位及周围1 cm内黏膜发现肿瘤病灶.局部复发:手术6 mo以后在原切除部位及周围1 cm内黏膜发现肿瘤病灶.异时性癌:指EGC内镜治疗12 mo后,原发部位外的新发肿瘤.
1.2.2 组织病理学评估:病理医师将固定后的标本用1%-5%碘溶液染色,以显示黏膜表面不染色区域,明确病变范围.以2毫米间隔连续平行切片,进行脱水、浸蜡、石蜡包埋等制片处理,行常规HE染色,并对切除的标本进行准确的病理诊断.诊断内容包括标本大小、病变大小、组织学类型、浸润深度、切缘情况、脉管侵犯情况等.
1.2.1 ESD步骤:ESD术前所有患者均完善肠道准备,有条件者行全身麻醉.使用内镜(GIF-H260;日本Olympus公司)进行ESD,放大内镜、窄带成像等再一次明确病灶情况,用高频电刀(ERBE ICC-200;爱尔博电子医疗仪器公司)、氩气高频电刀(CV-2000Y;康威电子技术有限公司)等粘膜下标记并逐步剥离病灶.切除后的标本用细针固定,标记口侧或肛侧,10%福尔马林固定,送至病理检查.所有内镜检查及ESD手术均由经验丰富的内镜医师进行.
利用独立样本
检验、
检验、
检验或
检验等比较各组之间的差异,通过Logistic回归模型分析非治愈性切除及ESD术后需要追加手术或放化疗的危险因素,并通过列线图预测模型将适合辅助治疗人群进行可视化.采用一致性指数(C-index)、受试者工作特征曲线(receiver operating characteristic curve,ROC)及其曲线下面积(area under the curve,AUC)、校准曲线和Hosmer and Lemeshow检验等对该模型进行内部验证并评价模型预测能力,用临床决策曲线评价该模型的临床实用性.所有检验结果
<0.05即定义为有统计学意义.所有的统计分析均使用了26.0版SPSS(SPSSInc.,Chicago,IL,USA)和R语言(R version 4.1.2 for windows)完成.
同样利用图1实验平台,还测试了薄膜对出射功率为8.4 W的CO2连续激光的透过率和反射率随辐照时间的变化情况.发现薄膜对10.6 μm远红外连续激光的透过率接近于0,在受辐照的60 s内几乎保持不透,而反射率则会有一定幅度变化,结果如图9所示.
2 结果
T1期食管癌及癌前病变患者在ESD术后仍然具有一定的复发、转移等风险,可能需要进一步追加外科根治性手术或放化疗等辅助治疗,从而减少不良事件的发生,降低肿瘤进展及死亡率.然而,临床上不能仅靠ESD术后病理结果为非治愈性切除而决定下一步治疗方案,而是应结合患者术前情况、内镜下表现及术后病理结果等综合评估需要辅助治疗的必要性.
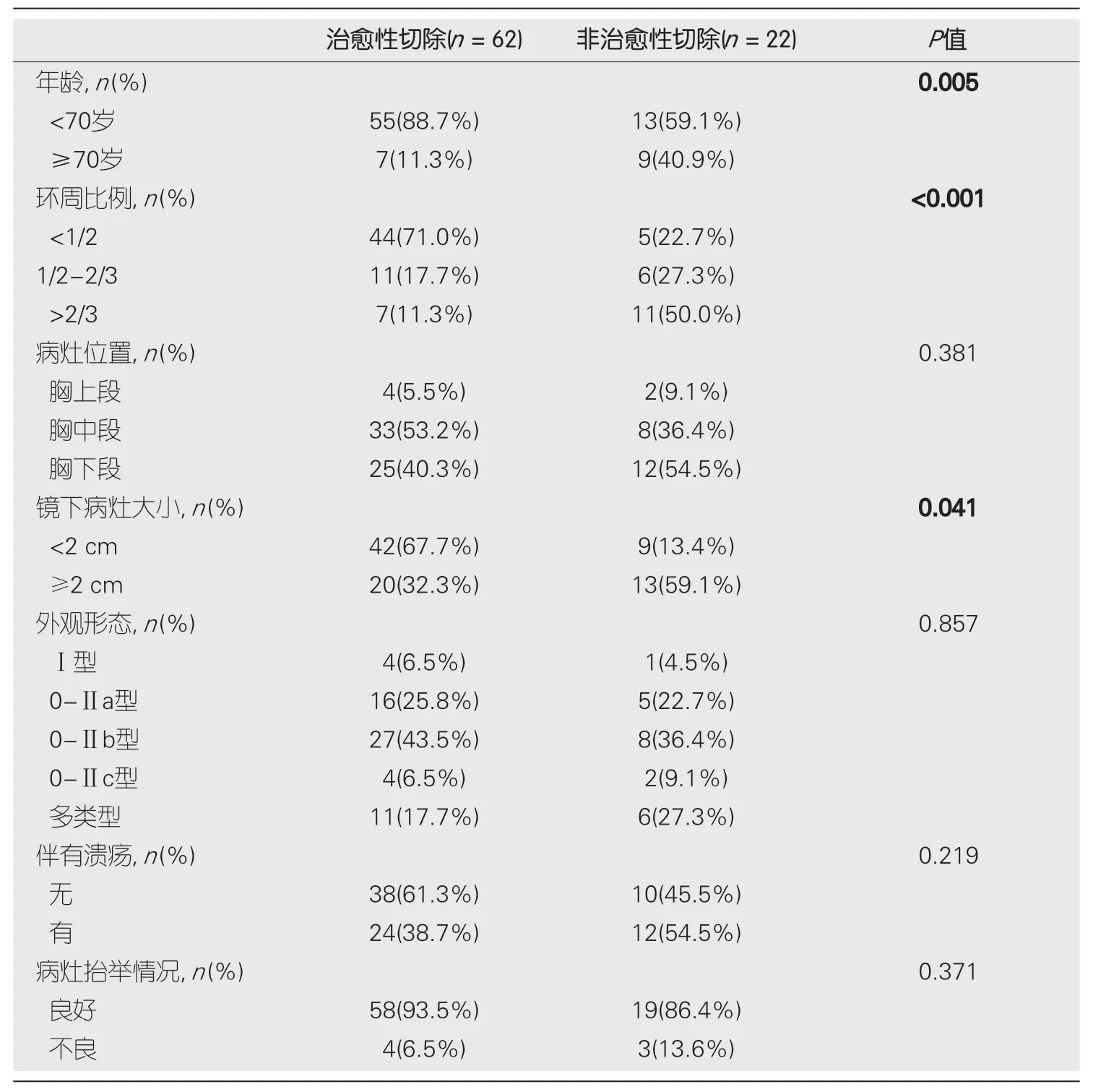
2.2 治愈性和非治愈性切除 将84个病灶分为治愈性切除组(
=62)和非治愈性切除组(
=22),对两组在ESD术前病人情况及ESD术中镜下病灶特征方面进行比较,并将有统计学意义的因素纳入二元Logistic回归模型中(表1).首先,单因素Logistic回归结果显示,年龄≥70岁、环周比例1/2-2/3、病灶大小≥2 cm与非治愈性切除相关(
<0.05),其中,病灶环周比例>2/3具有显著相关性(
<0.01).将上述影响因素纳入多元Logistic回归分析后显示,病灶环周比例>2/3食管管壁是T1期食管癌及癌前病变ESD术后非治愈性切除的独立危险因素(表2).
Endoscopy:the chronic gastritis is divided into two types under endoscopy,superficial gastritis,and atrophic gastritis with erosion,bile reflux,and bleeding if signs,such as the diagnosis of superficial gastritis or atrophic gastritis with erosion,bile reflux,etc.
2.3 追加手术或放化疗
2.3.1 追加辅助治疗的情况及原因:对所有纳入研究的患者进行长期随访,中位随访时间39 mo,最长随访时间86 mo.病灶残留率8/73(10.9%),局部复发率3/73(4.1%),远处脏器转移率2/73(2.7%),死亡率4/73(5.5%).12例(16.4%)于ESD术后追加手术或放疗,5例追加外科手术,7例追加放疗,具体追加治疗原因及情况见表3.追加组和未追加组死亡率(16.7%
3.3%,
=0.124)之间无统计学差异.

21例非治愈性切除患者有10例追加治疗,而52例治愈性切除者中有2例追加补救治疗,即治愈性和非治愈性切除患者中均有进一步手术或放化疗者.
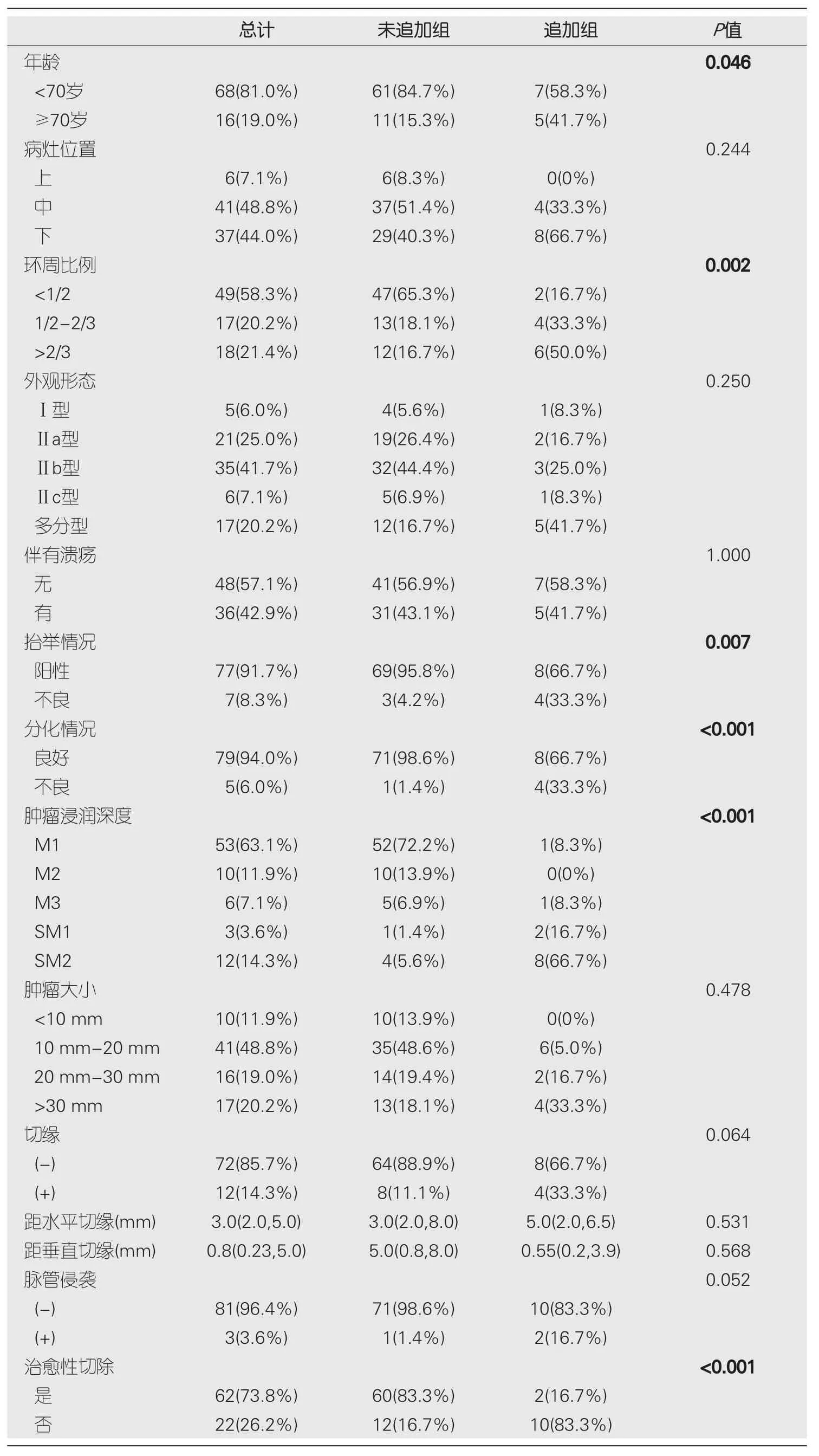
2.3.2 追加和未追加组之间的比较:本研究进一步将追加(
=12)和未追加手术或放化疗组(
=72)的病灶情况进行了比较,发现两组在年龄、环周比例、病灶抬举情况、肿瘤分化、肿瘤浸润深度等方面具有统计学差异(
<0.05),其中肿瘤分化情况以及肿瘤浸润深度具有显著相关性(
<0.01),表4.
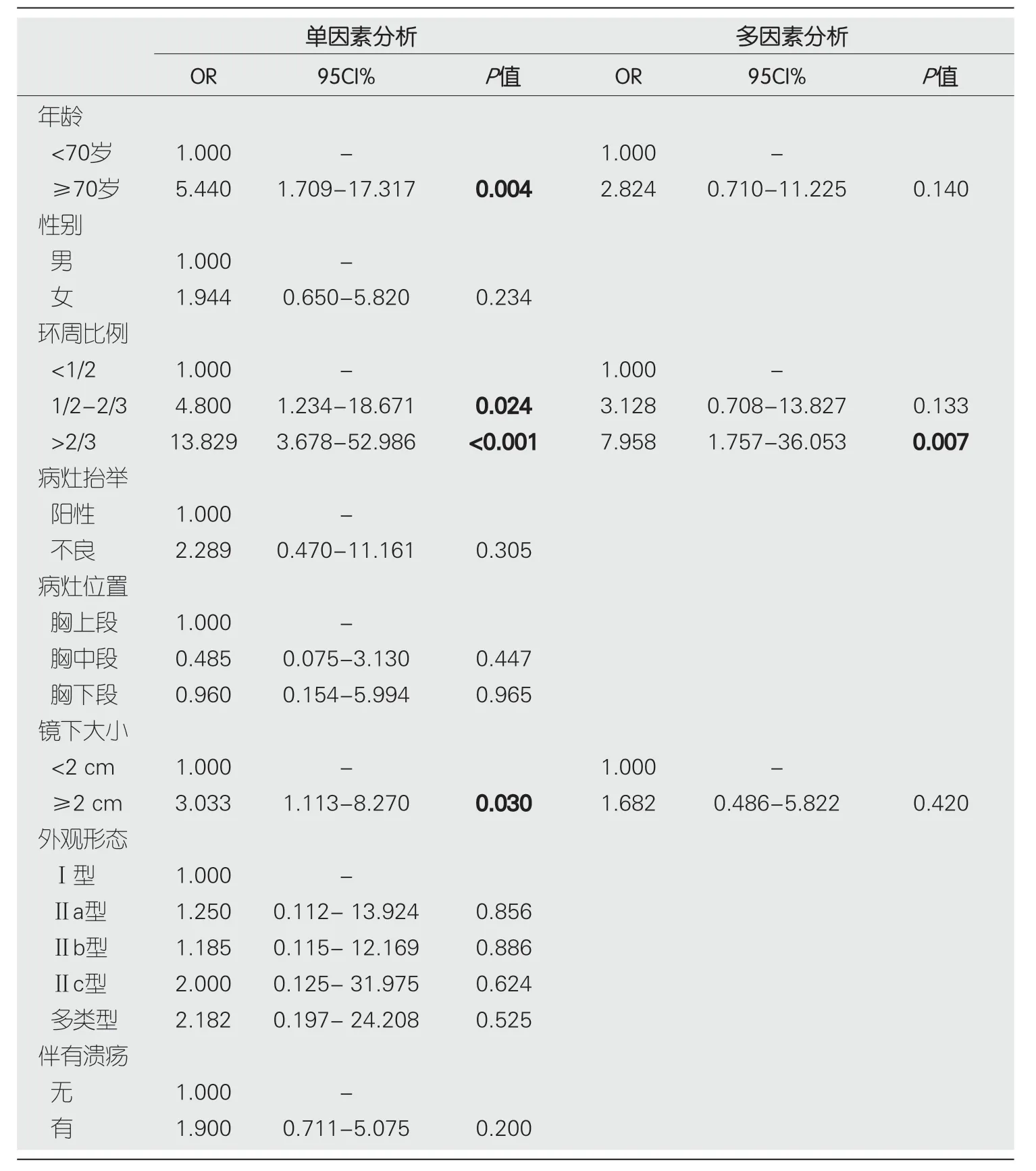
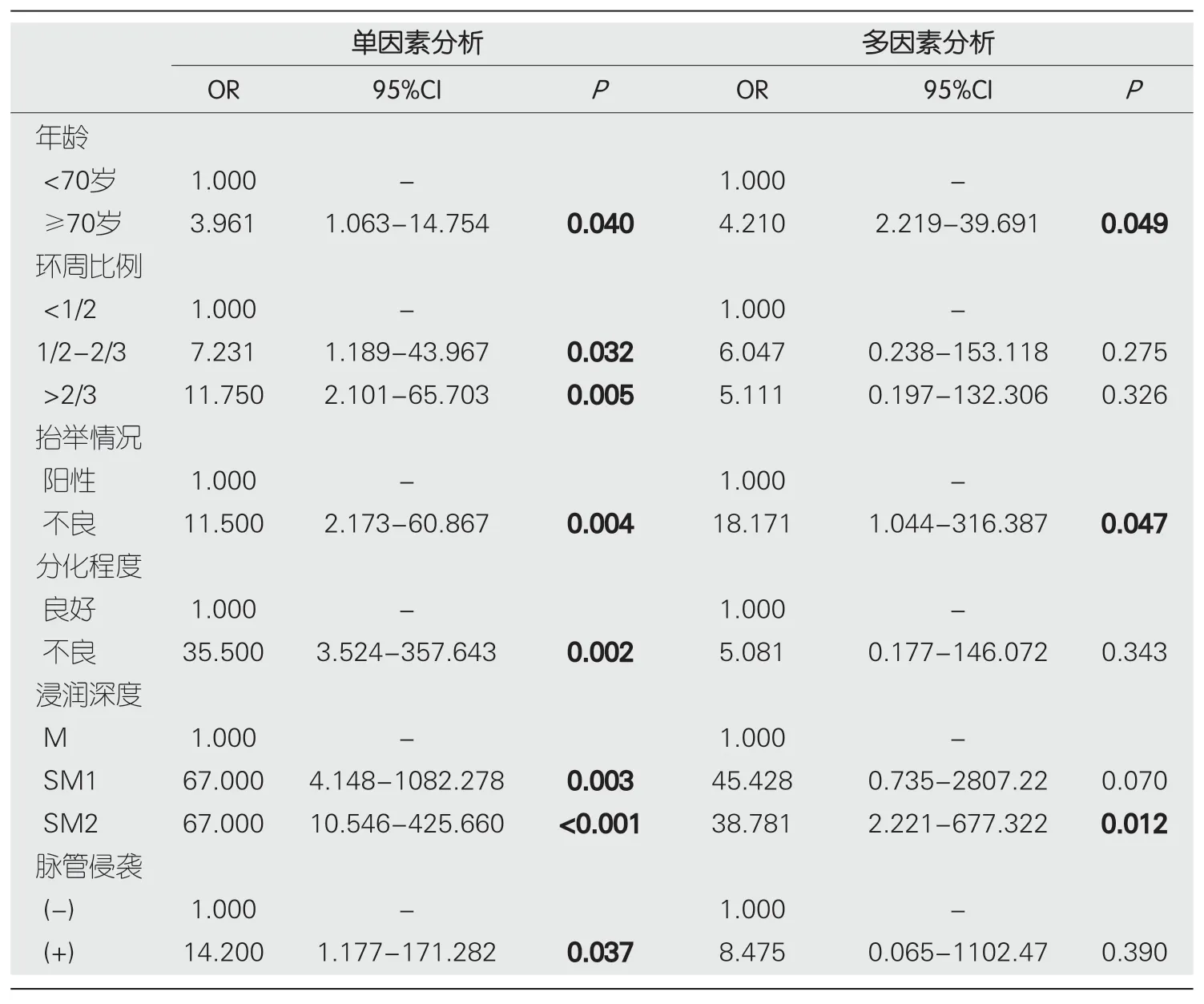
2.3.3 追加辅助治疗的危险因素分析:单因素Logistic分析结果显示,肿瘤浸润深度达SM2层与ESD术后需要进一步手术或放化疗显著相关(
<0.001),除此之外,年龄≥70岁、环周比例>1/2、病灶抬举不良、肿瘤分化不良、脉管侵袭阳性、肿瘤浸润至SM层与ESD术后需要进一步手术或放化疗相关(
<0.05).而多因素Logistic回归分析结果显示,患者年龄≥70岁、术中病灶抬举不良、肿瘤浸润深度达SM2层是T1期食管癌及癌前病变ESD术后需要进一步追加辅助治疗的独立危险因素,表5.
2.3.4 列线图预测模型的建立:本研究用上述多因素Logistic回归分析后
<0.05的变量(包括年龄、术中病灶抬举情况、肿瘤浸润深度)建立列线图模型(图2).模型中每个变量的不同指标分别对应相应的得分,比如:一个患者年龄在70岁以上为18分,ESD术中发现该患者病灶抬举不良为72分、术后病理结果示浸润深度达SM2层为100分,则总分为190分,说明该患者有90%以上的可能性需要在ESD术后进一步辅助治疗,否则可能会导致复发、转移等不良事件发生率的增加.

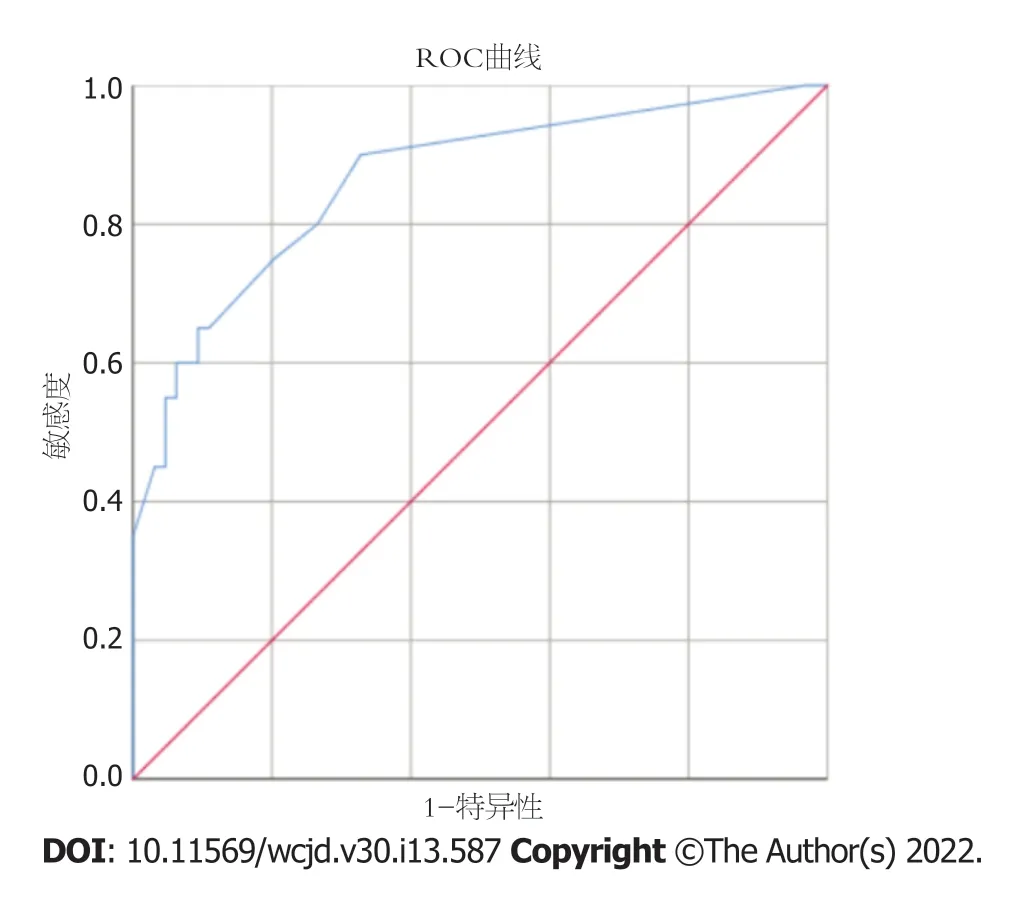
2.3.5 预测模型的内部验证及评价:该模型的一致性指数为0.923(95%CI:0.822-1.000),ROC曲线(图3)的AUC为0.864(95%CI:0.766-0.962),特异度和灵敏度分别为95.8%和75.0%,说明该模型具有良好的区分度.Hosmer and Lemeshow检验(
=1.5954,自由度=8,
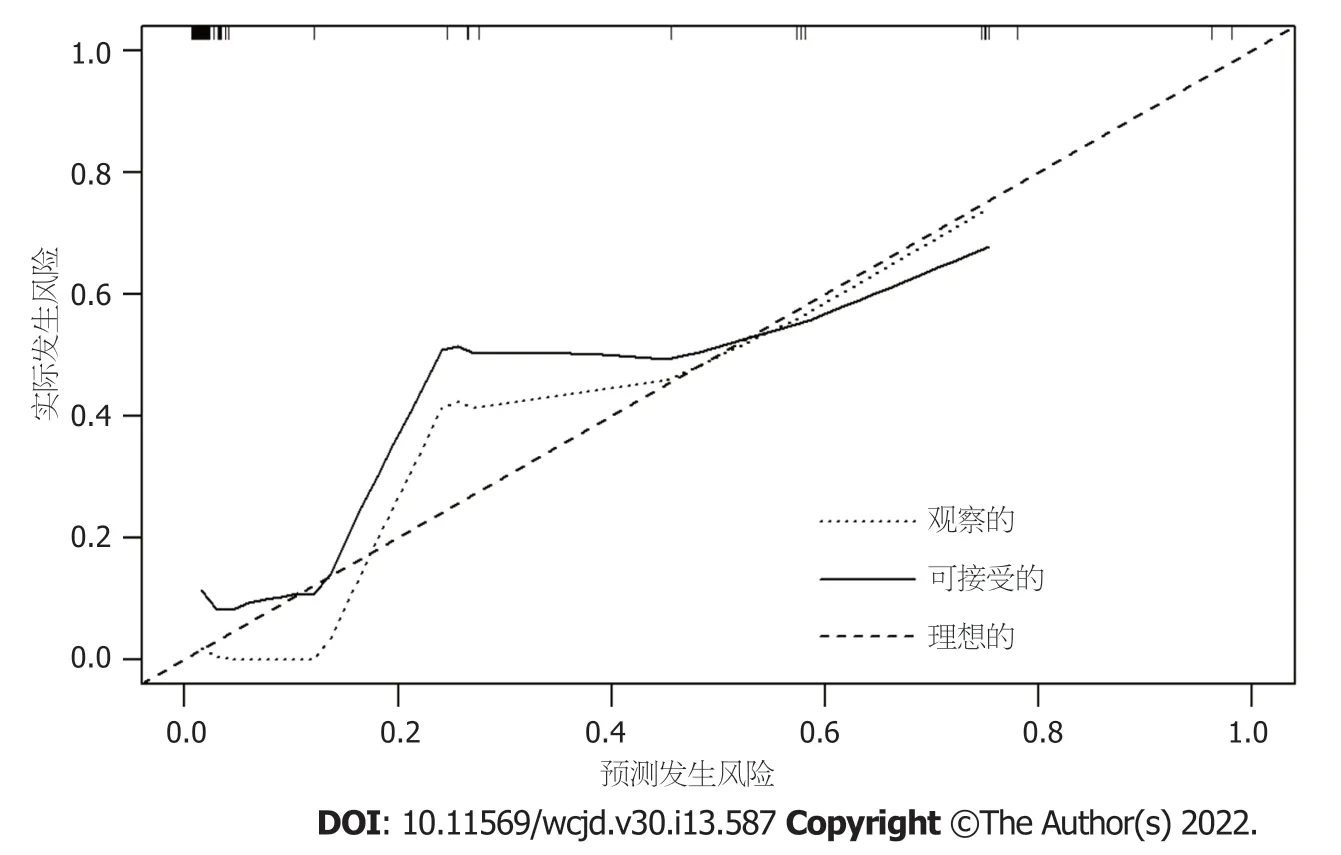
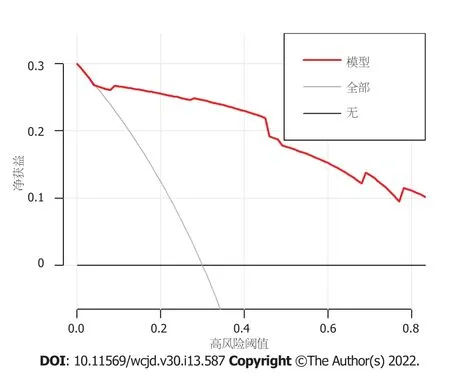
=0.991)表示该模型具有良好的拟合度.模型校准曲线(图4)显示与离线曲线拟合度尚可,说明模型具有一定的预测价值.决策曲线(图5)显示该模型具有良好临床实用性.
3 讨论
自古以来,传播在信息传递和交流中创造与维系着社会的发展。传播技术的改变,推动着人类社会的发展,改变着人类缔造的文化世界,改变着个体与社会的精神生活方式。从面对面的口头传播,到印刷的书写传播,再到高科技的电子传播,承载不同传播技术的各种媒体,赋予传播对象不同的权力,对社会伦理变革与个体的道德生活产生着不同的影响。随着信息技术的迅猛发展,新媒体日益凸显出强大的伦理变革功能,成为社会生活领域中全新的权力来源,新媒体赋权塑造了全新的社会生活状态,并影响着传统的伦理世界,具有深刻的伦理意义。
首先,在本研究中病灶的完整切除率为72/84(85.7%),整块切除率为84/84(100%),治愈性切除率为62/84(73.8%).而根据国内外报道,其完整切除率、整块切除率、治愈性切除率分别为96.35%
84.5%、98.96%
96.7%,92.45%
76.20%
,本中心的疗效与国内有所差别,可能是因为本研究样本量少、技术发展情况等相关.
本研究中发现22个非治愈性病灶中有12个切缘阳性、3个脉管侵袭阳性、5个肿瘤分化不良、11个浸润深度至SM2层,与治愈性切除组相比均具有统计学差异(
<0.05).这与以前的研究结果类似
,他们的结果均提示这四项与非治愈性切除明显相关.而本研究主要基于是否能内镜下即判断该患者的治愈性/非治愈性结果,于是将术中病灶情况纳入回归分析后发现,患者年龄>70岁、环周比例>1/2、镜下病灶大小>2 cm与非治愈性切除相关,而环周比例>2/3是独立危险因素.首先,纳入本研究的患者中年龄>70岁者占19%,有高龄化趋势,然而也不除外由选择偏倚引起的
,因为年龄较大的患者手术风险较高,更倾向于选择内镜下治疗.其次,研究表明非治愈性切除的可能性随着肿瘤大小的增加而增加
,这与本研究的结果类似,可能是因为肿瘤越大、手术剥离难度越大.最后,本研究认为病灶实际环周比例可能比内镜医师判断的环周比例更大,标记及切除范围过小,导致病灶残留.因此建议ESD前应充分利用色素内镜、NBI、FICE、EUS等明确及准确标记病变范围,提高治愈性切除率.
目前比较流行的MSR Daily 3D、MSR Action 3D和MSRC-12数据集运动帧数较少,不满足某些模型训练需要的数据多样性,数据集中行为帧的数量不等,不利于观察运动历史图像的动作变化细节[12]。所以本文花费了大量时间自建行为数据集,并用该数据集完成实验。
既往有研究指出,表浅性食管癌在ESD术后发现切缘阳性、肿瘤大小较大、浸润深度较深,会导致非治愈性切除,这时就需要接受外科手术或放化疗等辅助治疗
.然而在本研究中,21例非治愈性切除者中,最终追加治疗的只有10例,11例未追加者在后续随访中也未发现复发或转移,52例治愈性切除者中却有2例因复发和转移等原因而追加治疗.因此,结合本研究结果认为治愈性切除者也存在复发、或转移的风险,判断ESD术后是否需要进一步治疗不能仅靠ESD术后为非治愈性切除而决定.
于是本研究抛开治愈或非治愈因素,对ESD术后追加和未追加治疗的患者进行了分析,发现73例中有8例残留、3例局部复发、2例远处转移,其中12例追加了辅助治疗,5例追加外科手术,7例追加放疗.我们进一步分析需要追加辅助治疗的危险因素,发现年龄≥70岁、环周比例>1/2、病灶抬举不良、肿瘤分化不良、脉管侵袭阳性、肿瘤浸润深度达SM2层等与ESD术后需要追加辅助治疗相关,其中,肿瘤浸润至SM2层具有显著相关性(
<0.01).而多因素分析发现,年龄≥70岁、术中病灶抬举不良、肿瘤浸润深度达SM2层是独立危险因素.认为该结果的原因可能有几种,(1)Qi等人
指出在中国≥60岁者往往拒绝辅助治疗,因为其副作用会使人衰弱,然而Yamashina等
指出年龄是影响ESD术后生存率的独立危险因素.本中心认为,虽然大龄患者追加外科手术或放化疗的副作用大,但是未追加者生存率可能更低;(2)由于在行ESD前,都会常规行内镜+活检以判断肿瘤的性质,然而先前的这种操作会导致粘膜下组织发生纤维化、粘连等,导致ESD时病灶抬举不充分,甚至导致切除不干净;(3)已有大量研究表明肿瘤浸润深度与ESD术后的生存、复发及转移等密切相关
,这与我们的结果类似.因此,本研究认为,病理结果发现肿瘤浸润至SM2层时需要追加辅助治疗.
在既往研究中已有学者表明内镜治疗后放化疗辅助是早期食管癌的一种替代治疗选择
,而且与外科手术有相当的总体生存率
.内镜下可切除主要的病变并确定浸润深度,而放化疗可通过对有肿瘤浸润风险的区域淋巴结、阳性切缘或深部病变进行局部控制,从而提高生存率
.在我们的研究中,有7例行放疗治疗,由于随访时间较短,我们没能得到放疗后长期治疗的效果,后续我们将进行大中心、长期随访的研究来证实ESD术后放化疗的疗效.
本研究存在一定的局限性值得讨论.首先,这是一项单中心、样本量少的回顾性研究,研究设计可能存在选择和信息偏差,而且有几名患者因失访或资料缺失而被排除,最终纳入研究的患者数量比较少,导致我们的统计学结果中OR值及95%CI等较大.其次,部分患者于外院行内镜复查以及辅助治疗,电话随访其复查及辅助治疗的结果可能导致了纳入资料的准确性受到一定的影响.最后,由于研究的局限性,我们的模型的结果应谨慎解释.
2017年企业研发投入的参数β1=-1.55,即在其他条件不变的情况下,研发费用每增加1万元,主营业务利润减少1.55万元。P值为0.692,在10%的显著性水平下,表明2017年的企业研发投入对于2017年的主营业务利润无显著影响。
4 结论
2.1 患者及病灶基线特征 最终将73例患者、84个病灶(65例是单个病灶、5例为2个病灶、3例为3个病灶)纳入本研究中,其中男性54例(74%)、女性19例(26%),平均年龄64.55±7.913,病灶整块切除率为84/84(100%),R0切除率为72/84(85.7%),治愈性切除率为62/84(73.8%),手术总时长65.0(42,103) min.病理结果示癌前病变62例(74.7%),T1期鳞癌20例(24.1%),腺癌1例(1.2%),分化差者5例(6.0%),肿瘤局限在粘膜层者69例(82.1%),浸润至粘膜下层者15例(17.9%),切缘阳性12例(14.3%),脉管侵袭阳性3例(3.6%).
山路环绕,河水蜿蜒。“中国芒果之乡”百色市西郊38公里处,就是广西农垦国有阳圩农场。这里地处南亚热带季风区域,气候温和,雨量充沛,土壤肥沃,拥有芒果种植不可多得的自然环境。
1.2 方法
食管癌是全球范围内死亡率较高的消化道癌症之一
,治疗效果差
,早诊早治是目前提高食管癌治疗效果的最有效途径.在过去,根治性切除术伴淋巴结清扫一直是治疗早期食管肿瘤的金标准,然而它与术后较高的死亡率相关
.而近年来对于T1期食管癌及其癌前病变行内镜下治疗已经成为趋势,根据研究报道显示其5年生存率与外科手术相当
,而且具有保留正常的消化道结构、创伤小、恢复快、花费低、住院时间短、易于被人们接受等优点.其中,EMR和ESD的应用最广泛,ESD又优于EMR,因为ESD可以对较大的病灶实现整体切除
,从而获得包括肿瘤浸润深度、分化程度和是否有淋巴管或血管浸润在内的病理信息.因此,目前对于较大的病灶,只要无ESD相对或绝对禁忌症,均可行ESD治疗.然而,其术后非治愈性切除、复发、转移等不良事件的发生仍然是不可避免的
.最近的指南表明,ESD术后为非治愈性切除的患者,需要进一步追加外科手术或放化疗,从而预防复发、转移的发生
.然而,结合患者情况、镜下病灶情况及术后病理结果来预测追加治疗必要性的研究较少,因此我们开展了这项研究.
优点:优秀的显示效果及操控布局,配备光学防抖系统的等效28-140mm镜头。缺点:较为一般的画质表现。
食管癌是死亡率较高的一种消化系统肿瘤,早诊早治可提高患者生存率.目前对于T1期食管癌及癌前病变且无远处或淋巴结转移的患者均可首选内镜粘膜下剥离术(endoscopic submucosal dissection,ESD)治疗,然而多项研究表明ESD后可能会发生非治愈性切除、复发或转移,而是否需要追加辅助治疗以及选择辅助治疗人群的研究较少.
拜读了余小芬老师发表在《中学数学杂志》(初中版)2018年第8期上《研究中考试题的几个视角》一文后深受启发,特别对研究中考试题应从“立意”“背景”“解法”“变式”和“评价”五个角度切入的观点倍加欣赏.不过,笔者在实践中觉得中考试题研究还有一个不可或缺的视角——教学功能的开发与研讨.下面本人不揣浅陋,以近两年部分省市中考题为例,从“如何转化”和“如何类化”两个角度,略谈挖掘中考试题教学功能的肤浅做法,以求抛砖引玉.
媒介即信息,是麦克卢汉关于新闻传播方面的名言。社会化媒体的不断发展,人人都具备一款具有摄影功能的手机,当新闻事件发生时,或平时的日常生活中,拿出手机拍摄记录一些画面,并将照片或视频发布到社会化媒体上,这种社会化媒体的日益普及和成熟,为照片或视频的传播提供了良好的基础,并能够借助社会化媒体实现N次传播。
不同种类的蝙蝠,鼻叶的大小和形状也各不相同。蝙蝠家族中有一些十分与众不同的成员,它们的鼻叶很长,长到几乎与它们的耳朵一般大小。这就是剑鼻蝠。
探讨T1期食管癌及癌前病变患者ESD术后需要追加辅助治疗的危险因素,并分析治愈性切除对追加辅助治疗的影响,为选择适合辅助治疗人群提供思路.
建立ESD术后适合辅助治人群的选择的预测模型,给临床医师提供参考依据.
通过回顾性分析非治愈性切除及ESD术后需要追加手术或放化疗的危险因素,建立列线图预测模型将适合辅助治疗人群进行可视化,并对该模型进行内部验证、评价模型预测能力以及临床实用性.
早期食管病变ESD术后不论是否为治愈性切除均可能需要追加辅助治疗,患者年龄较大、术中病灶抬举不良、肿瘤浸润至SM2层等可增加需要辅助治疗的概率.
本研究结果与既往指南有所差异,比如指南建议T1期食管病变ESD术后为非治愈性切除者,则需追加外科手术或放化疗来预防复发转移,而本研究发现不论是否为治愈性切除均可能需要追加治疗.因此临床上应结合患者情况、镜下表现及术后病理等综合评估追加治疗的必要性,对于不同的早期食管病变患者,应个体化识别其高危因素并指导治疗进一步方案.
目前对早期食管病变ESD术后追加治疗必要性的研究较少,需进一步多中心大样本的临床研究进一步论证,从而在临床上更快更准确的识别适合辅助治疗的人群,使患者获益.
1 Sung H,Ferlay J,Siegel RL,Laversanne M,Soerjomataram I,Jemal A,Bray F.Global Cancer Statistics 2020:GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.
2021;71:209-249 [PMID:33538338 DOI:10.3322/caac.21660]
2 Smyth EC,Lagergren J,Fitzgerald RC,Lordick F,Shah MA,Lagergren P,Cunningham D.Oesophageal cancer.
2017;3:17048 [PMID:28748917 DOI:10.1038/nrdp.2017.48]
3 Nishizawa T,Suzuki H.Long-Term Outcomes of Endoscopic Submucosal Dissection for Superficial Esophageal Squamous Cell Carcinoma.
2020;12 [PMID:33023117 DOI:10.3390/cancers12102849]
4 Nagami Y,Ominami M,Shiba M,Minamino H,Fukunaga S,Kameda N,Sugimori S,Machida H,Tanigawa T,Yamagami H,Watanabe T,Tominaga K,Fujiwara Y,Arakawa T.The fiveyear survival rate after endoscopic submucosal dissection for superficial esophageal squamous cell neoplasia.
2017;49:427-433 [PMID:28096057 DOI:10.1016/j.dld.2016.12.009]
5 Min YW,Lee H,Song BG,Min BH,Kim HK,Choi YS,Lee JH,Hwang NY,Carriere KC,Rhee PL,Kim JJ,Zo JI,Shim YM.Comparison of endoscopic submucosal dissection and surgery for superficial esophageal squamous cell carcinoma:a propensity score-matched analysis.
2018;88:624-633[PMID:29750981 DOI:10.1016/j.gie.2018.04.2360]
6 Yamauchi K,Iwamuro M,Nakagawa M,Takenaka R,Matsueda K,Inaba T,Yoshioka M,Toyokawa T,Tanaka S,Kanzaki H,Kawano S,Kawahara Y,Shirakawa Y,Okada H;Okayama Gut Study Group.Long-term outcomes of endoscopic versus surgical resection for MM-SM1 esophageal squamous cell carcinoma using propensity score analysis.
2021;18:72-80 [PMID:32876825 DOI:10.1007/s10388-020-00775-0]
7 Yang D,Othman M,Draganov PV.Endoscopic Mucosal Resection vs Endoscopic Submucosal Dissection For Barrett’s Esophagus and Colorectal Neoplasia.
2019;17:1019-1028 [PMID:30267866 DOI:10.1016/j.cgh.2018.09.030]
8 Berger A,Rahmi G,Perrod G,Pioche M,Canard JM,Cesbron-Métivier E,Boursier J,Samaha E,Vienne A,Lépilliez V,Cellier C.Long-term follow-up after endoscopic resection for superficial esophageal squamous cell carcinoma:a multicenter Western study.
2019;51:298-306 [PMID:30261535 DOI:10.1055/a-0732-5317]
9 Kawashima K,Abe S,Koga M,Nonaka S,Suzuki H,Yoshinaga S,Oda I,Hikichi T,Ohira H,Saito Y.Optimal selection of endoscopic resection in patients with esophageal squamous cell carcinoma:endoscopic mucosal resection versus endoscopic submucosal dissection according to lesion size.
2021;34 [PMID:32959874 DOI:10.1093/dote/doaa096]
10 Joseph A,Draganov P,Maluf-Filho F,Aihara H,Fukami N,Sharma NR,Chak A,Yang D,Jawaid S,Dumot J,Alaber O,Chua T,Singh R,Mejia-Perez LK,Lyu R,Zhang X,Kamath S,Jang S,Murthy S,Vargo J,Bhatt A.Outcomes for endoscopic submucosal dissection of pathologically staged T1b esophageal cancer:a multicenter study.
2022 [PMID:35217020 DOI:10.1016/j.gie.2022.02.018]
11 中国食管鳞癌癌前状态及癌前病变诊治策略专家共识.中华消化内镜杂志 2020;37:853-867
12 di Pietro M,Canto MI,Fitzgerald RC.Endoscopic Management of Early Adenocarcinoma and Squamous Cell Carcinoma of the Esophagus:Screening,Diagnosis,and Therapy.
2018;154:421-436 [PMID:28778650 DOI:10.1053/j.gastro.2017.07.041]
13 Levy A,Wagner AD,Chargari C,Moehler M,Verheij M,Durand-Labrunie J,Kissel M,Chirat E,Burtin P,Ducreux M,Boige V,Nilsson M,Boku N,Chau I,Deutsch E.Palliation of dysphagia in metastatic oesogastric cancers:An international multidisciplinary position.
2020;135:103-112 [PMID:32563014 DOI:10.1016/j.ejca.2020.04.032]
14 Saddoughi SA,Reinersman JM,Zhukov YO,Taswell J,Mara K,Harmsen SW,Blackmon SH,Cassivi SD,Nichols F 3rd,Shen KR,Wigle DA,Allen MS.Survival After Surgical Resection of Stage IV Esophageal Cancer.
2017;103:261-266 [PMID:27623270 DOI:10.1016/j.athoracsur.2016.06.070]
15 Boshier PR,Klevebro F,Savva KV,Waller A,Hage L,Hanna GB,Low DE.Assessment of Health Related Quality of Life and Digestive Symptoms in Long-term,Disease Free Survivors After Esophagectomy.
2022;275:e140-e147 [PMID:32068555 DOI:10.1097/SLA.0000000000003829]
16 Han C,Sun Y.Efficacy and safety of endoscopic submucosal dissection versus endoscopic mucosal resection for superficial esophageal carcinoma:a systematic review and meta-analysis.
2021;34 [PMID:32895709 DOI:10.1093/dote/doaa081]
17 Duan X,Shang X,Yue J,Ma Z,Chen C,Tang P,Jiang H,Yu Z.A nomogram to predict lymph node metastasis risk for early esophageal squamous cell carcinoma.
2021;21:431[PMID:33879102 DOI:10.1186/s12885-021-08077-z]
18 Liu Z,Zhang J,Su Y,Pan J,Yang Y,Huang B,Zhao J,Li Z.Additional Esophagectomy Following Noncurative Endoscopic Resection for Early Esophageal Squamous Cell Carcinoma:A Multicenter Retrospective Study.
2021;28:7149-7159 [PMID:34269944 DOI:10.1245/s10434-021-10467-3]
19 Probst A,Aust D,Märkl B,Anthuber M,Messmann H.Early esophageal cancer in Europe:endoscopic treatment by endoscopic submucosal dissection.
2015;47:113-121[PMID:25479563 DOI:10.1055/s-0034-1391086]
20 Jin XF,Chai TH,Gai W,Chen ZS,Guo JQ.Multiband Mucosectomy Versus Endoscopic Submucosal Dissection for Treatment of Squamous Intraepithelial Neoplasia of the Esophagus.
2016;14:948-955 [PMID:27108794 DOI:10.1016/j.cgh.2016.04.018]
21 Omae M,Fujisaki J,Horiuchi Y,Yoshizawa N,Matsuo Y,Kubota M,Suganuma T,Okada K,Ishiyama A,Hirasawa T,Yamamoto Y,Tsuchida T,Hoshino E,Igarashi M.Safety,efficacy,and longterm outcomes for endoscopic submucosal dissection of early esophagogastric junction cancer.
2013;16:147-154[PMID:22692465 DOI:10.1007/s10120-012-0162-5]
22 Libânio D,Pimentel-Nunes P,Afonso LP,Henrique R,Dinis-Ribeiro M.Long-Term Outcomes of Gastric Endoscopic Submucosal Dissection:Focus on Metachronous and Non-Curative Resection Management.
2017;24:31-39 [PMID:28868336 DOI:10.1159/000450874]
23 Wen J,Linghu E,Yang Y,Liu Q,Wang X,Du H,Wang H,Meng J,Lu Z.Relevant risk factors and prognostic impact of positive resection margins after endoscopic submucosal dissection of superficial esophageal squamous cell neoplasia.
2014;28:1653-1659 [PMID:24380990 DOI:10.1007/s00464-013-3366-9]
24 Pimentel-Nunes P,Dinis-Ribeiro M,Ponchon T,Repici A,Vieth M,De Ceglie A,Amato A,Berr F,Bhandari P,Bialek A,Conio M,Haringsma J,Langner C,Meisner S,Messmann H,Morino M,Neuhaus H,Piessevaux H,Rugge M,Saunders BP,Robaszkiewicz M,Seewald S,Kashin S,Dumonceau JM,Hassan C,Deprez PH.Endoscopic submucosal dissection:European Society of Gastrointestinal Endoscopy (ESGE) Guideline.
2015;47:829-854 [PMID:26317585 DOI:10.1055/s-0034-1392882]
25 Qi ZP,Chen T,Li B,Ren Z,Yao LQ,Shi Q,Cai SL,Zhong YS,Zhou PH.Endoscopic submucosal dissection for early esophageal cancer in elderly patients with relative indications for endoscopic treatment.
2018;50:839-845 [PMID:29548040 DOI:10.1055/a-0577-2560]
26 Yamashina T,Ishihara R,Nagai K,Matsuura N,Matsui F,Ito T,Fujii M,Yamamoto S,Hanaoka N,Takeuchi Y,Higashino K,Uedo N,Iishi H.Long-term outcome and metastatic risk after endoscopic resection of superficial esophageal squamous cell carcinoma.
2013;108:544-551 [PMID:23399555 DOI:10.1038/ajg.2013.8]
27 Hatta W,Koike T,Takahashi S,Shimada T,Hikichi T,Toya Y,Tanaka I,Onozato Y,Hamada K,Fukushi D,Watanabe K,Kayaba S,Ito H,Mikami T,Oikawa T,Takahashi Y,Kondo Y,Yoshimura T,Shiroki T,Nagino K,Hanabata N,Funakubo A,Hirasawa D,Ohira T,Nakamura J,Matsumoto T,Nakamura T,Nakaya N,Iijima K,Fukuda S,Masamune A;Tohoku GI Endoscopy Group.Risk of metastatic recurrence after endoscopic resection for esophageal squamous cell carcinoma invading into the muscularis mucosa or submucosa:a multicenter retrospective study.
2021;56:620-632 [PMID:33881632 DOI:10.1007/s00535-021-01787-y]
28 Kam TY,Kountouri M,Roth A,Frossard JL,Huber O,Mönig S,Zilli T.Endoscopic resection with adjuvant chemo-radiotherapy for superficial esophageal squamous cell carcinoma:A critical review.
2018;124:61-65 [PMID:29548487 DOI:10.1016/j.critrevonc.2018.02.011]
29 Wang CY,Chen BH,Lee CH,Le PH,Tsou YK,Lin CH.cT1N0M0 Esophageal Squamous Cell Carcinoma Invades the Muscularis Mucosa or Submucosa:Comparison of the
of Endoscopic Submucosal Dissection and Esophagectomy.
2022;14 [PMID:35053586 DOI:10.3390/cancers14020424]
30 Huang B,Xu MC,Pennathur A,Li Z,Liu Z,Wu Q,Wang J,Luo K,Bai J,Wei Z,Xiang J,Fang W,Zhang J.Endoscopic resection with adjuvant treatment versus esophagectomy for early-stage esophageal cancer.
2022;36:1868-1875 [PMID:33893544 DOI:10.1007/s00464-021-08466-2]
31 Yu S,Zhang W,Ni W,Xiao Z,Wang Q,Zhou Z,Feng Q,Zhang H,Chen D,Liang J,Lv J,Hui Z,He J,Gao S,Sun K,Fang D,Liu X,Li Y.A propensity-score matching analysis comparing longterm survival of surgery alone and postoperative treatment for patients in node positive or stage III esophageal squamous cell carcinoma after R0 esophagectomy.
2019;140:159-166 [PMID:31302346 DOI:10.1016/j.radonc.2019.06.020]
32 Ikeda A,Hoshi N,Yoshizaki T,Fujishima Y,Ishida T,Morita Y,Ejima Y,Toyonaga T,Kakechi Y,Yokosaki H,Azuma T.Endoscopic Submucosal Dissection (ESD) with Additional Therapy for Superficial Esophageal Cancer with Submucosal Invasion.
2015;54:2803-2813 [PMID:26567992 DOI:10.2169/internalmedicine.54.3591]
33 Kang J,Chang JY,Sun X,Men Y,Zeng H,Hui Z.Role of Postoperative Concurrent Chemoradiotherapy for Esophageal Carcinoma:A meta-analysis of 2165 Patients.
2018;9:584-593 [PMID:29483964 DOI:10.7150/jca.20940]

