脂质和聚合物载体作为mRNA递送系统的研究进展
朱慧玲,朱丹丹,陈旺,刘潇璇
(中国药科大学 天然药物活性组分与药效国家重点实验室 药物科学研究院高端药物制剂与材料研究中心,江苏 南京 210009)
信使核糖核酸(messenger ribonucleic acid,mRNA)是一类携带遗传信息的单链核糖核酸,可与核糖体结合进而指导细胞直接合成特定的蛋白质[1]。mRNA疗法则是通过一定的手段将外源的治疗性mRNA导入特定细胞内,以纠正或补偿相关基因的表达,从而达到预防或治疗感染性疾病、恶性肿瘤、遗传性疾病和罕见病等疾病的目的[1-5]。自从20世纪60年代mRNA被首次发现到新型冠状病毒肺炎(COVID-19)mRNA疫苗紧急获批上市,mRNA疗法已然成为当今生物医药领域最具潜力的研发方向之一(见图1),其被广泛应用于蛋白替代疗法、mRNA疫苗以及基因编辑等领域[1-2,6-7]。例如,治疗性mRNA可在病变细胞内特异性补偿缺失基因或突变的表达,编码靶细胞所需功能性蛋白,进而恢复细胞正常的功能,在蛋白质替代治疗中具有较好的应用潜力[1];mRNA疫苗则可编码某些特定的抗原或细胞因子,激活或加强特异性免疫,从而达到预防或治疗疾病的效果,如COVID-19 mRNA疫苗等[2];此外,mRNA在基因编辑领域如规律成簇的间隔短回文重复序列及其相关核酸酶9(clustered regularly interspaced short palindromic repeats-associated protein 9,CRISPR-Cas9)也有着广泛应用潜力,Cas9 mRNA可在细胞内瞬时表达Cas9蛋白,随后其在sgRNA指导下定点编辑特定的DNA片段,瞬时且高效地发挥强有力的基因编辑作用[8]。因此,mRNA疗法是一种极具开发潜力和临床应用前景的治疗手段。目前,已获批上市2款mRNA药物并有69种已经进入临床试验阶段。

图 1 mRNA技术发展历程Figure 1 Timeline of the development of mRNA-based technologies
理论上,mRNA具有编码任意蛋白的潜力,相较于DNA疗法和蛋白疗法,mRNA疗法在应用过程中具有独特的优势:1)mRNA发挥作用直接高效,无需入核即可在胞质中启动功能性蛋白质翻译;2)mRNA具有良好的安全性,几乎无基因组插入风险,瞬时表达所编码的功能性蛋白;3)mRNA合成简单快捷,可大规模生产且成本较低;4)可针对蛋白药物难以成药的靶点进行设计与开发[6]。然而,mRNA的稳定性差,极易被核酸酶降解[9],而且容易被免疫系统识别并清除;其次,mRNA是亲水性的大分子核酸(相对分子质量为0.3×106~5.0×106),富含阴离子基团,难以被靶细胞摄取发挥作用[9-10];此外,外源性mRNA可能会激活Toll样受体(toll-like receptors,TLR),诱导机体产生免疫反应(见图2)[11]。因此,迫切需要安全高效递送载体将mRNA输送至靶细胞,在细胞质中启动蛋白翻译过程,编码所需治疗性蛋白。
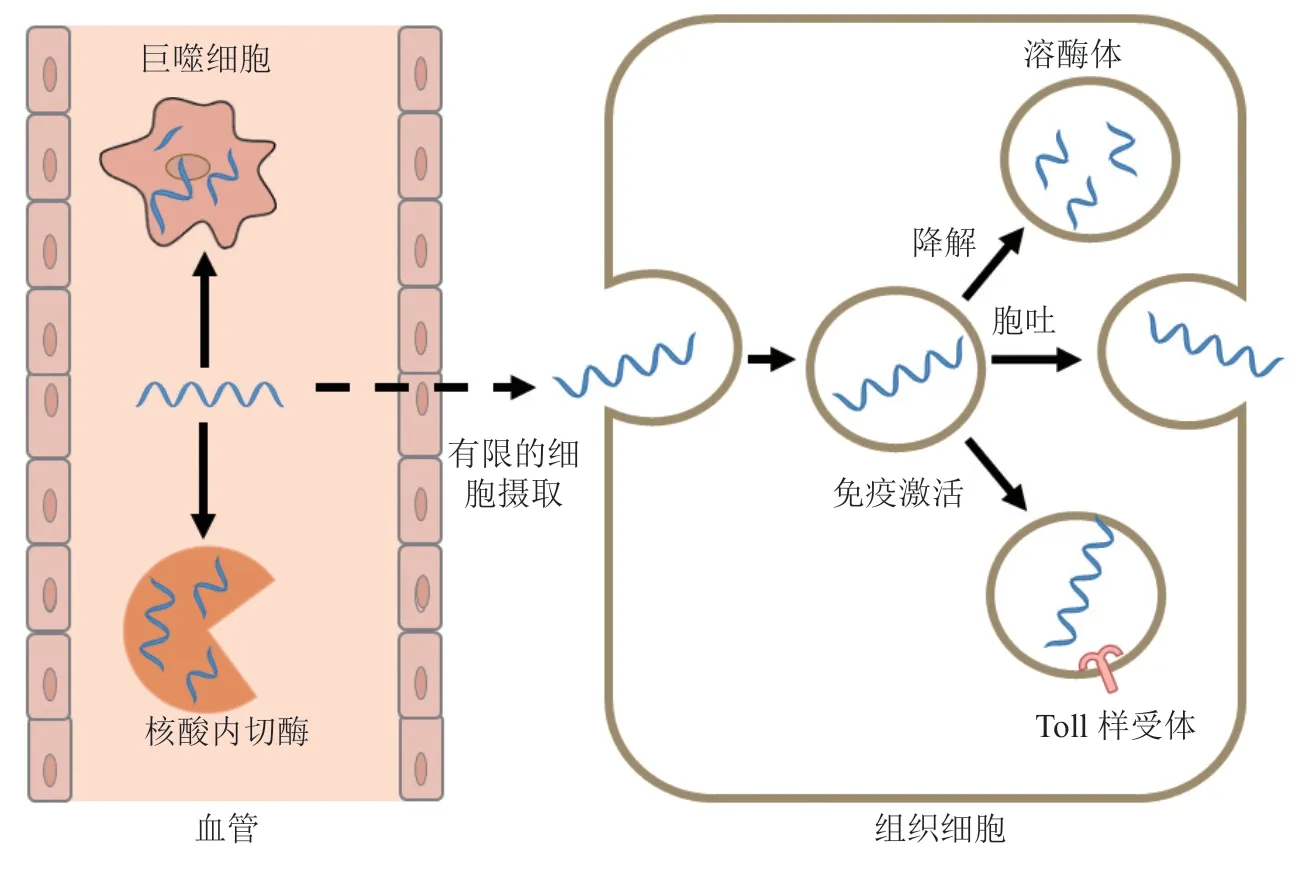
图 2 mRNA输送的细胞内外屏障Figure 2 The intracellular and extracellular barriers of mRNA delivery
1 mRNA递送载体概述
目前常用的mRNA递送载体主要分为病毒载体和非病毒载体[12]。病毒载体的mRNA递送效率较高,但是其mRNA荷载量有限且存在一定的安全隐患。相较而言,非病毒载体能有效负载mRNA并保护其不被降解,具有较高的核酸药物负载能力和较低的免疫原性,且适于规模化批量生产,被广泛用于mRNA递送的研究[13]。在众多开发的用于mRNA递送的非病毒载体中,脂质载体和聚合物是研究较深入和应用较广泛的载体(见图3)[12,14-15]。尤其是被美国FDA批准上市的2款针对COVID-19的mRNA疫苗(Comirnaty和Spikevax)都是基于脂质载体的药物制剂[14]。本综述将聚焦于脂质载体和聚合物在mRNA递送中的研究进展,探讨这些mRNA递送体系在应用过程中的挑战与发展前景,旨在为mRNA递送载体的开发和临床转化提供有价值的参考。

图 3 脂质和聚合物载体的mRNA递送过程示意图Figure 3 Lipid- and polymer-based vectors for mRNA delivery
2 脂质载体用于mRNA递送的研究
基于脂质载体的mRNA递送系统是目前临床上最成熟的mRNA输送技术之一,特别是脂质纳米颗粒(lipid nanoparticles,LNP)技术[14]。此类递送系统能高效负载mRNA,促进其被靶细胞摄取,且可通过膜扰动方式促进其负载mRNA快速从内涵体中逃逸,进而启动蛋白翻译过程(见图3)[16]。LNP所介导的mRNA递送系统通常是由mRNA、中性辅助脂质、胆固醇及其衍生物、聚乙二醇(polyethylene glycol,PEG)脂质和关键功能性脂质组成(见图4)[17]。中性辅助脂质一般为磷脂,对脂质递送系统的结构具有支撑和稳定的作用,可促进细胞摄取以提高mRNA递送效率。胆固醇及其衍生物具有疏水性和刚性,分布于脂质之间的间隙,可增强体系的流动性。PEG脂质主要位于纳米颗粒的表面,减少在体内与血浆蛋白的结合,提升体系的稳定性和延长血液循环时间[14,16]。关键功能性脂质是mRNA递送和转染效率的决定性因素,其由阳离子或可离子化头基、饱和或不饱和烷基长链和连接基团3部分组成。该类脂质的头基可通过静电相互作用与带负电的mRNA结合形成稳定的复合物,保护其免受酶降解;其疏水烷基长链约为8~18个碳,可增强关键功能性脂质与细胞膜的相互作用,促进其细胞摄取与内涵体逃逸;头基和烷基长链之间的连接基团可保持脂质结构的稳定性,还可引入生物可降解基团,以进一步促进mRNA释放[18-19]。本文将介绍3类常见的关键性功能脂质(阳离子脂质、可电离脂质和两性离子脂质)在mRNA递送中的应用,探讨不同类型头基、疏水烷基长链和连接基团的合理化设计与开发及其对脂质递送载体的mRNA递送效率的影响。
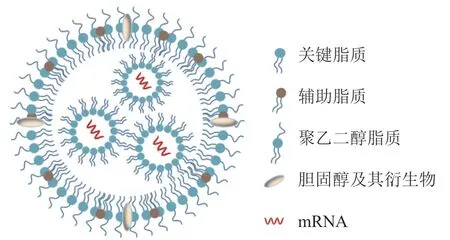
图 4 脂质纳米颗粒/mRNA复合物的示意图Figure 4 Schematic illustration of lipid nanoparticles/mRNA complexes
阳离子脂质是指头基中含有永久正电荷的阳离子基团(如氨基、季铵基团、胍基等)的功能性脂质,是应用最早的脂质载体。其中,1,2-双十八烯氧基-3-甲基铵丙烷(DOTMA,1)[20]和2,3-二油氧基丙基三甲基氯化铵(DOTAP,2)[21]是目前最常见的用于mRNA递送的阳离子脂质,例如商业化转染试剂Lipofectamine2000的关键脂质就是选用的DOTMA。为了进一步提高DOTMA的mRNA转染效率和安全性,研究人员在其连接基团中引入可降解的酯键得到DOTAP用于mRNA递送。Dhaliwal等[21]研究发现基于DOTAP的阳离子脂质体能将编码绿色荧光蛋白的mRNA(GFP mRNA)成功递送至小鼠巨噬细胞中,并表达绿色荧光蛋白。而且,该体系能将GFP mRNA成功输送至小鼠脑部并特异性表达靶蛋白,具有潜在治疗脑部相关疾病的优势。此外,基于DOTAP为关键脂质的LNP可以有效递送同时编码4种肿瘤相关抗原(tumor-associated antigen,TAA)的mRNA作为肿瘤疫苗,该系统已被用于治疗黑色素瘤的Ⅰ期临床试验中[22]。
研究人员针对病理微环境(如微酸环境、氧化还原环境等)的特征,充分利用敏感基团对阳离子脂质的疏水烷基长链进行改造。例如,Li等[23]将还原响应的二硫键作为功能性脂质的连接基团,同时将胆固醇作为疏水结构增强体系的流动性,设计并合成了生物可降解的还原型胆固醇基阳离子脂质组合文库Lipidoid(3)。结果发现,该系列脂质具有较好的安全性,可成功将编码Cre重组酶的mRNA(Cre mRNA)精准递送至Ai14转基因小鼠的骨骼肌、肺、脾和脑,表达Cre重组酶蛋白,对DNA位点进行特异性重组,发挥高效的基因编辑作用。利用类似的策略,Li等[24]将pH敏感的环苄叉缩醛(cyclic benzylidene acetal,CBA)基团引入到脂质分子的尾部结构中,设计并合成了pH响应可降解的脂质化合物组合文库。通过筛选发现,优选阳离子脂质R-O16CBA(4)所构建的mRNA递送系统,其在宫颈癌HeLa细胞的GFP mRNA转染活性与商业化转染试剂Lipofectamine2000相当。尽管阳离子脂质具有较高的转染效率,但是其存在潜在的毒性和免疫原性等问题。研究表明静脉注射阳离子脂质纳米颗粒可能会导致小鼠肝损伤并诱导强烈的干扰素-γ反应[25]。因此,研究人员为了改善阳离子脂质的安全性,进一步提升mRNA递送效率,开发了新一代关键功能性脂质——可电离脂质用于mRNA递送。

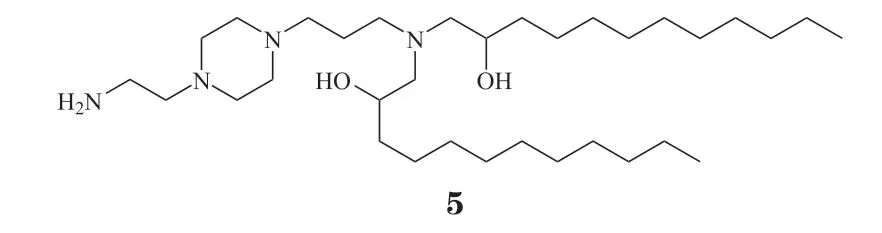
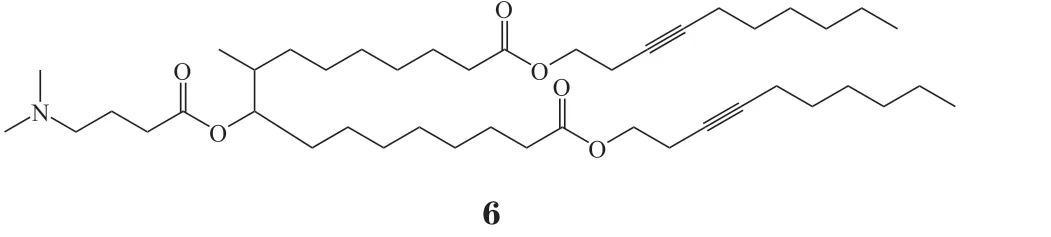
可电离脂质是由可电离头基、连接基团和疏水烷基长链组成。其可电离头基在生理条件(pH =7.4)下呈中性,可在一定程度上改善脂质载体的安全性[17,26];可电离头基在内涵体/溶酶体的酸性环境(pH≤5.0)下可发生质子化带正电荷,破坏内体细胞膜的稳定性,促进mRNA释放[12]。例如,Kim等[27]合成哌嗪类衍生物头基的可电离脂质246C10(5)用于肝组织靶向性递送mRNA,成功实现肝脏中基因特异性编辑。为了进一步提升可电离脂质的生物可降解性,研究人员在可电离脂质的连接基团中引入酯键,构建一系列可降解型可电离脂质。例如,Rurik等[28]开发的基于可降解可电离脂质的CD5特异性靶向的脂质纳米颗粒能成功将编码成纤维细胞激活蛋白的mRNA递送至小鼠体内的T细胞,并表达相关蛋白,实现在体内嵌合抗原受体T细胞免疫治疗(chimeric antigen receptor T-cell immunotherapy,CAR-T),有效清除异常活跃的成纤维细胞,缓解心脏纤维化。另一类基于肝靶向的生物可降解可电离脂质所构建的mRNA递送体系NTLA-2001能顺利将Cas mRNA和靶向识别血清转甲状腺素蛋白(recombinant transthyretin,TTR)DNA序列的单向 导RNA(single guide RNA,sgRNA)递送至肝脏病变细胞,治疗罕见遗传疾病转甲状腺素蛋白淀粉样变性(transthyretin amyloidosis,ATTR)[29]。值得一提的是,该递送体系Ⅰ期临床试验已取得优异的治疗效果,单剂给药即可有效降低血清中的TTR水平,这也是首个基于脂质纳米技术的体内CRISPR疗法,具有突破性重大意义。同样的,在可电离脂质的疏水结构引入可降解酯键,也能有效促进mRNA的释放,提升体系的安全性。例如,为了增强体系与细胞膜的相互作用,进一步促进负载mRNA药物的释放,Miao等[30]以Dlin-MC3-DMA为主体结构,在其疏水结构中引入酯键和炔基,构建了一类生物可降解的炔烃可电离脂质文库。其中,优选可电离脂质A6(6)所构建的mRNA递送体系能成功将编码荧光素酶的mRNA(Luciferase mRNA,Luc mRNA)递送至原代肝脏细胞,作用效果持久,mRNA转染活性远高于DLin-MC3-DMA的LNP。
除了上述两种关键脂质以外,两性离子脂质近年来也被广泛用于mRNA递送。两性离子脂质是指头基同时含有阳离子和阴离子基团,在生理条件下往往带负电或呈电中性,具有较好的血液稳定性[16]。例如,Siegwart团队基于选择性器官靶向的概念,设计并合成一系列在mRNA递送系统中颇具潜力的可电离两性磷脂[31-33]。研究人员通过调控可电离两性磷脂的结构,使得其所构建的mRNA递送系统可在体内吸附不同类型的血清蛋白,形成具有特异性的“蛋白冠”,成功将mRNA靶向递送至小鼠的肺、脾和肝。该策略为构建组织特异性的mRNA递送体系提供了新思路。
3 聚合物载体用于mRNA递送的研究
除脂质载体外,阳离子聚合物的结构设计灵活、可多功能化修饰、合成工艺简单,亦被广泛应用于mRNA递送,例如聚乙烯亚胺(polyethyleneimine,PEI)[34-35]、聚 氨 基 酸[36-38]、聚 酯[39-41]、聚 氨 酯[poly(amino ester),PAE][42-43]、两性离子聚合物[44]和树形分子[45-47]等。阳离子聚合物载体具有丰富的正电荷,可通过静电相互作用与mRNA结合形成稳定的复合物,有效保护mRNA免受核酸酶的降解,促进mRNA被靶细胞高效摄取;进入靶细胞后,大部分阳离子聚合物载体是通过“质子海绵效应”促使mRNA从内涵体逃逸到胞质中,以启动后续的蛋白质翻译过程(见图3)[15,48]。
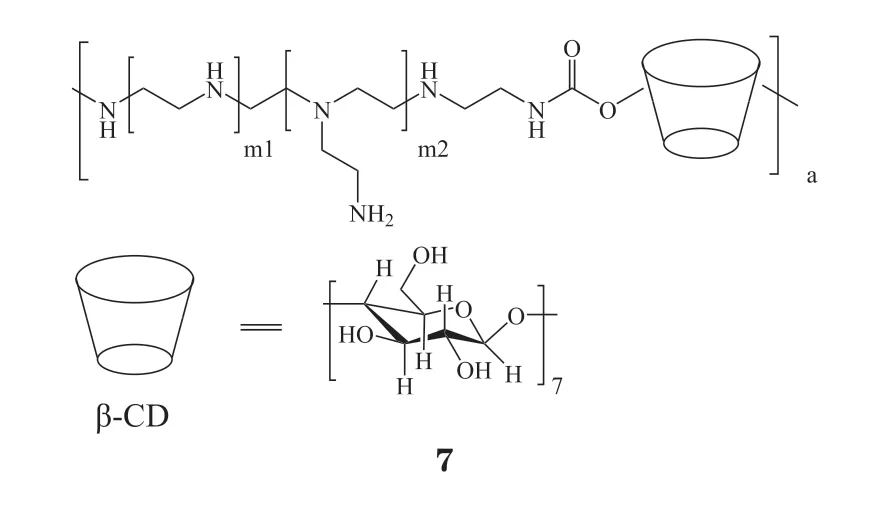
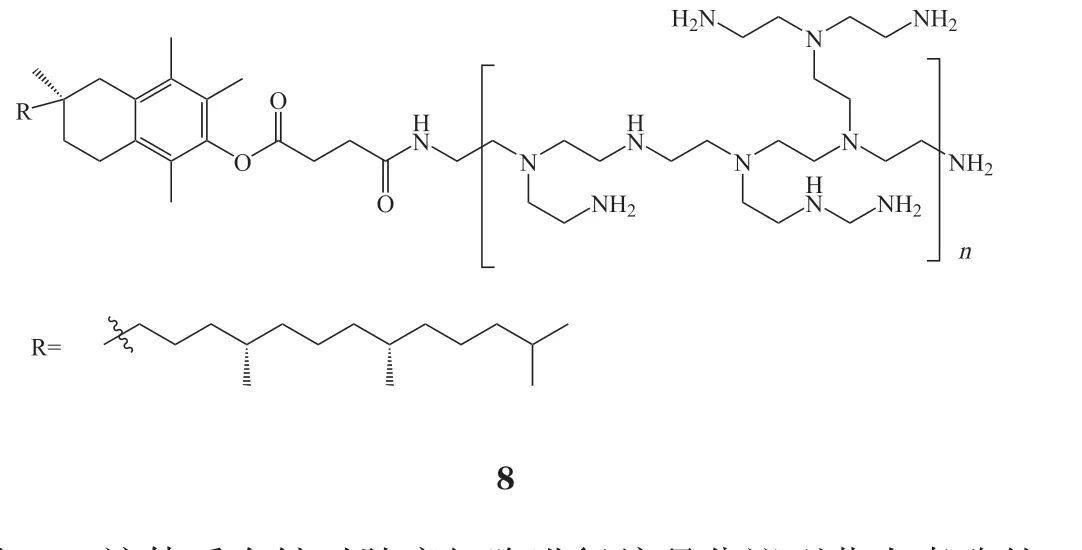
在众多开发的聚合物载体中,PEI是最早用于mRNA递送的聚合物载体,具有较好的mRNA递送能力。这主要归功于PEI结构中含有丰富的叔胺基团,具有较好的质子缓冲能力,可在内涵体酸性条件下发生质子化,促进负载mRNA快速释放到胞质发挥作用[49]。然而,通常情况下,具有高核酸递送能力的PEI多为高相对分子质量的PEI,此类PEI所携带的较高电荷密度会产生一定的细胞毒性,进而限制其进一步应用。为了应对这一挑战,研究人员采用具有低毒低效的低相对分子质量PEI代替高效高毒的PEI,通过对其进行合理化结构改造,例如利用功能化基团(如环糊精[34]和维生素E琥珀酸[35]等)对低相对分子质量PEI进行修饰,使其在拥有良好安全性的同时兼具高效的mRNA递送能力。例如,Tan等[34]设计的环糊精修饰的低相对分子质量PEI(CD-PEI2K)(7)不仅能够压缩核酸形成稳定复合物,并且能够延长体内的滞留时间,通过鼻腔给药成功将编码卵清蛋白的mRNA(ovalbumin mRNA,OVA-mRNA)递送至小鼠淋巴,激活强烈的免疫反应且未发现毒性。类似的,Ren等[35]将低相对分子质量PEI(1 800)与维生素E琥珀酸共价修饰得到共聚物PVES(8)用于递送mRNA。PVES具有优异的mRNA递送能力和良好的安全性,能成功将编码新冠病毒刺突蛋白受体结合域(SARS-CoV-2 RBD)的mRNA递送到小鼠体内产生强大的免疫反应,且未产生明显毒性,由此表明PVES是一类有潜力的mRNA疫苗递送载体。
聚氨基酸及其衍生物是一类具有良好的生物相容性的聚合物,在mRNA递送领域有着较为广泛的应用。例如,Chan等[36]设计了PEG修饰的聚天冬氨酸(PEG-PAsp)为主链的聚合物,并将不同类型的氨基乙烯重复基团共价修饰到侧链上(见图5A),促进伯胺基团与mRNA静电相互作用,有效负载mRNA形成稳定的内核,PEG作为亲水性外壳可以有效保护核酸免被降解,延长递送体系的血液循环时间和提高生物相容性。Kataoka课题组为了增加PEG-PAsp递送系统的稳定性,在主链的尾部引入疏水性的胆固醇提高了mRNA压缩能力(见图5B)[37],同时有效避免复合物在血清中解散,体内外研究发现,胆固醇修饰的PEG-PAsp能在小鼠异种移植胰腺癌肿瘤模型中成功递送编码抗血管生成蛋白的mRNA(soluble FMS-like tyrosine kinase receptor 1 mRNA,sFlt-1 mRNA),并显著抑制胰腺癌肿瘤生长。为了进一步增加胆固醇修饰PEG-PAsp的聚合物载体的稳定性与转染效率,该团队进一步在其侧链引入苯硼酸,构建一类具有三磷酸腺苷(adenosine triphosphate,ATP)响应性能的mRNA递送载体(见图5C)[38]。该体系与mRNA形成复合物时,载体结构中的苯基硼酸可与多元醇衍生的聚阳离子嵌段共聚物络合形成苯硼酸酯交联结构,提高载体与mRNA形成复合物稳定性;同时,该体系在针对肿瘤细胞进行编码分泌型荧光素酶的
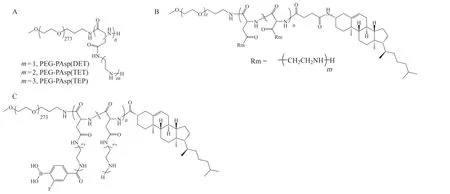
图 5 PEG-PAsp及其衍生物的化学结构Figure 5 Chemical structures of PEG-PAsp and its derivatives
mRNA(Gaussia luciferase mRNA,GLuc mRNA)递送时,肿瘤细胞内高水平的ATP可触发苯基硼酸酯键的裂解,进而加速mRNA的释放,促进GLuc蛋白的高表达,实现肿瘤细胞内高效且特异性的mRNA递送。
聚酯类聚合物因其富含生物可降解的酯键,而具有良好的生物相容性和安全性,被广泛应用于mRNA递送[41,50],如聚乳酸(Polylactic acid,PLA)[51]、聚(乳酸-co-羟基乙酸)[poly(lactic-coglycolic acid),PLGA][52]和聚氨酯等[42-43]。其中,聚氨基酯的聚合物不仅富含生物可降解酯键,还含有大量的叔胺基团,因而同时具有良好的生物相容性和质子缓冲能力,在mRNA递送领域显示出巨大的潜力[41]。如Haabeth等[53]设计合成的一系列具有电荷反转特性的寡碳酸酯-b-α-氨基酯(charge-altering releasable transporters,CARTs,9)可在原代细胞中高效递送OVA mRNA,同时与TLR配体(CpG)共负载,转染并激活淋巴细胞,诱导机体产生抗原特异性免疫反应,并用于肿瘤治疗。近期,该团队还设计了丝氨酸酯修饰的寡碳酸酯-b-α-氨基酯(Ser–CARTs)作为mRNA递送载体,寡肽的引入提高了生物相容性,并在体内特异性将Luc mRNA递送至脾[54]。此外,Patel等[55]制备的一系列超支化聚(β-氨基酯)[hyperbranched poly(β-amino ester),hPBAE,10]可有效结合mRNA,通过雾化给药方式将GFP mRNA顺利递送至肺上皮细胞,促进其细胞摄取,通过“质子海绵效应”促进其内涵体逃逸,表达绿色荧光蛋白,该体系在肺部疾病治疗中有较好的应用潜力。

树形分子是一类具有树枝状结构的特殊聚合物家族。相对于传统的聚合物而言,树形分子具有更为精确可控的结构和独特的多价协同作用,在生物医药领域极具应用前景,尤其是在核酸递送方面极具潜力[56-59]。其中,聚酰胺-胺类[Poly(amidoamine),PAMAM]树形分子是目前研究得最为深入且应用最为广泛的一类树形分子[60]。PAMAM树形分子的结构组成与多肽类似,其分子骨架中的酰胺结构使其具有良好的生物相容性,其高密度的多胺结构使其能够与核酸形成结构稳定的复合物,此外,其内部还拥有大量的叔胺基团,使其能产生“质子海绵效应”,有助于其内涵体逃逸[61-62]。这些独特的结构和性质使得PAMAM树形分子成为了一类非常有潜力的核酸药物载体,目前已经上市的商品化基因转染试剂HiPerFect的主要成分就是PAMAM树形分子。近年来,PAMAM树形分子在mRNA递送方面也展现出了独特的魅力。例如,Mbatha等[45]开发了基于PAMAM树形分子的mRNA递送系统,该系统基于第5代PAMAM树形分子(generation-five PAMAM dendrimer,PAMAM G5D)通过叶酸修饰并接枝金纳米粒子(gold nanoparticle,AuNPs)而构成;能与Luc mRNA结合形成稳定的纳米复合物,保护其不被降解,具有良好的生物安全性,成功介导了高效的mRNA转染。
为了进一步提高树形分子载体的核酸递送能力,研究人员将脂质载体与树形分子载体相结合开发了一系列两亲性树形分子[47]。该类分子由疏水烷基链和亲水树枝状结构组成,其不仅具有脂质载体的特性,还拥有树形分子载体的多价协同等特点,在核酸药物递送中颇具应用潜力[63-66]。基于此,Chahal等[46]利用脂质化两亲性树形分子与PEG化脂质共组装用于mRNA疫苗的递送。该体系具有较好的安全性,可成功将可自我复制并表达多种抗原的自扩增mRNA(self-amplifying mRNA,saRNA)疫苗递送至靶细胞,单剂量即可激活杀伤性T细胞,进而保护机体免受病毒感染,如埃博拉病毒、A型流感病毒(influenza A virus, H1N1)和刚地弓形虫等。此外,Zhang等[67]利用模块化正交设计策略合成了可电离两亲性Janus树形分子(ionizable amphiphilic janus dendrimers,IAJD)库,用于mRNA的靶向递送[68-69]。IAJD系列分子在醋酸缓冲液中即可与mRNA共组装形成稳定的单一组分纳米颗粒。初步研究发现IAJD的连接基团和疏水烷基链比例与其mRNA递送系统在体内的特异性递送密切相关,可将Luc mRNA特异性精准递送至肺、肝、脾和淋巴细胞等,如含有酰胺连接基团的IAJD110和IAJD111可将mRNA特异性递送至肺(见图6)。然而,该系列分子的组织特异性靶向机制仍需要深入研究。
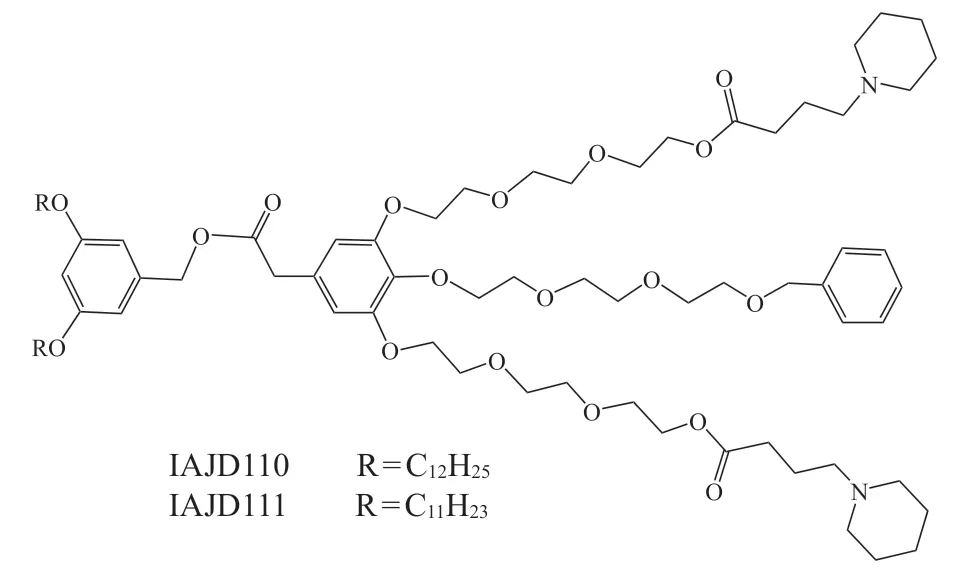
图 6 可离子化两亲性Janus树形分子的化学结构Figure 6 Structure of ionizable amphiphilic Janus dendrimers
4 结语与展望
mRNA疗法在未来生物医药领域具有巨大的应用潜力,如蛋白替代疗法、mRNA疫苗、基因编辑等。脂质载体和聚合物因其结构灵活性和功能多样性而被广泛应用于mRNA递送。两者均可通过非共价作用力有效负载mRNA形成稳定的复合物,有效增强其在疾病部位的富集,促进其被靶细胞摄取,通过细胞膜扰动或者“质子海绵效应”促进负载药物释放至胞质,从而启动靶蛋白翻译过程。更重要的是,研究人员通过对脂质载体和聚合物载体进行合理化设计,改善其安全性,赋予其病理响应激活性能和组织细胞特异性,进一步增强载体的mRNA递送效率。尽管脂质载体和聚合物在mRNA递送中已取得较好的成果,但该系列载体在开发过程中仍存在以下挑战:首先,mRNA递送载体的结构对其组织细胞选择靶向性的影响规律需进一步验证与探究;其次,mRNA递送载体的体内安全性、体内稳定性和药代动力学行为需要进一步深入研究;最后,针对mRNA在不同疾病中的应用需求,迫切需要开发疾病特异性按需递送的新型mRNA递送载体。总之,脂质载体和聚合物在mRNA输送中极具潜力,但其进一步的临床应用仍任重道远,迫切需要分子生物学、药学、材料化学、纳米科学等多学科联合攻关。希望本文为mRNA递送载体的合理设计提供一定的参考和帮助。

