mRNA疫苗创造的经济与社会价值分析
华挺,吴昊泉,徐松林
(1.财通证券股份有限公司研究所,上海 200120;2.杭州康霖生物有限公司,浙江 杭州 310018;3.浙江海昶生物医药技术有限公司,浙江 杭州 310023)
新型冠状病毒肺炎(Coronavirus disease 2019,COVID-19)病毒及其变异株目前仍在全球范围内蔓延,给人类生命健康带来了巨大威胁。面对这样的一场突如其来的疫情,COVID-19 疫苗的出现帮助遏制了疫情的蔓延,降低了患者的死亡率与感染率。特别值得注意的是,在与COVID-19疫情对抗的过程中,信使RNA(message RNA,mRNA)疫苗作为一种革命性疫苗进入了公共视野,在抗疫过程中发挥了举足轻重的作用,使得这一种全新的技术快速进入了商业化并为全球大部分民众所熟知。
本文将介绍mRNA疫苗在传染病及肿瘤等领域的研究现状、产生的经济价值以及未来巨大的前景,并深入分析mRNA疫苗如何带动上下游相关产业创新升级与基础科研的发展,mRNA疫苗产业的发展,将有助于保障我国产业链的安全,具有一定的社会价值。
1 mRNA疫苗的疗效
在本次COVID-19疫情中,2种COVID-19 mRNA疫苗[Moderna(mRNA-1273)和Pfizer/BioNTech(BNT162b2)]均显示出明确的安全性,有效性高达90% ~ 95%[1]。在实际应用中,注射了mRNA疫苗的患者,病毒RNA载量低于未接种疫苗者,并且COVID-19病情较轻、病程较短[2]。同时,根据一项来自圣路易斯华盛顿大学医学院等机构的研究表明,mRNA疫苗可以诱发持久的生发中心反应,较之于传统疫苗有望提供更为持久的免疫保护[3]。mRNA疫苗能够展现出如此杰出的性能,主要得益于mRNA疫苗可以诱导强烈的先天与适应性免疫,作用机制保证了其在疗效上的巨大优势,确保了其有效性与安全性,同时提供持久免疫保护效果,可减少疫苗的注射数量与频次,以全球有条件接种新冠疫苗人口为40亿计算,每年将节约巨大的疫苗成本与社会医疗资源。除此之外,由于mRNA疫苗(含脂质体)具有自佐剂的效果,可以更好地调动机体免疫,免除了佐剂研发的巨大时间与资金投入。
2 mRNA新冠疫苗具有的研发与生产成本优势
相比其他技术路线的疫苗,mRNA疫苗具有显著的成本优势。通过对mRNA疫苗的生产成本分析,可以更直接地了解mRNA疫苗相对于传统疫苗的生产优劣势(见表1)。
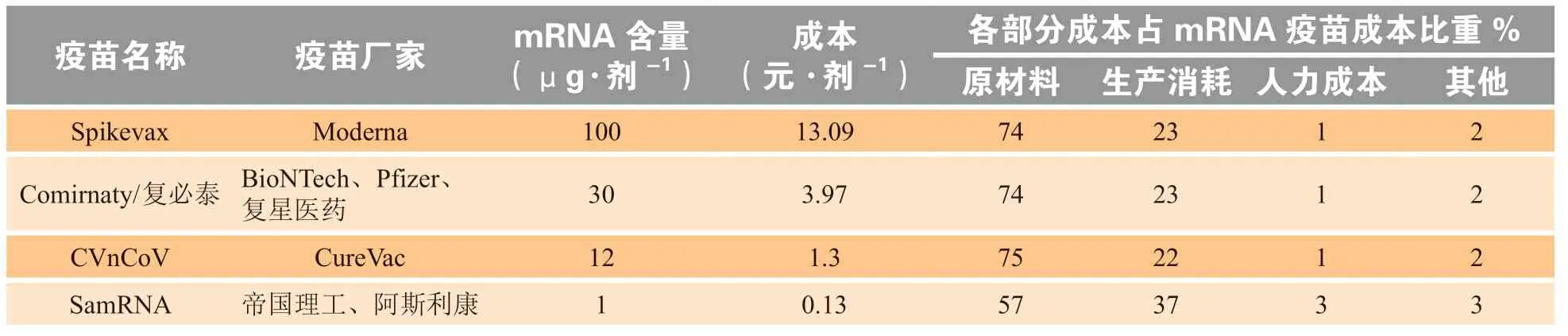
表 1 几种主要类型mRNA疫苗成本分析[4]Table 1 Cost analysis of several major types of mRNA vaccines
由表1可见,尽管同为mRNA疫苗,但不同厂家每剂疫苗所含mRNA含量以及生产成本均不同,其中Moderna、BioNTech、CureVac、帝国理工(Imperial College London,IC)每剂分别含有100、30、12和1 μg mRNA。根据以下假设对不同mRNA疫苗成本做出估算:1)使用30 L生物反应器生产,反应器滴度达到5 g · L-1;2)下游纯化和制剂过程中消耗比例为44%;3)生产失败率为5%;4)5′端帽子和三磷酸尿苷(uridine triphosphate,UTP)采购价格分别为每克3 000和4 700美元;5)劳动力工资为每小时20美元;6)每年生产450批次[4],得到Moderna、BioNTech、CureVac、帝国理工每剂疫苗成本分别为13.09、3.97、1.3和0.13元人民币,其中原材料在Moderna、BioNTech、CureVac疫苗中成本占比约为75%左右,在帝国理工苗中占比仅为57%。
就产能而言,Pfizer/BioNTech计划在2021年底生产13亿剂疫苗(BNT162b2,每剂30 μg),其生产线主要使用30 L生物反应器[5]。Moderna则计划到2021年底产能从8亿剂增加到10亿剂,并在2022年增加至30亿剂,同时Moderna还计划增加用于儿童的新冠疫苗,mRNA含量为成人疫苗的一半(每剂50 μg)。产能得以迅速增加的原因在于Moderna达成与多个生产商的合作,除了原本的供应商,Lonza、Recipharm、三星、赛默飞也都与Moderna达成合作[6]。由此可见,mRNA疫苗产能的平行放大相对较易实现。
相比其他技术路线的疫苗,mRNA疫苗具有显著的成本优势。灭活、减毒等传统技术路线的疫苗,不计入其P3级别厂房建设成本,其疫苗每剂成本大致范围为5 ~ 12元,其中原料占据30% ~ 40%,人力成本占到20%。因此与传统疫苗相比,mRNA疫苗成本具有一定优势;且当每剂mRNA含量仅为1或0.1 μg的疫苗上市后,mRNA疫苗成本有望下降1 ~2个数量级;此外,该成本估算建立在30 L生物反应器条件下,当后续产能扩大至50 L生物反应器,其每剂成本将进一步下降,相较于传统疫苗,存在显著的成本降低优势。与同样为创新技术路径的腺病毒疫苗相比,mRNA疫苗的成本优势也依然存在,以康希诺的重组新型冠状病毒疫苗克威莎TM为例,参考其政府采购价格以及财报中披露的利润率推测其成本约为13.34元左右[7],略高于传统疫苗的5 ~12元和mRNA疫苗的0.028 ~ 13.09元。
除了成本优势外,mRNA疫苗还具有其他显著优势:1)mRNA疫苗的生产过程较短且易于监控,生产效率较高;2)针对新病毒或变异株的产品开发时间短,mRNA疫苗生产平台一旦建设完成后,后续其他产品的开发只需要更换mRNA的片段,生产基本无需变动,周转时间快;3)mRNA疫苗生产流程具有较强灵活性,使用一次性生产设备可以使得生产线进行快速的切换,同样的生产流程可以用于生产一系列靶点不同的mRNA疫苗,因此产线也可以用于生产其他疫苗或临床试验阶段的产品,产线利用率较高。
3 mRNA疫苗的更多应用可创造经济收益
mRNA疫苗的应用场景远不止用于新型冠状病毒肺炎的防控,针对其他传染病、肿瘤等疾病的mRNA疫苗也都在积极探索中[8]。
3.1 mRNA疫苗在传染病预防中的经济价值
如前所述,mRNA疫苗可以刺激机体的免疫系统产生多种机制的免疫反应,以达到预防流行性疾病的作用,加之由于其研发、生产与放大具有传统疫苗难以企及的便利性,其快速反应能力将在未来传染病的预防中起到极大的作用。对于那些变异快、容易导致传统疫苗效果降低的传染性疾病,mRNA可以帮助一个国家或地区在较短时间内实现特异的免疫屏障,创造出巨大的经济价值。其中,流感病毒、狂犬病病毒、埃博拉病毒、人呼吸道合胞病毒(respiratory syncytial virus,RSV)、寨卡病毒等病毒引发的传染病是mRNA疫苗极具潜力的发展方向。
使用mRNA技术进行传染病治疗的第一项研究是针对人类免疫缺陷病毒(human immunodeficiency virus,HIV)的,尽管疫苗具有安全性[9],但使用基于树突状细胞(dendritic cells,DC)和裸露mRNA的Ⅰ期和Ⅱ期临床试验结果并不十分理想,临床结果表明缺乏针对 HIV的有效免疫反应[10]。
狂犬病是mRNA疫苗发展的一大热点,CureVac公司在2017年公布的狂犬病G糖蛋白mRNA临床试验显示,通过无针装置接种疫苗的患者会产生高于WHO预定滴度(≥0.5 IU · mL-1)的抗体[11]。CureVAC 基于之前的临床试验,于2018年开展了第2次狂犬病mRNA疫苗的Ⅰ期临床试验,评估一种基于脂质纳米粒(lipid nanoparticle,LNP)递送系统的新配方mRNA疫苗[12]。
流感病毒的疫苗制作一直受制于病毒本身的高变异性,而mRNA技术非常适合克服这一问题。对于流感的免疫研究首次证明了mRNA疫苗在动物模型(小鼠、雪貂和猪)中对抗传染病的功效[13]。针对H10N8和H7N9的基于LNP的疫苗目前正在Ⅰ期临床试验评估中,在针对H10N8的mRNA疫苗实验中,23名受试者在第2次接种后的3周,都产生了血凝素抑制(hemagglutination inhibition,HAI)抗体,且87%的受试者产生了不低于1∶20的病毒中和抗体;在另一项针对H7N9的临床试验中,在第2次接种后的3周,低剂量组中有96.3%的受试者产生了不低于1∶40的HAI抗体,而在高剂量组中,89.7%的受试者产生了不低于1∶40的HAI抗体[14]。mRNA疫苗在预防流感病毒感染的临床试验中,显示其具有良好的安全性且可以激发机体的免疫反应。
对于其他传染病,mRNA 疫苗也显示出极大的应用潜力。例如寨卡病毒一直是mRNA疫苗应用的重点关注领域。在编码寨卡病毒跨膜E蛋白的mRNA疫苗临床前试验中,高、低剂量组中的小鼠与恒河猴均产生了抗原特异性抗体,且2种动物体内特异性抗体水平都至少维持了4周[15]。Moderna公司于2022年2月宣布RSV疫苗已准备启动Ⅲ期临床试验,针对寨卡病毒、基孔肯雅病毒的Ⅰ期临床试验和针对人类巨细胞病毒的Ⅱ期试验正在进行中。
新冠疫情暴发以来,全球人民愈发认识到了传染性疾病可能带来的重大公共卫生风险:不仅会给全人类的健康造成巨大威胁,而且对于经济社会活动带来了巨大的冲击。从本次疫情可以看出,突发性传染病的暴发可能会造成大范围的货物、资本、人员的流通停滞,而这些都是经济高速增长的基础。因此,研发具有快速响应能力且能高适应性地针对病毒变异的疫苗,将为社会经济稳定做出突出贡献,研发疫苗的企业也将获得良好的经济回报。
mRNA传染病疫苗对于企业经济效益的收益,不妨以临床进度较前且研究较为充分的流感疫苗为例进行分析。现做如下假设:1)假设流感疫苗主要在经济较为发达地区接种与使用,主要目标人群(含儿童)人口约30亿;2)假设流感疫苗的接种比例与美国疾病控制与预防中心(Centers for Disease Control and Prevention,CDC)统计的2019年流感疫苗成年人接种比例大体相当,约占目标人群的48.3%[16];3)假设流感mRNA疫苗获批,可占流感疫苗批签发总数的40%;4)假设流感mRNA疫苗的定价参照BioNTech的mRNA新冠疫苗定价,定价为19.5美元[17],且未来随着生产技术与工艺的成熟、产能的不断完善,疫苗价格也会降低约40%,最终流感mRNA疫苗的定价每剂约12 美元,按照实时汇率1美元兑换6.48元,每剂约为78元。若流感疫苗每年注射1剂,则流感mRNA疫苗每年可为mRNA企业创造约452亿人民币(30亿×48.3%×40%×78)的收入。
mRNA疫苗可为研发企业带来巨大的经济效益,这点也在新冠疫情中mRNA疫苗企业的收入上得以体现。2022,辉瑞-BioNTech合作的COVID-19疫苗Comirnaty在2021年销售额为367.8亿美元[18];同样的,Moderna的COVID-19疫苗Spikevax在2021年销售额为176.75亿美元[19]。
从对社会的经济效益来看, mRNA的生产制造涉及到产学研各个环节,通过对上下游产生的带动以及创新的涟漪效应,mRNA疫苗也可以为社会经济发展带来巨大的贡献。一般而言,生物医药的社会经济效益主要包括3类:直接影响(即生物医药企业的直接产出,销售额)、间接影响(生物医药企业的销售对上下游供应商及流通企业的影响)以及诱发影响(即生物医药企业以及上下游供应商、流通企业的员工,给社会经济带来的影响)。根据美国药物研究和制造商协会(PhRMA)所做的统计,2014年,药企每单位销售收入,可以带来约2.18单位的整体社会经济产出提升[20]。同样以流感mRNA疫苗为例,若该疫苗研发成功,参照上述假设,若流感mRNA可直接产生452亿元的销售额,则总共可为社会经济带来约985亿元的产出。
从卫生经济学角度分析,推广疫苗接种同样具有成本效益。由于各国医疗水平与成本存在显著差异,以我国流感情况为例,假设流感的发病率为6%,因流感住院率为1.63%,死亡率为0.075%,门诊、住院费用与接种费用分别为498、6 716和60.6元,流感、住院与健康效用值分别为0.5、0.21和0.76。对于平均预期剩余寿命18.74周岁的65岁以上老年人群进行流感疫苗接种的成本效果分析显示,如果流感疫苗接种率从目前的1.10% 提高到20%,增量成本效果比为 -718元每质量调整寿命年(adjusted life year,QALY),即在节约 -718元的情况下还可增加1个QALY[21]。若按每剂mRNA流感疫苗78元且能提供更高的保护效率考量,mRNA流感疫苗具有显著的社会成本效益。
3.2 mRNA肿瘤疫苗的经济价值
mRNA疫苗已成为肿瘤免疫治疗和预防中一种极具潜力的治疗方式。靶向肿瘤相关抗原(tumorassociated antigen,TAA)或肿瘤特异性抗原( tumor specific antigen,TSA)的疫苗导入患者体内后,可以激活B细胞和T细胞产生免疫反应,作用于对应的肿瘤细胞。相较于其他肿瘤疗法,mRNA肿瘤疫苗平台具有独特的优势:1)允许同时递送多种TAA或体细胞肿瘤突变的抗原,引发体液和细胞介导的免疫反应;2)mRNA可以编码全长肿瘤抗原,能刺激更广泛的免疫反应;3)安全性良好;4)安全易管理、可快速开发、制造成本低。
mRNA肿瘤疫苗在展现出临床潜力的同时,其经济上的价值也值得关注。作为一种新型疗法,mRNA疫苗相对于其他细胞与基因治疗产品,具有生产放大便捷性与成本优势。以进展最快的肿瘤疫苗为例,Moderna和BioNTech分别有一款肿瘤mRNA疫苗进入Ⅱ期临床:mRNA-4157和BNT122,适应证分别为实体瘤和黑色素瘤,均为编码特异性抗原的肿瘤疫苗。已上市的其他基因/细胞疗法,如嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell,CAR-T)等,目前的治疗价格动辄上百万[22],为患者及社会带来极大的经济负担[23]。例如CAR-T海外定价为30 ~ 40万美元,国内(奕凯达/Yescarta)定价约为120万元左右。CAR-T产品需要针对患者个性化地进行细胞提取、改造、体外培养、回输等一系列过程,难以进行放大生产,因此单品成本难以降低;mRNA肿瘤疫苗尽管编码患者个性化抗原,但完成个性化序列设计后的合成、生产步骤均为标准化过程,单品成本具有显著成本优势。若将来mRNA疫苗能在临床上产生类似于CAR-T疗法的替代效果,或者将mRNA与CAR-T结合,提高CAR-T的安全性并降低生产成本,将更加凸显CAR-T疗法在卫生经济学上的成本效益。
以Gilead/Kite公司开发的Yescarta(axicabtagene ciloleucel,国内由复星医药引进并进行商业化,产品为阿基仑赛注射液TM)为例,最早于2017年10月首次被批准用于治疗至少两种其他疗法失败后的成人大B细胞淋巴瘤,定价为每剂37.3 万美元。根据相关研究显示,CAR-T治疗提高的QALY比其他抗肿瘤药物干预平均多5.03 年,比非药物治疗干预平均多4.61年,同时保持着相似的成本效力比[24]。若mRNA疗法与CAR-T结合或替代CAR-T,能够降低CAR-T疗法的成本50%,将使得抗肿瘤药物的成本效力比也降低50%,有望在同适应证下成为绝对优势策略,显著降低社会经济负担。
4 mRNA疫苗可带动产业创新升级
mRNA疫苗除了自身可带来巨大的商业化价值外,还可带动上下游相关产业的发展。作为一门新兴产业,从产业链上看,以mRNA新冠疫苗为例,其从靶点发现到成药再到终端销售,大体经历过程:测序得到目的基因序列→构建DNA质粒载体→体外生物合成mRNA→LNP包裹mRNA→纯化LNP-mRNA→mRNA制剂→mRNA流通运输等多个环节,涉及到材料学、生物信息学、药剂学、工程学等多学科协同,涉及到高校实验室、原材料、设备供应商、代工生产服务商、制药公司以及流通企业。作为一门新兴产业,可带动大量相关学科发展,具有巨大的产业链价值。
从产业链具体涉及的原材料与设备来看,mRNA疫苗产业具有综合带动效应,可带动大批上下游需求(见表2)。如靶点筛选与发现阶段会涉及核酸提取、反转录、聚合酶链反应(polymerase chain reaction,PCR)、二代测序文库、蛋白质谱分析等,生产阶段会涉及到质粒DNA模板,T7聚合酶、无机焦磷酸酶、核糖核酸酶抑制剂、加帽酶、甲基转移酶、多腺苷酸聚合酶、核酸内切酶等在内的多种酶以及底物核苷酸等,纯化步骤则涉及切向流过滤(tangential flow filtration,TFF)、杂交亲和层析以及阴离子交换层析等多个步骤。在物流运输过程中,由于mRNA疫苗运输条件相对苛刻,对于冷藏车辆、冷链包装、存储冷库等均有较高的要求。因此,mRNA疫苗产业链对于上下游材料与设备具有较高的要求,且相应物料具有较高的科技含量与技术水平,整条mRNA产业链可以催生出巨大的上下游产业链升级需求,并带动相应企业的技术升级与转型。
同时,mRNA疫苗作为一门新兴学科,其快速发展也将提升包括RNA信息学、RNA结构生物学、药剂学、转化医学等在内的众多基础科研领域的研究热情,带动相应基础科研的蓬勃发展(见表3)。
并且,mRNA疫苗相对清晰的作用机制与便利的放大生产能力,具有较大的科研成果转化潜力,对我国持续创建健全创新体系,完善产业创新生态,推进创新产品的开发和产业化,促进医药工业发展向创新驱动转型具有推动作用。因此,为了促进药物创新发展,2016年后,我国不断出台政策鼓励创新药研发,包括mRNA药物在内的行业不断发展,技术研究不断深入(见表4)。疫情后,我国在《“十四五”医药工业发展规划》中也重点指出,“支持企业整合科技资源,围绕药品、医疗器械生产的关键技术、核心装备、新型材料开展攻关,开发和转化应用一批先进技术,构筑产业技术新优势。”在生物药技术中,重点发展核酸疫苗等新型生物药的产业化制备技术,将mRNA疫苗的价值提高到了一个新的层面[25]。
应当认识到,mRNA领域的研究也可以促进跨学科与基础科学的发展。mRNA疗法与目前现有的大多数疗法及细胞、基因治疗并不冲突,且可能产生协同作用。如通过mRNA转导的CAR-T细胞可以避免基因整合的致癌风险并降低细胞因子风暴的发生;由于传统碱基编辑器如规律成簇间隔短回文重复(clustered regularly interspaced short palindromic repeats,CRISPR)-CRISPR相 关 蛋 白9(CRISPR associated protein 9,Cas9)中核酸编辑酶长期存在,可能会加大脱靶效应产生风险,而体外转录mRNA(in vitrotranscription mRNA,IVT mRNA )的表达时间一般被认为是短暂的,通过IVT mRNA编码相应核酸编辑酶可以最小化脱靶风险。目前,IVT mRNA用于基因编辑的可行性在体内和体外都已经得到了广泛验证:通过新型两性离子氨基脂质(zwitterionic amino lipids,ZAL)递送系统将Cas9 mRNA(含有4 500个核苷酸)和sgRNA(含有100个核苷酸)静脉注射到小鼠体内,实现DNA靶向编辑;通过电穿孔将ZFN mRNA和腺相关病毒(AAV)血清型6载体转入人类造血干细胞、祖细胞(Hematopoietic Progenitor Cells,HPCs)和T细胞,也可以有效实现对这些细胞的基因组编辑。这些研究,可以有效促进不同学科之间的跨学科研究,起到更为深远的影响。

表 2 mRNA疫苗生产涉及的主要原材料及设备Table 2 Main raw materials and equipment involved in mRNA vaccine production

表 3 mRNA涉及诸多学科Table 3 mRNA-involved disciplines

表 4 近年来我国鼓励mRNA相关领域创新发展的政策Table 4 Policies to drive innovation in mRNA-related fields

续表4
5 mRNA疫苗国产化有利于提升产业链稳定性
在当前国际关系处于“百年未有之大变局”的背景下,解决生物医药“卡脖子”问题是保证我国制药供应链安全可控的重要环节,特别是《十四五医药工业发展规划》中强调我国要具有国际化视野的研发创新能力,国际高水准生产能力的持续提升,保障完善供应保障体系[25]。发展mRNA疫苗的过程,也是我国从“制药大国”向“制药强国”迈进过程中不可缺失的一环,然而受制于我国生物医药发展起步晚、部分学科仍相对薄弱,我国药物研发生产过程中时常会遭遇关键原材料与关键设备“卡脖子”的问题,这是我国需要重点克服的领域。在mRNA疫苗产业链中,涉及的酶、层析填料、磁珠、一次性反应器、膜材等都是当前我国生物医药产业需要重点实现国产化的领域,促进mRNA疫苗产业的发展,将极大地促进我国生物医药产业链的发展、提升自主可控性,有助于保障我国产业链的安全。
特别是在新冠疫情中,全球产业链受到疫情冲击,许多设施设备厂商无法正常供货,且许多国家产品优先供应本地需求,使得促进我国mRNA疫苗相关产业链自主可控更显必要。并且,推进mRNA疫苗产业链的国产替代,除了可促进产业链创新升级外,还有利于发挥我国作为制造业大国与强国的优势,降低mRNA疫苗的成本,减轻疫情防控相关成本。
目前,我国本土企业已积极参与到mRNA疫苗产业链的上中下游(见图1),其中中游制剂制造厂商的产品取得了一定突破,有4款基于mRNA疫苗技术研发的针对COVID-19的国产疫苗已经进入临床(见表5),其中沃森生物/艾博生物合作的mRNA新冠疫苗进展最快,目前已进入Ⅲ期临床最后病例收集阶段,且在国内开展了灭活疫苗序贯接种临床试验;2022年1月于《柳叶刀》子刊公布其Ⅰ期临床结果。其他3款目前仍处于Ⅰ期临床阶段。此外,针对上游生产的“卡脖子”问题有所缓解,如脂质和帽子结构的专利、GMP(Good Manufacturing Practice of Medical Product,药品生产质量管理规范)级别质粒供应、测序设备等均有本土企业苦心攻关,如专注于序列设计和基因测序的吉玛基因、圆壹智慧、赛福基因,专注于细胞和基因治疗设备和实验室整体解决方案的赛桥生物和泰林生物,提供本土化上游试剂和一次性耗材的瀚海新酶、近岸生物、兆维科技、翌圣生物和乐纯生物等。相信随着“卡脖子”环节的不断突破、产业链的本土化,终端产品制造成本一定会不断下降,使得mRNA技术真正可以“飞入寻常百姓家”,将其自身的科学价值转化成为利国利民的社会价值。
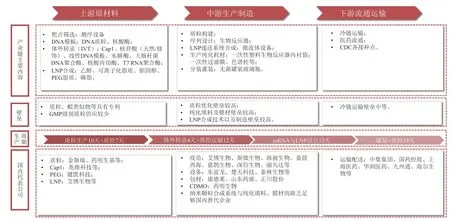
图 1 我国mRNA上下游产业链Figure 1 China's mRNA upstream and downstream industrial chain

表 5 国产mRNA疫苗领先企业进展情况Table 5 Progress of leading domestic enterprises of COVID-19 mRNA vaccines
6 结语和展望
在过去的20年里,mRNA领域发展迅速,为包括传染病、癌症在内的多种疾病创造了一种安全且有吸引力的治疗选择。相较于传统大分子生物药物,mRNA具有快速开发能力、高效力、安全性和制造成本低的优势,显示出作为下一代生物药物的前景。mRNA疗法作为一种全新的疗法,其技术特点决定了其具有巨大的经济潜力,无论是对具体企业的收入还是社会经济稳定的贡献,mRNA药物都能带来巨大且稳定的贡献。mRNA疫苗除了自身可带来巨大的商业化价值外,还可带动上下游相关产业的发展,促进不同学科之间的跨学科研究,对我国创建持续健全创新体系,完善产业创新生态,推进创新产品的开发和产业化,促进医药工业发展向创新驱动转型具有推动作用。推进mRNA疫苗产业的发展,将极大地促进我国生物医药产业链的发展、提升自主可控性,有助于保障我国产业链的安全。 相信,未来mRNA药物将会开创全新的生物医药格局,和抗体药物一样,将为相关产业和社会带来巨大的获益。
致谢:赵孝斌博士,浙江海昶生物的董事长、CEO;沈栋博士,RNAimmune(达冕生物)创始人、总裁;杨海涛博士,上海瑞羿奥纳生物医药有限公司董事长。

